体外诱导人骨髓间充质干细胞向肝系细胞分化过程中的基因表达谱变化
2013-03-09张慧霞樊红琨段芳龄
李 蔚,张慧霞,樊红琨,段芳龄,马 军
1.郑州大学基础医学院生理学教研室,河南郑州450001;2.郑州大学第一附属医院消化内科;3.郑州大学消化疾病研究所
近年发现骨髓间充质干细胞(MSCs)可向肝系细胞分化,成为临床上进行肝系细胞移植治疗肝脏疾病的潜在种子细胞。本课题在体外用HGF+FGF-4培养人骨髓间充质干细胞向肝系细胞分化,运用微阵列技术对分化过程中的基因表达谱进行筛选,分析发生表达变化的基因,以期了解与人骨髓间充质干细胞向肝系细胞分化相关的基因及它们之间的相互关系,揭示人骨髓间充质干细胞向肝系细胞分化的分子机制。
1 材料与方法
1.1 hMSCs的分离和培养 健康志愿成人胸骨穿刺无菌抽取骨髓2~4 ml,重悬于等量PBS中;将稀释后的骨髓细胞叠加到等体积的淋巴细胞分离液(密度1.077),离心;沿管壁抽取含有MSCs的灰白色细胞层的全部细胞,分别用作细胞计数、免疫组化和抽提RNA,并留取部分细胞加入含有10%胎牛血清的LDMEM培养基中,吹打成单细胞悬液,以2×105/cm2的密度接种于25 ml培养瓶中,37℃、5%CO2饱和湿度常规培养。
3 d后首次换液,除去未贴壁细胞,更换新鲜的培养液,以后每3~4 d换液1次,待细胞生长至瓶底90%融合时,用0.25%胰蛋白酶消化,胎牛血清终止,传代培养。
1.2 hMSCs的诱导培养 第3代hMSCs到达对数生长期后,接种于铺有鼠尾胶原处理爬片的24孔培养板中。改用含 5%FBS、1×ITS、4.7 μg/ml亚油酸、1 mg/ml BSA、5×10-9M/L地塞米松、10-4M/L抗坏血酸、100 U/ml青霉素、100 U/ml链霉素以及10 ng/ ml EGF的DF培养基培养,加入HGF(20 ng/ml)+ FGF4(15 ng/ml)。每4 d换液1次,37℃、5%CO2饱和湿度常规培养。连续诱导培养28 d,应用免疫细胞化学和糖原染色方法分别检测诱导后的细胞表型和功能。
1.3 正常人肝细胞株L-02的培养 用不含生长因子的诱导培养基把正常肝细胞株接种到预铺有鼠尾胶原的25 cm2的塑料培养瓶中,接种密度为3×105/ml。常规培养和换液。
1.4 肝系细胞的分析和鉴定 免疫细胞化学检测:留取的细胞爬片用4%多聚甲醛室温固定;0.3%TritonX-100处理;过氧化物酶阻断溶液室温下孵育;滴加正常山羊血清封闭液;加一抗:CK18工作液、AFP工作液、白蛋白工作液,4℃过夜;加生物素标记的二抗,室温下孵育20 min;加过氧化物酶标记的卵白素;加新配制的DAB显色5~10 min;苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。
PAS染色:留取的细胞爬片分别用Carnoy固定液固定10 min;1%过碘酸水溶液反应10 min;Schiff试剂反应30 min;2%甲基绿复染20 min;梯度酒精脱水,二甲苯透明,中性树胶封片。
RT-PCR:应用RT-PCR技术检测肝系细胞中的白蛋白,TRIZOL法提取RNA,逆转录按试剂盒说明书进行。应用Oligo 6.0软件设计引物并由上海生物工程技术服务有限公司合成,具体如下:
引物序列产物长度退火温度ALB 5'-TGCAAGAA TGTGCTGATGATGACAGGG-3',162 bp 58℃,5'-AAGGCAAGTCAGCAGGCATCTCATC-3',GAPDH:5'-GGTGAAGGTCGGAGTCAACG-3',500 bp 58℃,5'-CAAAG TTGTCATGGATGGACC-3',PCR反应体系 10×buffer 2.5 μl,Taq酶0.125 μl,dNTPs(10 mmol/L)0.5 μl,上游引物(276.5 pmol/L)0.27 μl,下游引物(271.5 pmol/L)0.276 μl,cDNA模板1 μl,去离子水20.329 μl,总体积 25 μl。循环条件:94℃预变性3 min→94℃变性30 s→58℃退火30 s→72℃延伸45 s,总共30个循环后72℃延伸3 min。
1.5 PCR结果的判定 分别取PCR产物5 μl上样,6 μl DNA ladder作参照。用1.5%琼脂糖跑电泳,紫外投射仪下观察。
1.6 微阵列分析 取诱导培养28 d的细胞和未诱导细胞进行微阵列实验,采用H-80S基因表达谱芯片(上海博星生物芯片有限公司协助完成)。其实验和数据分析方法如下:
苯酚氯仿试剂盒抽提诱导细胞和未诱导细胞总RNA,荧光标记(CY5标记诱导细胞,CY3标记未诱导细胞,后者作对照组),cDNA芯片的制作和基因杂交。ScanArray4000扫描仪(美国packard公司)扫描芯片,图像处理软件:Genepix Pro 3.0图像处理软件分析Cy3和Cy5两种荧光信号的强度和比值,经内参基因的标准化。以Cy3和Cy5的比值>2或<0.5,Cy3和Cy5均>200或其中之一>800,认为基因表达有差异。1.7 统计学处理 应用SPSS 17.0统计软件进行统计学处理,计数资料采用χ2检验和Fisher精确概率法,以α=0.05作为有统计学意义的判断水准。
2 结果
2.1 骨髓间充质干细胞分离培养 新鲜分离的骨髓细胞性状良好。培养3周左右骨髓间充质干细胞接近融合,细胞排列成旋涡状或辐射状,胞体中央膨大为扁圆形的细胞核,可见1~2个核仁(见图1)。
2.2 诱导培养后肝系细胞的鉴定
2.2.1 AFP免疫细胞化学检测结果:AFP细胞诱导0 d时未见表达。诱导7 d时AFP高表达,14 d时AFP表达率降低(P<0.05),21 d及28 d时AFP为阴性。不加一抗对照为阴性结果(见图2)。
2.2.2 CK18免疫细胞化学检测结果:CK18在细胞诱导0 d时未见表达。诱导7 d时有少数细胞呈阳性表达,随着诱导时间的延长,表达率逐渐增高(P<0.05)。不加一抗对照为阴性结果(见图3)。
2.2.3 白蛋白免疫细胞化学检测结果:白蛋白在细胞诱导0 d时未见表达。诱导7 d时有少数细胞呈阳性表达,随着诱导时间的延长,表达率逐渐增高(P<0.05)。不加一抗对照为阴性结果(见图4)。
2.2.4 PAS糖原染色结果:细胞诱导0 d、7 d时糖原染色结果为阴性,诱导14 d时开始有少数细胞糖原染色为阳性,21 d、28 d时表达率逐渐增高(P<0.05,见图5)。
2.2.5 白蛋白RT-PCR结果:细胞培养0周白蛋白mRNA为阴性表达,1、2、3、4周均为阳性表达,且表达程度逐渐增高(见图6)。
2.3 骨髓间充质干细胞和肝系细胞的基因表达差异分析 结果显示121条基因表达发生变化,其中89条基因上调,32条基因下调。
3 讨论
本实验采用HGF、FGF4诱导人MSCs向肝系细胞分化,所诱导的细胞表达肝系细胞特异性表面标志并具有肝脏合成糖原的功能,有望成为干细胞为基础的肝脏疾病治疗的种子细胞。
微阵列技术以其高度信息集约化、平行化以及高效、快速、高灵敏度等优点,被推广运用于基因表达谱、疾病诊断、药物筛选、新基因寻找、基因分型、基因突变等领域[1]。本实验运用微阵列技术对人骨髓间充质干细胞向肝系细胞分化的基因表达谱进行研究和筛选,分析表达变化的基因。
实验结果显示,121条基因表达发生了变化,其中89条基因上调,32条基因下调。这些基因涉及信号转导、能量代谢、基因转录、蛋白质翻译与合成等。由于肝脏在物质代谢中具有重要作用,我们认为血清和糖皮质激素调节蛋白激酶(serum and glucocorticoid regulated protein kinase,SGK)等可能在骨髓间充质干细胞向肝系细胞分化过程中有重要意义。


图6 培养不同时间人骨髓间充质干细胞中白蛋白核糖核酸的表达 M:Marker;0:培养0周;1:培养1周;2:培养2周;3:培养3周;4:培养4周;阳:阳性对照Fig 6 Expression of album in RNA in hMSCs cultured 0~4 weeks M:Marker;0:cultured 0 week;1:cultured 1 week;2: cultured 2 weeks;3:cultured 3 weeks 4:cultured 4 weeks;Positive:positive control
SGK基因:研究表明,SGK可能是多种细胞信号传导通路和细胞磷酸化级联反应的一个功能性交汇点[2-3],在调节离子通道、细胞存活和凋亡的信号传导中起重要作用。
SGK受多种生长因子刺激激活而促进细胞存活、抑制细胞凋亡。在人乳腺上皮细胞中激活糖皮质激素受体,能够迅速诱导SGK,从而启动一个抗凋亡的信号传导途径;而在无生长因子作用下,异常的SGK表达能够抑制细胞凋亡。而丧失激酶活性的SGK在细胞中表达,拮抗糖皮质激素受体激活导致的对细胞凋亡的抑制作用。这些实验结果提示,SGK是糖皮质激素受体介导的细胞存活信号传导中一个重要的下游应答底物。其快速敏捷的转录水平上的调控使其与其他细胞存活激酶相比具有明显区别[4]。
SGK可经HGF刺激激活而促进细胞存活、抑制细胞凋亡。Shelly等[5]利用表皮细胞系MDCK细胞进行研究,发现HGF能够激活SGK基因,而且认为SGK的活化可以通过涉及到细胞存活的调节、细胞与细胞和细胞与基质相互作用的信号转导途径来完成。我们的实验应用含有生长因子HGF+FGF4的DMEM-F12培养基诱导骨髓间充质干细胞向肝细胞分化,并证实已分化细胞具有肝系细胞特征,而且SGK基因在我们的实验中明显上调,因此本实验表明SGK基因可能在该培养体系诱导的骨髓间充质干细胞向肝系细胞转分化中,因HGF的作用而被激活,从而在维持细胞存活和细胞增殖方面起重要作用,为实现骨髓间充质干细胞向肝系细胞分化提供了重要的前提条件。
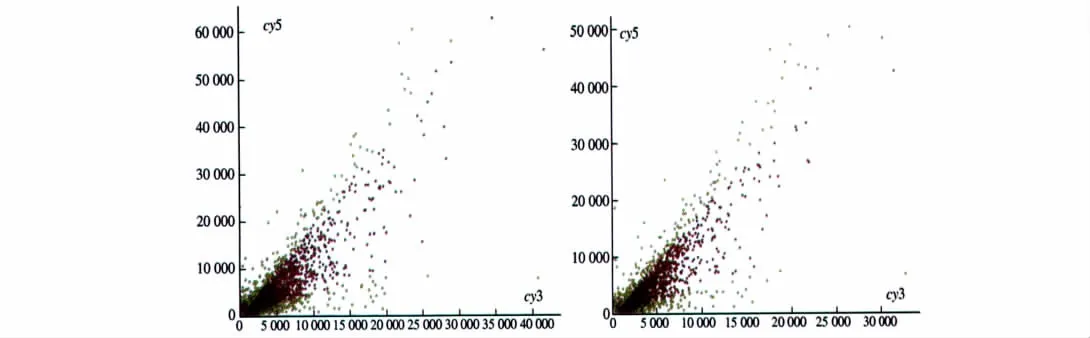
图7 2次重复实验的诱导细胞和未诱导细胞杂交信号强度散点图Fig 7 Hybridization signal intensity scatter diagram between the experiment group and the control group through tw ice repeated experiment
ApoB:ApoB是LDL受体的配体,其负责LDL在体内的清理、参与VLDL的合成分泌、向组织运输脂类和胆固醇等。脂类被用于代谢或储存;胆固醇被用于细胞膜的合成更新及类固醇的合成等。
LDLR基因:低密度脂蛋白受体(low density lipoprotein receptor,LDLR)是一种细胞表面蛋白,是低密度脂蛋白受体基因家族中最重要的一种,对于调节胆固醇的体内平衡、调节血浆总胆固醇浓度起关键性的作用。
CETP:CETP(胆固醇酯转运蛋白)为疏水性糖蛋白,由17个氨基酸的信号肽和476个氨基酸的多肽组成,疏水性氨基酸占44%。人的肝脏、小肠等组织含有CETP mRNA。在脂蛋白代谢中,CETP介导脂蛋白之间脂质的交换,协调脂质转运。
综上所述,我们的实验结果表明SGK基因在HGF +FGF4作用下被激活,介导细胞增殖、存活信号转导通路、维持细胞的存活,并促进细胞的增殖,从而为骨髓间充质干细胞向肝系细胞分化提供前提保证。在骨髓间充质干细胞向肝系细胞分化过程中,与肝细胞功能有关的基因逐渐表达出来,如有关脂质和胆固醇代谢的基因ApoB、LDLR和CETP,进一步完善肝细胞的功能。
[1]Lockhart DJ,Winzeler EA.Genomics,gene experssion and DNA arrays[J].Nature,2000,405(6788):827-836.
[2]Park J,Leong ML,Buse P,et al.Serum and glucocorticoid-inducible kinase(SGK)is a target of the PI3-kinase-stimulated signaling pahtway[J].EMBO J,1999,18(11):3024-3033.
[3]Klaus F,Palmada M,Lindner R,et al.Up-regulation of hyperto-nicityactivatedmyo-inositol transporter SMIT1by the cell vol-umesensitive protein kinase SGK1[J].J Physiol,2008,586(6):1539.
[4]Mikosz CA,Brickley DR,Sharkey MS,et al.Glucocorticoid receptormediated protection from apoptosis is associated with induction of the serine/threonine survival kinase gene,sgk-1[J].J Biol Chem,2001,276(20):16649-16654.
[5]Shelly C,Herrera R.Activation of SGK1 by HGF,Rac1 and integrinmediated cell adhesion in MDCK cells:PI-3K-dependent and-independent pathways[J].J Cell Sci,2002,115(Pt 9):1985-1993.
