蛤仔回交家系建立及早期生长发育比较
2013-03-07赵力强闫喜武霍忠明
赵力强, 闫喜武, 霍忠明, 杨 凤
(大连海洋大学 水产与生命学院, 辽宁 大连 116023)
蛤仔回交家系建立及早期生长发育比较
赵力强, 闫喜武, 霍忠明, 杨 凤
(大连海洋大学 水产与生命学院, 辽宁 大连 116023)
2009年9月, 作者以蛤仔(Ruditapes philippinarum)杂交家系HD(♀H×♂D)及其亲本家系H、D为材料, 采取单对交配策略建立了B1F1(♀HD×♂H)、B2F1(♀D×♂HD)、B3F1(♀HD×♂D)和B4F1(♀H×♂HD)4个回交家系, 并对各家系蛤仔早期生长发育进行比较。结果表明: 家系间蛤仔的卵径、受精率、孵化率和初孵 D形幼虫壳长差异不显著(P>0.05); 浮游幼虫期, B1F1和 B3F1家系幼虫生长速度显著快于B2F1和B4F1(P<0.05), 9日龄时B2F1和B4F1幼虫存活率显著低于B1F1和B3F1(P<0.05); 变态期, B2F1和B4F1家系幼虫表现出明显的变态时间延长、变态规格小型化和变态率低等近交衰退现象; 稚贝期, B1F1和B3F1家系稚贝生长优势开始显现, 而B2F1和B4F1家系稚贝生长和存活劣势依旧明显。综上可见以杂交F1(♀)为母本的B1F1和B3F1家系早期生长和存活性状显著优于以杂交F1(♂)为父本的B2F1和B4F1家系, 因此在蛤仔回交育种中以杂交F1(♀)为母本更有利于选择。
蛤仔; 回交; 家系; 生长; 存活
优良品种(系)是海产贝类养殖业健康稳定和高效可持续发展的关键所在, 家系作为培育优良品种(系)的重要育种材料, 建立家系并进行定向选育已经成为海产贝类遗传育种的重要手段[1]。优良家系可以通过累代选择、家系内纯化和家系间杂交, 有效固定选育群体内优良性状的加性基因, 增加群体内优良性状的基因频率, 最终获得满足人们需求的新品种(系)[2-5]。家系的建立主要有巢式设计和单对交配两种方式[6], 很多育种家系, 如自交家系、近交家系和杂交家系都是采用这两种方法建立起来的[7-9], 但目前尚未见有关回交家系的报道。
中国是蛤仔养殖大国, 但目前中国所养蛤仔基本上都是野生型的, 尚未经过家化过程的选择, 生长性状和抗逆性均有待提高。同时, 种质资源基础状况不清、品质下降、抗逆性差、大面积死亡时有发生等不良现象严重阻碍了蛤仔产业的良性发展。近年来, 闫喜武[10-14]等相继开展了蛤仔良种培育和遗传改良工作, 并成功培育出海洋橙(Ruditapes philippinarum)、斑马蛤(Ruditapes philippinarum)等生长快、抗逆性强的蛤仔新品系。作者采取回交交配方式, 建立了4个回交家系, 通过对各家系F1生长和存活比较, 研究了回交对蛤仔 F1生长和存活的回交效应, 以期为蛤仔良种培育和遗传改良提供参考。
1 材料与方法
1.1 亲贝来源和选择
2007年8月, 以蛤仔(Ruditapes philippinarum)北方野生群体为材料建立了50个家系, 筛选出生长和存活性状优良的H和D家系; 2008年8月, 对H和D家系进行家系间双列杂交, 从 HD(♀H×♂D)和DH(♀D×♂H)家系中筛选出生长和存活优势明显的HD家系; 2009年4月, 以杂交家系HD及其亲本H、D家系为材料, 选择外表无损伤、壳型一致的个体在大连庄河海洋贝类育苗场室外土池自然促熟, 8月下旬, 待其性腺发育成熟时, 取回车间催产。
1.2 试验设计及处理
将HD和H、D家系蛤仔阴干8 h后, 放入沙滤海水中催产, 亲贝产卵排精后, 迅速将正在排放的个体挑出, 用淡水冲洗干净, 放入盛有过滤海水的2.0 L聚乙烯桶中继续排放, 排放结束后及时将亲贝捞出, 并将所收集的卵子用 400目筛网洗卵和镜检,弃掉已受精的卵子。精卵收集结束后, 按图1试验设计进行人工授精, ♀HD与♂H交配建立 B1F1家系, ♀D与♂HD交配建立B2F1家系, ♀HD与♂D交配建立B3F1家系, ♀H与♂HD交配建立B4F1家系, 同时以HD家系自繁子代作为对照组CF1。将配对好的精子和卵子放入2.0 L聚乙烯桶中, 搅动海水进行人工授精, 然后用200目筛网滤出杂质后将受精卵放入50 L聚乙烯桶中, 按照 30~50 个/mL进行孵化, 孵化过程中微充气。操作过程中, 各家系间严格隔离, 避免受到外源精、卵和幼虫污染。
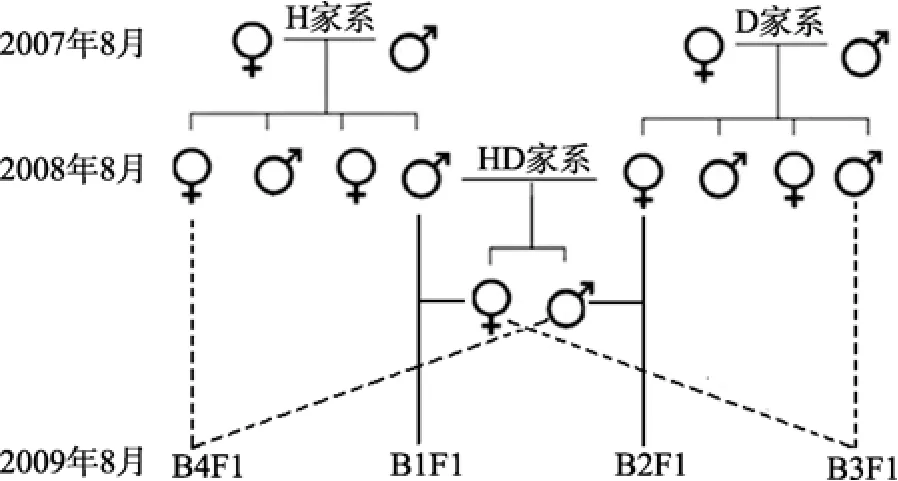
图1 蛤仔回交家系试验设计Fig. 1 The experiment design of the backcross families
1.3 幼虫、稚贝培育和中间育成
受精后约23~25 h, 胚胎发育至D形幼虫, 选育后将幼虫转移至60 L聚乙烯桶培育, 密度为5~6 个/mL。每个家系设置3个重复。幼虫培育前3 d, 投喂等鞭金藻(Isochrysis galbana), 第4天起进行等鞭金藻和小球藻(Chlorella vulgaris)(1: 1)混合投喂。随着幼虫生长发育, 日投藻细胞数从5000 个/mL逐渐增加至20000个/mL。每隔1d全量换水1次。经过40 d室内培育后, 采取挂养方式转入室外土池中间育成, 挂养网袋规格为40 cm × 30 cm, 定期更换大网眼网袋, 网眼规格从60目逐渐增大至18目。定期清洗网袋, 及时清除淤泥和附着生物, 保持袋内水流畅通。
1.4 取样、测量
幼虫期, 第 3、6、9天及附着前(幼虫面盘开始退化, 足可以自由伸缩, 表现出明显的避光性和趋地性)取样1次, 每个家系随机取样30个幼虫测量壳长, 同时测定幼虫密度, 幼虫存活率即为各日龄幼虫密度与初孵 D形幼虫密度百分比; 变态期, 以附着幼虫出现鳃原基、足、次生壳为变态完成标志, 每个家系随机取样30个体测量幼虫变态规格, 统计变态率, 并记录附着幼虫开始变态时间至全部完成变态时间; 稚贝期, 第30、60和90天随机取样测量稚贝壳长并统计空壳率, 通过空壳率计算出稚贝各日龄存活率。
1.5 数据处理
为了减小方差齐性, 所有的壳长均转化为对数Log10[15], 所有存活率均转化为反正弦函数 ASIN[16]。用SPSS 17.0统计软件对数据进行分析处理, 数据比较采用单因素方差分析方法(Turkey HSD), 差异显著性设置为P<0.05; Excel作图。
2 结果
2.1 卵径、受精率、孵化率和初孵 D形幼虫壳长
B1F1、B2F1、B3F1和 B4F1家系和对照组 CF1蛤仔的卵径、受精率、孵化率和初孵D形幼虫壳长见表1。各家系和对照组蛤仔的卵径、受精率、孵化率和初孵 D形幼虫壳长差异不显著(P>0.05); 受精率和孵化率均较高, 分别在95%和80%以上。
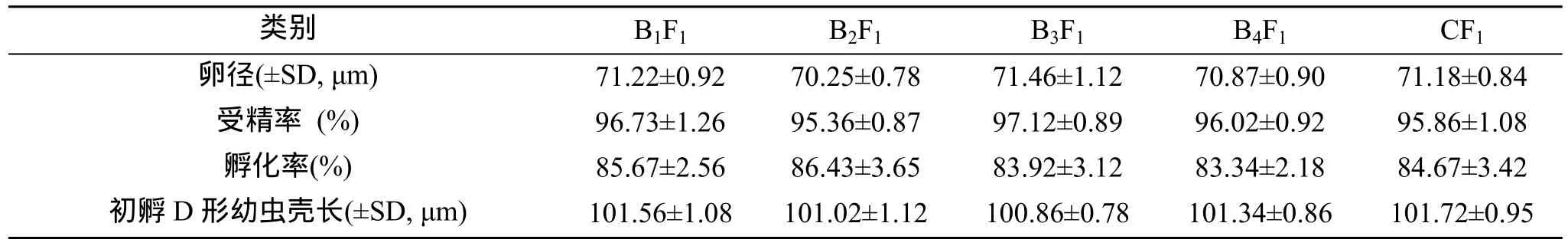
表1 各家系和对照组蛤仔的卵径、受精率、孵化率和初孵D形幼虫壳长Tab. 1 The egg diameter, fertilized rate, hatching rate and shell length of D larvae of the families and control line
2.2 幼虫生长、存活
如图2所示, 幼虫期, 3日龄时, B1F1、B2F1、B3F1和B4F1家系及对照组CF1幼虫壳长差异不显著(P< 0.05), 随着幼虫的生长发育, 各家系幼虫大小开始出现分化, 9日龄时以HD家系为母本的B1F1、B3F1家系幼虫壳长显著大于以 HD家系为父本的 B2F1、 B4F1家系幼虫壳长(P<0.05), 而 B1F1、B3F1家系与对照组CF1幼虫壳长差异不显著(P>0.05)。
如图 3所示, 6日龄以前, B1F1、B2F1、B3F1和B4F1家系及对照组CF1幼虫存活率均在75%以上, 9日龄时B2F1、B4F1家系幼虫存活率显著低于B1F1、B3F1家系和对照组CF1(P<0.05)。

图2 家系间幼虫生长发育比较Fig. 2 The larval growth of the families
2.3 幼虫变态
B1F1、B2F1、B3F1和B4F1家系及对照组CF1幼虫附着大小、变态时间、变态规格和变态率见表2。B2F1和B4F1家系幼虫表现出明显的变态时间延长、变态规格小型化和变态率低等近交衰退现象, 变态时间较B1F1、B3F1家系与对照组CF1延长3~4d,幼虫附着大小、变态规格和变态率均显著低于B1F1、B3F1家系与对照组 CF1(P<0.05), 而 B1F1、B3F1家系与对照组CF1幼虫附着大小、变态时间、变态规格和变态率差异不显著(P>0.05)。

图3 家系间幼虫存活比较Fig. 3 The larval survival rate of the families

表2 家系间和对照组幼虫附着大小、变态时间、变态规格和变态率Tab. 2 The setting size, metamorphosis time, metamorphic size, and metamorphosis rate of the families and control line
2.4 稚贝生长、存活
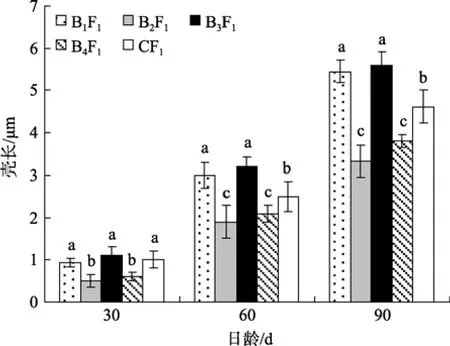
图4 家系间稚贝生长发育比较Fig. 4 The juvenile growth of the families
如图4所示, 室内培育阶段(60日龄前), 稚贝生长速度较慢, 30日龄时, B2F1、B4F1家系稚贝壳长显著小于B1F1和B3F1家系与对照组CF1(P<0.05), 60日龄时, B1F1和B3F1家系稚贝壳长与对照组CF1差异显著(P<0.05), 表现出明显的生长优势; 室外生态池培育阶段, 90日龄时B1F1和B3F1稚贝壳长显著大于对照组CF1(P<0.05), 而B2F1、B4F1家系稚贝壳长显著小于对照组CF1(P<0.05)。
如图5所示, 60日龄时各家系稚贝存活率均达到75%以上, 家系间稚贝存活率差异不显著(P>0.05), 30日龄和90日龄时, B2F1、B4F1家系稚贝存活率显著低于 B1F1和 B3F1家系与对照组 CF1(P<0.05), 而B1F1和B3F1家系与对照组CF1稚贝存活率差异不显著(P>0.05)。
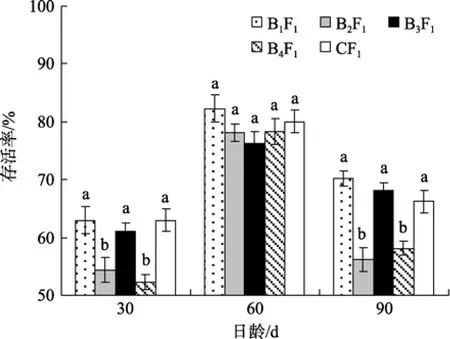
图5 家系间稚贝存活比较Fig. 5 The survival rate of the families
3 讨论
回交作为杂交育种的重要手段, 旨在通过杂交子代与亲本的再次杂交, 从而使杂交后代进一步加强轮回亲本的某些优良性状, 减少杂交后代性状的分离, 同时保留非轮回亲本的某些优良性状[17-19]。因此, 回交更有利于提高品种的优越性, 有利于正确选择[20]。作者从50个家系中筛选出生长快、抗逆性强的H和D家系, 通过H和D家系的双列杂交, 显著地提高了杂交后代的生活力, 获得较高的杂种优势, 并从2个杂交组合中进一步筛选出生长更快、抗逆性更强的HD杂交家系。为进一步强化HD家系的优良性状, 并考虑到父母本的选择对子代性状的影响[21], 以 HD(♀HD、♂HD)家系为亲本, 分别与H(♀H、♂H)和 D(♀H、♂H)家系进行回交, 建立了B1F1(♀HD×♂H)、B2F1(♀D×♂HD)、B3F1(♀HD×♂D)和B4F1(♀H×♂HD)4个回交家系, 并通过与HD家系杂交 F2比较, 获得了生长性状显著优于杂交 F2的B1F1和B3F1家系, 显示经过回交后, HD家系的优良性状在回交子代中得到进一步加强。
近亲交配是指血缘关系极为相近或者遗传组成极相似的个体之间进行的交配繁殖[22], 因此, 回交也是一种高度的近亲交配。近亲交配可以产生一系列的遗传效应, 连续的近交可以显著提高群体的近交水平、清除子代体内的有害隐形基因、固定能够适应环境的优良等位基因、提高子代群体的同质性、加速纯系的培育[23-25], 但近亲交配最明显的结果是,那些与繁殖能力或生理机能相关的性状所表现的表型平均值降低, 这种现象称为近交衰退[1]。根据亲缘关系的远近, 近交又可分为自交、全同胞交配、半同胞交配和回交。目前, 自交、全同胞交配、半同胞交配所引起的近交衰退报道比较多, 张国范[8]、Ibarra[26]等通过对海湾扇贝(Argopecten irradians irradians)自交系研究表明, 自交对海湾扇贝的生长和存活带来明显不利的影响, 表现为个体发育迟缓、小型化和存活率降低; Ford[27]采取不同配对方式建立近交水平为F=0.0625和0.203的太平洋牡蛎(Crassostrea gigas)家系, 通过对其生长、存活等表型性状研究表明, 近交衰退的变化依赖于近交的程度, 不同近交水平的近交衰退差异显著。有关回交所引起近交衰退的研究很少, 刘于信[17]等研究发现, 以杂交 F1为父本的尼罗♀×(尼罗♀×萨罗♂)♂、尼罗♀×(萨罗♀×尼罗♂)♂的生长性能和耐盐性能均显著低于杂交 F2。在本文所建立的4个回交家系中, B2F1和B4F1家系也表现出明显的个体发育迟缓、小型化和存活率降低等近交衰退现象。
亲本的选择恰当与否是育种工作成功的关键所在, 待选性状作为父本有利还是母本有利是当前育种工作中经常遇到的一个问题, 而在回交育种中父母本的选择对子代性状的影响尤为突出[21]。闫学春[19]等采取形态学方法比较了鲤鲫杂交两种回交子代鱼的形态特征, 发现回交鲤和回交鲫形态特征上差别很大; 刘于信等[17]对以杂交F1为亲本培育的4种回交罗非鱼的生长性能和耐盐性能研究发现, 以杂交 F1为母本的♀(尼罗♀×萨罗♂)×尼罗♂和♀(萨罗♀×尼罗♂)×尼罗♂的生长性能和耐盐性能均显著优于杂交F2,而以杂交 F1为父本的尼罗♀×(尼罗♀×萨罗♂)♂和尼罗♀×(萨罗♀×尼罗♂)♂的生长性能和耐盐性能较杂交F2显著降低。作者通过对4个回交家系早期生长性状比较, 发现以杂交 F1(♀)为母本的 B1F1和 B3F1家系生长和存活性状均显著优于以杂交 F1(♂)为父本的B2F1和B4F1家系, 可见在蛤仔回交育种中以杂交F1(♀)为母本更有利于选择。
[1] 张国范, 刘晓. 关于贝类遗传改良几个问题的讨论[J]. 水产学报, 2006, 30(1): 130-137.
[2] 张国范, 郑怀平. 海湾扇贝养殖遗传学[M]. 北京:科学出版社, 2009: 103-104.
[3] 张国范, 闫喜武. 蛤仔养殖学[M]. 北京: 科学出版社, 2010: 333-339.
[4] Landon C, Evans F, Jacobson D, et al. Yields of cultured Pacific oystersCrassostrea gigasThunberg improved after one generation of selection[J]. Aquaculture, 2003, 220: 227-244.
[5] Jones R, Bates J A, Innes D J, et al. Quantitative genetic analysis of growth in larval scallops (Placopecten magellanicus) [J]. Marine Biology, 1996, 124: 671-677.
[6] 张泽, 罗泽伟. 因子与巢式设计群体近交率的比较研究[J]. 遗传学报, 1999, 26(2): 27-33.
[7] 何毛贤, 管云雁, 林岳光, 等. 马氏珠母贝家系的生长比较[J]. 热带海洋学报, 2007, 26(1): 39-43.
[8] 张国范, 刘述锡, 刘晓, 等. 海湾扇贝自交家系的建立与自交效应[J]. 中国水产科学, 2003, 10(6): 441-445.
[9] 霍忠明, 闫喜武, 张跃环, 等. 菲律宾蛤仔大连群体家系建立及生长比较[J]. 海洋与湖沼, 2010, 41(3): 334-340.
[10] 闫喜武, 张国范, 杨凤, 等. 菲律宾蛤仔莆田群体两个壳色品系生长发育的比较[J]. 大连水产学院学报, 2005, 20(4): 266-269.
[11] 闫喜武, 张跃环, 霍忠明, 等. 不同壳色菲律宾蛤仔品系间的双列杂交[J]. 水产学报, 2008, 32(6): 864-875.
[12] 闫喜武, 张跃环, 霍忠明, 等. 不同壳色菲律宾蛤仔品系 F2的表型性状研究[J]. 水产学报, 2010, 34(6): 346-352.
[13] 张跃环, 闫喜武, 姚托, 等. 菲律宾蛤仔 2个壳色品系群体杂交的研究[J]. 南方水产, 2008, 4(3): 27-32.
[14] 张跃环, 闫喜武, 霍忠明, 等. 菲律宾蛤仔 4个斑马蛤品系 F2的表型性状研究[R]. 江西南昌: 第十二次贝类学会分会, 2009.
[15] Neter J, Wasserman W, Kutner M. Applied linear statistical models [M]. Chicago: McGraw-Hill Irwin, 1985: 1127.
[16] Rohlf F J, Sokal R R. Statistical tables [M]. New York: W H Freemanand Company, 1981: 219.
[17] 刘于信, 李思发, 蔡完其, 等. 耐盐罗非鱼育种回交效应评估[J]. 中国水产科学, 2008, 16(3): 332-339.
[18] 吴买生, 朱吉, 刘天明, 等. 沙子岭猪回交试验[J].家畜生态学报, 2008, 29(2): 10-13.
[19] 闫学春, 梁利群, 孙效文, 等. 鲤鲫杂交两种回交子代鱼的形态特征比较[J]. 东北农业大学学报, 2007, 38(6): 797-800.
[20] 楼允东. 鱼类育种学[M]. 北京: 中国农业出版社, 2001: 53-55.
[21] 伏军. 水稻杂交育种中父母本选择的研究[J]. 湖南农学院学报, 1986, 3(1): 5-11.
[22] Hershberger W K, Perdue J A, Beattie J H. Genetic selection and eyetematic breeding in pacific oyster culture [J]. Aquaculture, 1984, 39: 237-245
[23] Gallardo J A, Garcia X, Lhorente J P, et al. Inbreeding and inbreeding depression of female reproductive traits in two populations of coho salmon selected using BLUP predictors of breeding values [J]. Aquaculture, 2004, 234: 111-122.
[24] Shikano T, Chivokubo T, Taniguchi N. Effect of inbreeding on salinity tolerance in the guppyPoecilia reticulata[J]. Aquaculture, 2001, 202: 45-55.
[25] Myers J M, Heggelund P O, Hudson G, et al. Genetics and broodstock management of coho salmon [J]. Aquaculture, 2001, 197: 43-62.
[26] Ibarra A M, Cruz P, Romero B A, et al. Effects of inbreeding on growth and survival of selffertilized catarina scallop larvae,Argopecten circularis[J]. Aquaculture, 1995, 134: 37-47.
[27] Ford E, Sean M, John B, et al. The effects of inbreeding on performance traits of adult Pacific oysters,Crassostrea gigas[J]. Aquaculture, 2003, 125: 59-65.
(本文编辑: 谭雪静)
Establishment of backcross families of Manila clamRuditapes philippinarumand comparison of their early growth and development
ZHAO Li-qiang, YAN Xi-wu, HUO Zhong-ming, YANG Feng
(College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023, China)
Feb.,9,2012
Ruditapes philippinarum; backcross; family; growth; survival
Four backcross families (B1F1(♀HD×♂H), B2F1(♀D×♂HD), B3F1(♀HD×♂D) and B4F1(♀H×♂HD) of Manila clamRuditapes philippinarum) were established in September, 2009. Phenotypic traits of these families were analyzed. No significant difference were detected in egg-diameter, fertilization rates, hatching rates, and D larval size among the families (P>0.05). We found that the growth rates of B1F1and B3F1, which were selected F1(♀) as female parents were significantly higher than those of B2F1and B4F1selected F1(♂) as male parents (P<0.05), at all the early growth stages, but the difference between B1F1, B3F1and control line were not significant before 60 days (P>0.05). Comparing the survival rates of these families, B1F1and B3F1, were also significantly higher than those of B2F1and B4F1, while there was no significant difference between B1F1, B3F1and control line throughout the early growth stages (P>0.05). Therefore, selecting F1(♀) as the female parent, and then conducting a backcross breeding appears to be an effective method for genetic improvement of Manila clamRuditapes philippinarum.
Q111.22
A
1000-3096(2013)01-0070-06
2012-02-09;
2012-07-12
现代农业产业技术体系建设专项(CARS-48)
赵力强 (1983–), 男, 河北石家庄人, 硕士, 实验师, 主要从事贝类遗传育种与健康养殖技术研究, E-mail: zhaoliqiang@dlou.edu.cn;闫喜武, 通信作者, E-mail: yanxiwu@dlou.edu.cn
