主动靶向脂质体研究进展
2013-03-06左勇亮肖人钟王蓉蓉
左勇亮,肖人钟,王蓉蓉
(1.九江市妇幼保健院,江西 九江 332000;2.江西昂泰制药有限公司,江西 九江 332300;3.浙江大学校
医院,杭州 310009)
主动靶向脂质体研究进展
左勇亮1,肖人钟2*,王蓉蓉3
(1.九江市妇幼保健院,江西 九江 332000;2.江西昂泰制药有限公司,江西 九江 332300;3.浙江大学校
医院,杭州 310009)
目的 介绍主动靶向脂质体最新研究进展。方法 查阅近年来国内外相关文献,对主动靶向脂质体的表面修饰、配体选择及应用进行总结和归纳。结果 主动靶向脂质体的表面修饰有3种方法:作为组份直接制备;键合到脂质体表面;后插入法。主动靶向脂质体可以将药物传递到靶组织、靶向细胞或靶细胞器,提高药物的生物利用度,而不增加对正常组织或细胞的毒性,是近年研究最为广泛的主动靶向给药系统。结论 主动靶向脂质体是一种非常有前途的给药系统。
主动靶向脂质体;靶向给药系统;配体
主动靶向给药系统是指通过载体结构修饰或生物识别作用将药物定向运送至病变部位发挥药效,而不损伤周围的正常细胞、组织和器官的体系[1]。脂质体是最常用的靶向给药载体,其靶向性分为主动靶向和被动靶向,是由类细胞膜磷脂双分子层组成的、内部为水相的封闭囊泡,现已广泛应用于药物制剂领域。脂质体作为主动靶向给药载体具有许多优点,如:双亲性、生物相容性、容易表面修饰、不引起或只引起非常小的抗原性、致热性、过敏性和毒性反应[2-3]。由于脂质体具有类细胞膜结构,所以可以通过吞噬、融合和吸附的方法进入靶细胞。动态的脂质体膜能更方便的吸附配体到脂质体表面,使配体在脂质体表面分布更为平均,与靶分子结合更为容易[4-5]。现已有多篇论文对脂质体的制备进行了系统性综述[6-7],故本文不再介绍。本文将着重对主动靶向脂质体的表面修饰及应用进行简要综述。
1 主动靶向脂质体的表面修饰
通过利用配体修饰脂质体表面,能有效地增加靶向效率,精确地靶向靶细胞或靶组织,从而提高生物利用度。配体修饰脂质体的方法应该简单、快速,形成的化学键应该稳定、没有毒性,而且能高效地识别靶组织。配体修饰脂质体的方法分为非化学键合吸附和化学键耦合,前者由于具有吸附效率低、分布不均匀、不能保证配体在脂质体表面、配体易分离等,现在该方法应用较少[8]。化学键耦合具有的优点是稳定性好、重复性好和分布均匀,所以该方法是脂质体表面修饰的常用方法。现主要有3种方式制备配体修饰的脂质体,见图1。
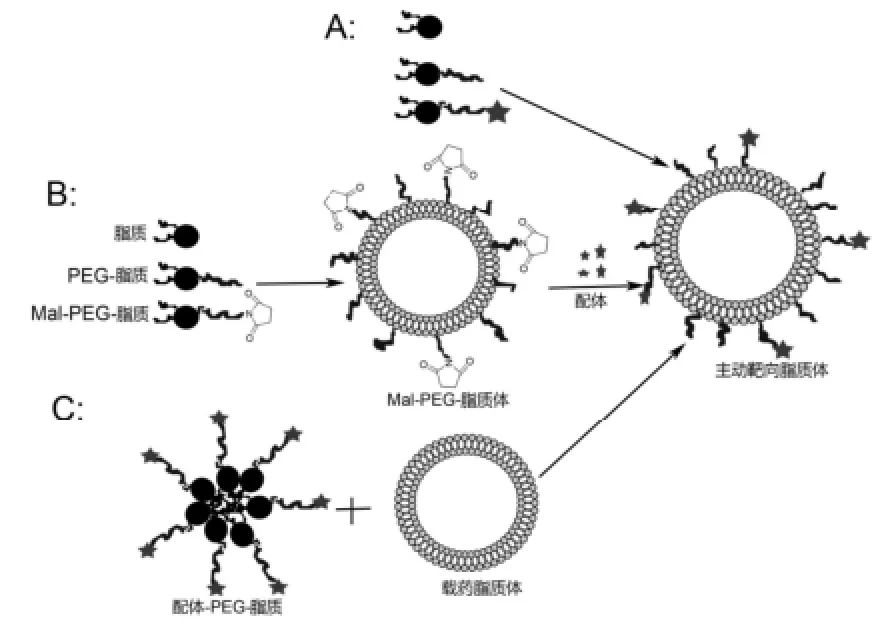
图1 配体修饰脂质体的方法A-配体与脂质耦合后,作为制备脂质体的成分,直接制备;B-直接键合到脂质体表面;C-后插入法Fig 1 The strategies of adsorbing ligands onto the vector surface A-addition of ligands as components during the preparation liposomes; B-direct coupling method; C-post insertion method
①配体与脂质耦合后,作为制备脂质体的成分,直接制备。
Yan等[9]先将LyP-1配体与聚乙二醇-二硬脂酰磷脂酰乙醇胺(PEG-DSPE)链接,然后将其与磷脂、胆固醇、PEG-DSPE一起作为脂质体组成成分,用薄膜水化法制备包封多比柔星的LyP-1-PEG-脂质体。结果该脂质体粒径较小、分布均匀,能增加肿瘤细胞和转移性肿瘤淋巴结对载药脂质体的吸收,从而能有效地抑制肿瘤细胞的增殖和肿瘤的转移。
②直接键合到脂质体表面。首先制备表面含活性基团的含药脂质体,然后配体与之反应形成主动靶向脂质体,但要求该反应条件温和、效率高。常用的活性基团有酰肼基、马来酰亚胺基、羧基等[10-11]。
Maruyama等[10]先制备了表面含羧基的PEG-脂质体(HOOC-PEG-脂质体),然后加入一种单克隆抗体-34A,使之与羧基反应,形成34A-PEG-脂质体。用普通脂质体和PEG-脂质体作为对照,发现34A-PEG-脂质体与肺的结合率比普通脂质体高1.3倍。表明34A-PEG-脂质体没有空间立体阻碍,未链接抗体的PEG能有效的避免被网状内皮系统(RES)吸附,增加34A-PEG-脂质体的血药浓度和体循环时间。
③后插入法。
先制备载药脂质体,然后把配体-脂质通过孵育法插入到载药脂质体表面。利用后插入法能插入多种配体,实现个性化治疗[12]。
Kullberg等[13]先制备了包封DNA复合物和吖啶的脂质体,然后在60 ℃,孵育1 h,插入表皮生长因子(EGF)-PEG-DSPE。结果每个脂质体微球表面含有10~15个EGF分子,对人神经胶质肿瘤细胞表面的EGF受体有特殊的亲和作用。Allen等[12]证实后插入法能应用于抗体、抗体碎片、多肽配体,允许多种配体插入到已制备好的载多种药物的脂质体,有利于实现个性化治疗。后插入法制备靶向脂质体操作简单、快速、柔韧性好,可以应用于实验研究和工业化。
目前配体修饰的靶向脂质体的制备最常用的方法是配体与脂质耦合后,作为制备脂质体的脂质成分,直接制备,但该方法会造成分布不均,而且配体在脂质双层膜的内外均有分布,降低了配体靶向效率。另一种方法是直接键合到脂质体表面,但这一方法的反应效率往往不高也不确定。后插入法体操作简单、快速、柔韧性好,能确保配体在脂质体表面,而且分布均匀,但有可能降低药物包封率。因此,脂质体的表面修饰需要根据不同的药物、不同的工艺,选择合适的修饰方法。
2 配体的选择
靶向配体是影响主动靶向脂质体靶向效率重要因素之一,合适的靶向配体能极大的增加靶向效率,提高药物的生物利用度。靶向配体的选择原则:①靶向配体对细胞表面抗体或受体具有高度特异性、专一靶向性;②靶细胞表面的抗原或受体应该具有高浓度,靶细胞抗原反应不应该显示高异质性;③在完成靶治疗之前,抗体或受体不应降低或流出,而完成后靶向配体或复合物应能被快速的清除[14]。目前,研究者发现了许多靶向配体,并对其进行了深入的研究,如抗体、生长因子类、细胞因子类、蛋白质、核酸等[15-16]。这些配体可以分为非抗体靶向配体和抗体靶向配体。
2.1 非抗体靶向配体
由于细胞周围微环境的改变,一些细胞或者组织过度表达一些特殊的受体,而正常细胞低水平表达或不表达这些受体,因此可以在脂质体表面链接一些特殊的靶向配体靶向这些细胞或组织,传递药物到靶细胞或组织。Gabizon等[17]实验表明非叶酸修饰的脂质体仅局限于分布在细胞外液和巨噬细胞,而叶酸修饰的脂质体能将药物传递肿瘤细胞内,增加了抗肿瘤效果。
非抗体靶向配体一般较易获得、廉价、易处理,但选择特异性较差。常见的非抗体靶向配体见表1。
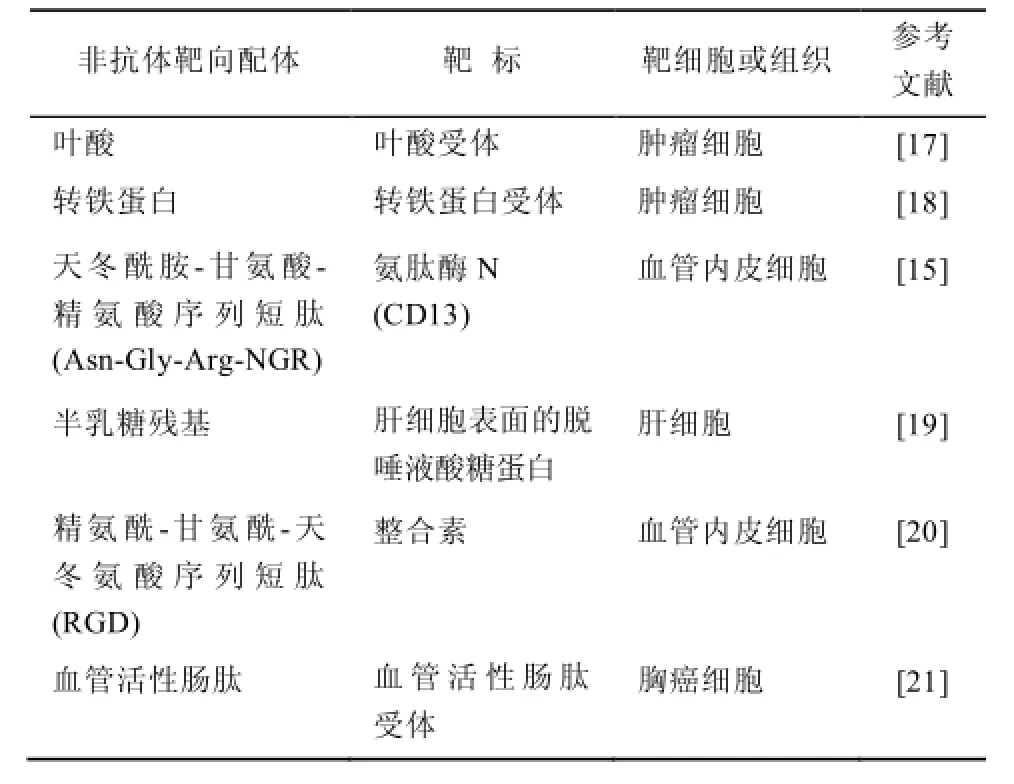
表1 非抗体靶向配体Tab 1 Nonantibody targeting ligands
2.2 抗体靶向配体
非抗体靶向配体通常是通用的、低价的、易于获得的,而其不良反应多源于特异性不强产生的表达[14]。如精氨酸-甘氨酸-天冬氨酸三肽(RGD)靶向细胞黏附分子,叶酸和转铁蛋白靶向生长因子受体,因此会结合一些非靶组织,降低靶向效率,产生不良反应。例如:叶酸存在于食物和人体中,血液中的游离叶酸会与脂质体表面的叶酸竞争结合靶组织[14]。
随着抗体工程技术和噬菌体展示技术的发展,人们能获得高靶向性、高亲和力、低分子量的抗体或抗体碎片[22],特别是用杂交瘤技术和DNA重组技术获得人源化抗体,极大地降低了抗体的免疫源性[23],从而极大地促进了抗体介导的靶向治疗的研究。例如,anti-CD22单克隆抗体能与非霍奇金淋巴瘤细胞表面的CD22抗原进行特异性结合,因此O’donnell等[24]制备了anti-CD22-脂质体包封多比柔星(anti-CD22-LPD)。免疫荧光染色法检测发现anti-CD22-LPD与表达CD22的细胞专一性结合,anti-CD22-LPD比普通脂质体对CD22阳性细胞具有更高的细胞毒性,但没有增加杀死CD22阴性细胞的能力。Lopes de Menezes等[25]制备了anti-CD19单克隆抗体修饰的多比柔星脂质体(anti-CD19-LPD)抑制恶性B淋巴细胞。结果anti-CD19-LPD与CD19阳性B淋巴细胞结合率是非靶向脂质体的3倍。非靶向脂质体对B淋巴细胞或T淋巴细胞明显具有更低的识别能力。
吴爱国等[26]使用胃蛋白酶在Tastuzumab抗体J链Fc段侧切断抗体获得抗体F(ab')2段,并用抗体交联法制备Trastuzmab F(ab')2段修饰的紫杉醇免疫脂质体。结果在相同时间内,大肠癌细胞HT-29对紫杉醇免疫脂质体的摄取要明显高于对照组。Trastuzmab F(ab')2修饰的紫杉醇免疫脂质体对大肠癌细胞HT-29的杀伤作用强于对照组,且该作用具有时间依赖性。
3 主动靶向脂质体的应用
主动靶向脂质体能应用于传递各种药物,脂溶性药物能吸附或镶嵌在双分子层,水溶性药物被包封于脂质体内部的水相,特别是能传递蛋白质、核酸,而不影响药物的生物活性。
3.1 传递脂溶性药物
脂溶性药物制备成口服制剂的生物利用度较低,且波动性较大,而制备成注射剂需要加入大量的乙醇、吐温等,刺激性很大,且具有毒性。周蔚等[27]构建了RGD修饰的紫杉醇长循环纳米脂质体(RGD-SSL-PTX),以紫杉醇注射液(商品名为泰素)为对照,尾静脉注射肺腺癌细胞A549的荷瘤裸鼠。结果表明,RGD-SSL-PTX相比泰素有较好的长循环作用。RGD-SSL-PTX的肿瘤组织靶向效率较泰素有提高,而其他器官中药物分布相对降低,最大耐受量也高于泰素,其抑瘤作用更明显。还有,唐勇等[28]采用硫酸铵梯度法制备了半乳糖化紫杉醇长循环纳米脂质体,延长了药物在体内的循环时间,提高了肿瘤组织靶向效率而其他器官中药物分布相对降低。从而改善了紫杉醇传统剂型的药物动力学和组织分布,提高了紫杉醇在体内的安全性和抑瘤作用。
Xiong等[29]制备了RGD修饰的立体稳定性脂质体(RGD-PEG-LP)包封脂溶性抗癌药多比柔星,并证明RGD-PEG-LP增加了黑色素瘤细胞对多比柔星的胞内吸收,提高了抗肿瘤活性。RGD-PEG-LP能被动积聚在肿瘤组织和通过整联蛋白介导的胞吞作用主动靶向肿瘤组织。
陈莹等[30]将白介素-2(IL-2)直接键合到5-氟尿苷棕榈酸酯(5-FURP)脂质体表面,研究其主动靶向IL-2受体高表达的肿瘤细胞的能力。结果脂质体具有缓释作用,IL-2-5-FURP-脂质体呈剂量依赖性抑制肿瘤细胞的生长,对Hut-102的杀伤作用明显优于5-FURP-脂质体及5-FURP。
3.2 传递水溶性药物
大部分药物因其水溶性或分子质量超过500 Da无法透过血脑屏障,而主动靶向脂质体能传递水溶性脂质体透过血脑屏障,从而提高脑内药物浓度,降低不良反应。
闫颖等[31]以水溶性葡萄糖为模型,制备了叶酸受体为靶向的阳离子脂质体,流式细胞技术检测KB细胞和HepG2细胞对叶酸靶向脂质体的摄取,结果表明叶酸受体靶向的长循环阳离子脂质体能提高细胞对脂质体的摄取。
吕清等[32]制备了转铁蛋白、叶酸共同修饰的阿霉素脂质体,结果该双配脂质体在bEnd3细胞中摄取远大于普通脂质体,药物透过血脑屏障的速率显著提高,并对下层C6细胞的毒性大大增加。
叶果等[33]研究表明,主动靶向脂质体对多药耐药有一定的逆转作用。MRK-16修饰阿霉素免疫脂质体的多药耐药逆转指数达7.45,逆转指数4.28。
3.3 传递蛋白质和核酸
随着生物技术、蛋白质工程技术的发展,大量的生物分子被用于疾病的治疗,如蛋白质、核酸等,然而这些大分子通常被限制进入细胞和易被溶酶体降解,很难达到细胞质和细胞核。通过包封生物分子到主动靶向脂质体载体内,然后利用胞吞作用将其摄入,再在胞内释放药物,能防止被溶酶体降解,靶向病态的部位和提高靶细胞的吸收,从而提高这些不稳定的大分子药物的治疗[34]。
Gao等[35]构建了HER2重组人源化片段修饰的PEG-脂质体(HER2-PEG-LP)载siRNA药物(anti-RhoA siRNA)。以RhoA作为抗癌药物靶标,发现含2.5%PEG的HER2-PEG-LP能被SK-BR3细胞识别,并被内化,在细胞内释放anti-RhoA siRNA能使RhoA表达沉默和阻止侵入细胞。
Falco等[36]用鱼病毒性出血性败血症棒状病毒(VHSV)的表面糖蛋白G修饰脂质体运载蜂毒肽,体外结果显示该制剂能抑制VHSV的传染性,95.2%的病毒直接失活。在感染后的不同时间加入该制剂,分析感染疫源地大小,发现VHSV的传染性均受到抑制,减少了VHSV蔓延,并杀死了原生质膜能过度表达表面糖蛋白G的细胞。
总之,主动靶向脂质体传递药物能避免生理学和生物学障碍,还能主动靶向靶组织或细胞,是热门的新型载体,尤其适合应用于抗肿瘤药物。虽然靶向配体的消除方式,还没有阐明,有些配体分子量较大,靶向效率不高,但是随着新材料的合成,新靶标和新配体的发现,将使主动靶向脂质体向更为安全、有效的方向发展,未来具有广阔的应用前景。
REFERENCES
[1] BRANNON-PEPPAS L, BLANCHETTEl J O. Nanoparticle and targeted systems for cancer therapy [J]. Adv Drug Deliv Rev, 2004, 56(11): 1649–1659.
[2] IMMORDINO M L, DOSIO F, CATTEL L. Stealth liposomes: review of the basic science, rationale, and clinical applications, existing and potential [J]. Int J Nanomed, 2006, 1(3): 297-315.
[3] RAWAT M, SINGH D, SARAF S. Nanocarriers: promising vehicle for bioactive drugs [J]. Biol Pharm Bull, 2006, 29(9): 1790-1798.
[4] FORSSEN E, WILLIS M. Ligand-targeted liposomes [J]. Adv Drug Deliver Rev, 1998, 29(3): 249-271.
[5] MCMAHON H T, GALLOP J L. Membrane curvature and mechanisms of dynamic cell membrane remodelling [J]. Nature, 2005, 438(7068): 590-596.
[6] WU X P, WANG C. Advances in peptide-modified liposome targeted drug delivery system [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2010, 27(8): 681-685
[7] ZHENG J D, HUANG H. Liposome active load medicine and its research progress [J]. Foreign Med Sci(Sect Pharm)(国外医学:药学分册), 2005, 32(4): 271-274.
[8] NOBS L, BUCHEGGR F, GURNY R, et al. Current methods for attaching targeting ligands to liposomes and nanoparticles [J]. J Pharm Sci, 2004, 93(8): 1980-1992.
[9] YAN Z, WANG F, WEN Z, et al. LyP-1-conjugated PEGylated liposomes: A carrier system for targeted therapy of lymphatic metastatic tumor [J]. J Control Release, 2012, 157(1): 118-125.
[10] MARUYAMA K, TAKIZAWA T, YUDA T, et al. Targetability of novel immunoliposomes modified with amphipathic poly(ethylene glycol) s conjugated at their distal terminals to monoclonal antibodies [J]. Biochim Biophys Acta, 1995, 1234(1): 74-80.
[11] DE MENEZES D E L, PILARSKI L M, ALLEN T M. In vitro and in vivo targeting of immunoliposomal doxorubicin to human B-cell lymphoma [J]. Cancer Res, 1998, 58(15): 3320-3330.
[12] ALLEN T M, SAPRA P, MOASE E. Use of the post-insertion method for the formation of ligand-coupled liposomes [J]. Cell Mol Biol Lett, 2002, 7(2): 217-219.
[13] KULLBERG E B, BERGSTRAND N, CARLSSON J, et al. Development of EGF-conjugated liposomes for targeted delivery of boronated DNA-binding agents [J]. Bioconjugate Chem, 2002, 13(4): 737-743.
[14] ALLEN T M. Ligand-targeted therapeutics in anticancer therapy [J]. Nat Rev Cancer, 2002, 2(10): 750-763.
[15] ZHAO B J, KE X Y, HUANG Y, et al. The antiangiogenic efficacy of NGR-modified PEG-DSPE micelles containing paclitaxel (NGR-M-PTX) for the treatment of glioma in rats [J]. J Drug Target, 2011, 19(5): 382-390.
[16] YAMANO S, DAI J, YUVIENCO C, et al. Modified Tat peptide with cationic lipids enhances gene transfection efficiency via temperature-dependent and caveolae-mediated endocytosis [J]. J Control Release, 2011, 152(2): 278-285.
[17] GABIZON A, TZEMACH D, GORIN J, et al. Improved therapeutic activity of folate-targeted liposomal doxorubicin in folate receptor-expressing tumor models [J]. Cancer Chemother Pharmacol, 2010, 66(1): 43-52.
[18] DOI A, KAWABATA S, IIDA K, et al. Tumor-specific targeting of sodium borocaptate (BSH) to malignant glioma by transferrin-PEG liposomes: a modality for boron neutron capture therapy [J]. J Neurooncol, 2008, 87(3): 287-294.
[19] SONOKE S, UEDA T, FUJIWARA K, et al. Galactose-modified cationic liposomes as a liver-targeting delivery system for small interfering RNA [J]. Biol Pharm Bull, 2011, 34(8): 1338-1342.
[20] JIANG J, YANG S, WANG J, et al. Sequential treatment of drug-resistant tumors with RGD-modified liposomes containing siRNA or doxorubicin [J]. Eur J Pharm Biopharm, 2010, 76(2): 170-178.
[21] ÖNYüKSEL H, MOHANTY P S, RUBINSTEIN I. VIP-grafted sterically stabilized phospholipid nanomicellar 17-allylamino-17-demethoxy geldanamycin: a novel targeted nanomedicine for breast cancer [J]. Int J Pharm, 2009, 365(1): 157-161.
[22] THIE H, MEYER T, SCHIRRMANN T, et al. Phage display derived therapeutic antibodies [J]. Curr Pharm Biotechnol, 2008, 9(6): 439-446.
[23] MAYNARD J, GEORGIOU G. Antibody engineering [J]. Ann Rev Biomed Engineering, 2000, 2(1): 339-376.
[24] O’DONNELL R, MARTIN S, MA Y, et al. Development and characterization of CD22-targeted pegylated-liposomal doxorubicin (IL-PLD) [J]. Invest New Drug, 2010, 28(3): 260-267.
[25] LOPES De MENEZES D E, PILARSKI L M, ALLEN T M. Invitro and in vivo targeting of immunoliposomal doxorubicin to human B-cell lymphoma [J]. Cancer Res, 1998, 58(15): 3320.
[26] WU A G, JIAO D C, LI P, et al. Killing effects of immunoliposomal paclitaxel tagged with trastuzumab F(ab′)2 on colorectal cancer cells [J]. Cancer Prev Res, 2010, 37(012): 1360-1363.
[27] ZHOU W, ZHOU C C, MENG S Y, et al. The anti-tumor effects of lung cancer-targeting long-circulating paclitaxelcontaining liposomes [J]. Tumor, 2011, 31(3): 203-209.
[28] TANG Y, LI J, ZHANG Y D. The anti-tumor effects of liver cancer-targeting long-circulating paclitaxel-containing galactosylated liposomes [J]. China J Mod Med(中国现代医学杂志), 2012, 22(9): 6-11.
[29] XIONG X B, HUANG Y, LU W L, et al. Enhanced intracellular delivery and improved antitumor efficacy of doxorubicin by sterically stabilized liposomes modified with a synthetic RGD mimetic [J]. J Control Release, 2005, 107(2): 262-275.
[30] CHEN Y, WU M, PAN L, et al. Preparation of 5’-palmitoyl-5-fluorouridine liposomes modified with interleukin-2 and its cell toxicity [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2011, 28(9): 842-5.
[31] YAN Y, QI X R. Preparation and properties of fol ate receptor targeted cationic liposomes [J]. Acta Pharm Sin(药学学报), 2008, 43(011): 1134-1139.
[32] LÜ Q, HAN M, LI L, et al. Study of doxorubicin liposome modified with transferrin and folic acid targeting to glioma in vitro [J]. Chin J Mod Appl Pharm(中国现代应用药学), 2012, 29(011): 963-70.
[33] YE G, KE A W, LI X. ADM-loaded immuno liposomes reverse MDR of human lung carcinoma in vitro [J]. Mod Oncol(现代肿瘤医学), 2007, 15(6): 754-7.
[34] FRETZ M M, HøGSET A, KONING G A, et al. Cytosolic delivery of liposomally targeted proteins induced by photochemical internalization [J]. Pharm Res, 2007, 24(11): 2040-2047.
[35] GAO J, SUN J, LI H, et al. Lyophilized HER2-specific PEGylated immunoliposomes for active siRNA gene silencing [J]. Biomaterials, 2010, 31(9): 2655-2664.
[36] FALCO A, BARRAJ N-CATAL N E, MEN NDEZ-GUTI RREZ M P, et al. Melittin-loaded immunoliposomes against viral surface proteins, a new approach to antiviral therapy [J]. Antiviral Res, 2013, 97(2): 218-221.
Advances in Active Targeting Liposomes
ZUO Yongliang1, XIAO Renzhong2*, WANG Rongrong3
(1.Jiujiang Maternity and Child Health Care Hospital, Jiujiang 332000, China; 2.Jiangxi Angtai Pharmaceutical Co., Ltd, Jiujiang 332300, China; 3.Campus Hospital of Zhejiang University, Hangzhou 310009, China)
OBJECTIVE To introduce the latest researches about active targeting liposomes. METHODS Review the strategies of adsorbing ligands onto the vector surface, the selection of targeted ligands and the application of active targeting liposomes through searching and summarizing relevant literatures. RESULTS There were three strategies of adsorbing ligands onto the vector surface: addition of ligands as components during the preparation liposomes, direct coupling method, and post insertion method. Active targeting of liposomes could deliver the cargo to target cells, tissues and even the intracellular localization, which could improve the drug bioavailability and produced no increase in toxicity towards normal tissue or cells. The drug-delivery system had become one of the most widely study of targeting drug-deliver systems in recent years. CONCLUSION The active targeting liposomes is a very promising drug delivery system.
active targeting liposomes; targeting drug-deliver systems; ligand
R944
A
1007-7693(2013)10-1151-06
2012-10-29
左勇亮,男,药师 Tel: 15879220142 E-mail: zyld-1@163.com*
肖人钟,男,硕士,工程师 Tel: (0792)2760867 E-mail: jimmyhz@aliyun.com
