响应面分析法优化微波辅助提取剑麻果胶的工艺
2013-03-06姚先超张雪红梁玉石林翠梧
姚先超,张雪红,梁玉石,周 红,林翠梧,*
(1.广西大学化学化工学院,广西 南宁 530004;2.广西民族大学化学化工学院,广西 南宁 530006;3.广西民族大学设备实验管理处,广西 南宁 530006)
响应面分析法优化微波辅助提取剑麻果胶的工艺
姚先超1,2,张雪红1,梁玉石3,周 红1,林翠梧1,*
(1.广西大学化学化工学院,广西 南宁 530004;2.广西民族大学化学化工学院,广西 南宁 530006;3.广西民族大学设备实验管理处,广西 南宁 530006)
以剑麻纤维生产过程中产生的废渣为原料,采用微波辅助技术从中提取果胶。首先通过单因素试验考察选取影响因素和相关水平,然后采用三因素三水平的响应面法分析设计优化微波功率、提取时间、溶液pH值等因素的组合试验,对果胶提取条件进行优化和显著性分析,依据回归分析确定最佳提取工艺条件为微波功率534W、提取时间9.8min、pH1.3,在此工艺条件下,剑麻果胶的提取率为6.10%,其半乳糖醛酸含量和酯化度分别为75.3%和72.09%。
响应面分析法;剑麻;果胶;微波;提取
剑麻(Agave sisalana Perrine)又名凤尾兰、千手兰、菠萝麻等,为龙舌兰科植物,原产于墨西哥尤卡坦半岛[1],其剑状单叶经压碾破碎后主要用于加工生产优质纤维[2]。现在巴西、坦桑尼亚等国及其他热带、亚热带地区均有广大分布和种植生产[3]。中国是世界第二大剑麻主产国,产量仅次于巴西;主要分布在海南、广西、广东、福建等省份[4]。在传统中医药草中,剑麻是一种非常有用的中草药植物,具有凉血止血、消肿止痛之功效,能够用于治疗肺痨咯血、痢疾以及痈疮肿毒等伤病[5]。由于纤维仅占剑麻质量的5%左右,其余部分在纤维生产中一般作为废叶废渣被丢弃[6],致使大量资源浪费。因此,研究如何更好地开发利用剑麻废液废渣变得尤为重要。
剑麻叶肉及其汁液中含有大量的天然成分如叶绿素、皂苷、氨基酸及果胶,其中皂素等成分已知具有药效作用[7]。从生产剑麻形成的废液中提取重要的甾体激素药物原料剑麻皂素[8],是目前对剑麻废液再利用最成功的例子,而关于其果胶多糖的研究则较少。果胶是一种应用广泛的食品添加剂;剑麻果胶作为天然多糖碳水合物,在动物急性毒性实验中未发现其具有毒性,相关指标符合国家食品添加剂标准,是一种有潜力的食用果胶资源[9]。
响应面优化法由数学分析方法和统计分析学方法组成,主要用于考察研究影响因素自变量及其相互之间的交互作用对变化过程因变量的影响,能够反映因素自变量和响应因变量之间的关系。响应面优化法是一种优化工艺过程条件的有效方法,已经广泛应用于化学工艺、生物工程、食品工业以及冶金等领域[10-12]。目前关于应用响应面优化微波提取剑麻果胶(A. sisalana pectic,ASP)的工艺研究还未见报道,本实验引入响应面法和微波辅助法以探讨快速高效提取剑麻果胶,以期今后工业化生产寻找理论依据。
1 材料与方法
1.1 材料与试剂
剑麻废渣由广西剑麻集团有限公司提供,干渣经粉碎后其粒度应低于100目。
浓盐酸、无水乙醇均为国产分析纯试剂;半乳糖醛酸和果胶标准品 美国Sigma公司。
1.2 仪器与设备
微波超声波组合萃取仪 北京祥鹄公司;冷冻真空干燥器 北京博医康仪器公司;AL204电子天平 梅特勒托利多仪器公司;RE-52旋转蒸发仪 上海亚荣生化公司;低速台式大容量离心机 上海安亭科学仪器厂;紫外-可见分光光度计 上海尤尼科仪器公司;FTIR红外光谱仪 美国Thermo Nicolet公司。
1.3 方法
1.3.1 剑麻果胶提取工艺
定量称取的剑麻渣粉末在常温条件下复水20min,在200目的滤布中洗涤2次并拧干。滤渣在90℃以上的水中高温灭酶10min,洗涤并拧干,反复3次。处理后的剑麻渣放入一定酸度的盐酸溶液(即料液比1:25(g/mL),麻渣浸入程度最佳)中,在恒定功率的微波辐射下,搅拌提取一段时间后,趁热过滤,挤干,同样条件反复提取3次。3次提取滤液汇集、冷却、离心,所得清液在减压旋转蒸发系统中浓缩。在搅拌状态下,将4倍体积的乙醇溶液加入冷却后的浓缩液中,在4℃环境下醇沉静置5h。然后,醇沉混合液以4700r/min的转速离心10min,收集胶状沉积物,以95%乙醇-0.1mol/L HCl(1:2,V/V)溶液溶解2次,每次都进行离心。最后,收集所得的沉积物在-45℃条件下真空冷冻干燥24h。称质量,按下式计算提取率:

1.3.2 单因素试验
称取10g剑麻渣粉末,在微波辐射作用下提取剑麻果胶,分别改变微波功率、pH值及时间等提取条件,考察这些因素对剑麻果胶提取率(Y,%)的总体影响趋势。每组对应条件进行3次重复实验,所得的果胶提取率取其平均值。
1.3.3 剑麻果胶提取工艺的响应面试验设计
根据Box-Behnken组合试验设计原理[13-14],通过单因素试验确定影响因素后,多因素三水平的设计方案可以在SAS软件(Version 9.2,SAS Institute)完成。
1.3.4 剑麻果胶的红外光谱
将适量的剑麻果胶与一定量的KBr混合研磨,压片。采用Nicollet Nexus FTIR于4000~400cm-1波数范围内扫描64次,分辨率为4cm-1。
1.3.5 剑麻果胶的酯化度测定
剑麻果胶的酯化度测定参照文献[15]的方法进行测定。1.3.6 剑麻果胶中半乳糖醛酸含量的测定
剑麻果胶中半乳糖醛酸含量通过硫酸咔唑比色法[16]进行测定,测定条件为浓硫酸用量6.0mL、水解温度70℃、水解时间20min、0.15%咔唑无水乙醇溶液用量为0.5mL,在室温条件下暗处显色,显色时间为30min,在530nm波长处测定其吸光度。
2 结果与分析
2.1 单因素试验
2.1.1 pH值对提取率的影响
在微波功率800W、提取时间10min条件下,选择pH值分别为0.5、1.0、1.5、2、3、4的溶液酸度,对剑麻果胶进行提取,其提取率随pH值的影响变化如图1所示。显然,溶液的酸度(pH值)对果胶的浸出影响很大。当pH值小于2时,较强的酸性可以有效地破坏细胞组织结构等因素对果胶分子封闭,提取率较大。酸性减弱时,原果胶难以完全转化为水溶性果胶,甚至只有少量低聚糖溶出,因此产率很小。所以,优化试验的pH值选择1.5较为合适。

图1 pH值对剑麻果胶提取率的影响Fig.1 Effect of pH of the extraction yield of ASP
2.1.2 微波功率对提取率的影响
保持条件pH1.0、提取时间10min,微波功率分别选择为200、400、500、700、800、1000W对剑麻果胶的提取效果的影响如图2所示。当微波功率较低时,检测到的温度较低,因此提取率较低。微波功率达到400W以上时,剑麻果胶的提取率明显增大,但600W以上的功率对提取率影响不明显,所以选择500W作为优化点。
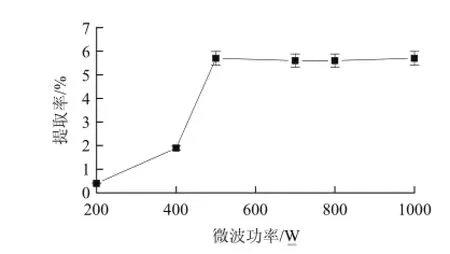
图2 微波功率对剑麻果胶提取率的影响Fig.2 Effect of microwave output power on the extraction yield of ASP
2.1.3 提取时间对提取率的影响
在微波功率800W、pH1.0条件下,提取时间分别为5、10、15、20、30、40min对剑麻果胶的提取效果的影响如图3所示。在5min内,提取时间对剑麻果胶产率的影响不明显。在5~10min期间,随着微波的不间断作用,物料和溶剂温度不断升高,细胞组织的不同部位升温率差异不断扩大,具有支链的高分子果胶也能够大量浸出,果胶得率随之增大。当进一步延长时间,果胶提取率并没有明显变化,说明大部分果胶在提取10min左右后已经溶出,所以选择10min作为进一步的优化条件。
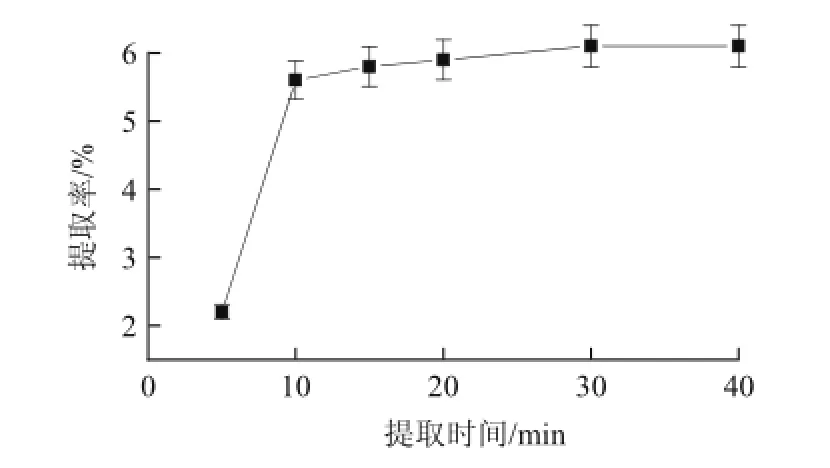
图3 提取时间对剑麻果胶提取率的影响Fig.3 Effect of extraction time on the extraction yield of ASP
2.2 响应面试验设计与优化分析
2.2.1 响应面分析因素水平的选取
综合单因素试验结果,pH值、微波功率、提取时间三因素对果胶的提取率有较为明显的影响。根据Box-Behnken的原理,在单因素数据结果的基础上,采取三因素三水平的响应面试验设计分析方法,试验因素与水平设计见表1。
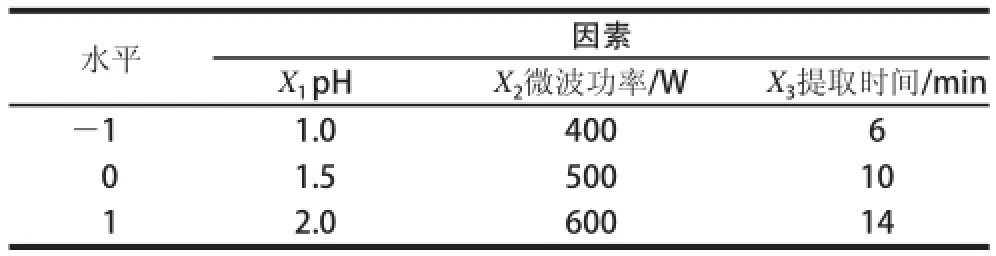
表1 响应面试验设计的因素变量和水平Table1 Coded levels for independent variables used in response surface analysis
2.2.2 响应面试验设计与结果
以pH值(X1)、微波功率(X2)、提取时间(X3)为自变量,以提取率(Y)为响应值,试验设计方案及结果见表2。

表2 Box-Behnken试验设计和结果Table2 Box-Behnken design and results
2.2.3 模型建立与显著性检验
在表2中,此15个试验选择分为响应面的析因点和零点,其中序号1~12的试验属于析因试验,序号13~15属于中心试验。析因点自变量在由X1、X2、X3因素所构成的三维顶点上取值,零点则在对应区域的中心点[17]。一般,零点试验要重复进行3次,以便用于试验的估计误差。由于各因素对提取率的影响均不是简单的线性关系,所以采用SAS-RSREG程序对表2中的响应值分别进行多元回归拟合[18],并确定各因素对响应值的影响,回归方差分析结果见表3。各因素经回归拟合后,响应变量Y对pH值、提取时间、微波功率的二次多项回归方程如下:
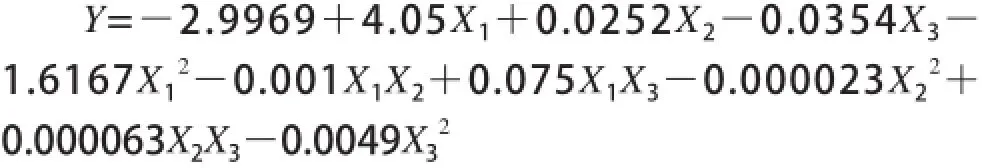
拟合方程的每个变量对响应值影响的显著程度,可以通过P值来判断[19],P值小则表示对应变量的影响显著性高。通常认为,模型在P≤0.05时水平显著,在P≤0.01时水平极显著,表明试验设计可靠。由表3可知,对于剑麻果胶多糖的提取率而言,pH值的一次项(X1)和二次项()均达到极显著水平,说明在该试验中pH值的影响是不可忽视的;微波功率的一次项(X2)和二次项(X22)均达到显著水平;其他项均P>0.05,说明其他2个因素自身作用或3个因素之间的交互作用不显著;由此可见回归模型不是简单的线性关系。回归模型的R2为95.63%,说明95.63%的响应值变化与所选的3个变量(pH值、提取时间和微波功率)相关;调整后R2仍然能够达到87.77%的相关度,而且模型显著水平P为0.0067,可见拟合方程能够较准确地描述所选因素变量与响应变量值之间的实际关系,可用于确定提取工艺条件。
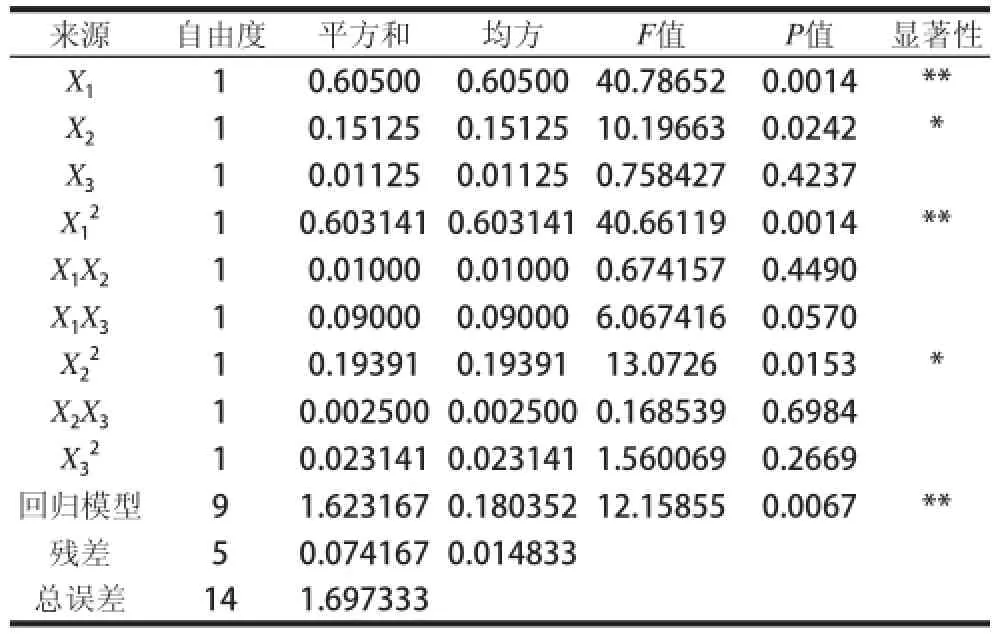
表3 响应面回归模型的方差分析(ANOVA)Table3 ANOVA for the response surface model
2.2.4 响应面分析
SAS软件对响应变量的变化趋势进行预测优化,并画出由响应值与因素变量构成的三维响应曲面和二维等高图线,能够对拟合模型进行直观分析。提取条件对剑麻果胶的提取率的响应面变化趋势如图4所示。比较此3组图可知,pH值(X1)对剑麻果胶提取的影响最为显著,表现为曲线较陡;其次是微波功率(X2);而提取时间(X3)最不明显,在曲面和等高线上表现较为平坦,也就是随着试验因素变量数值的增加或减少,引起的响应变量即提取率的变化值比较小[20]。说明各因素的主效应关系为:pH值(X1)>微波功率(X2)>提取时间(X3)。图4中3组响应曲面呈一定程度抛物曲面状,Y随因素变量的变化,极易出现一个最大值,此时最易与找出最佳优化条件。


图4 微波提取条件对剑麻果胶的提取率的响应面Fig.4 Response surface plot showing the interaction effects of three extraction conditions on the extraction yield of ASP
2.2.5 最佳提取工艺的优化及验证
回归方程的典型相关分析表明Y的稳定点为最大点,其值分别为6.14%,无需进行进一步的岭脊分析(ridge analysis)。最后,通过SAS软件的最优化模型回归分析得到最佳的提取工艺条件为pH1.3、微波功率533.7W、提取时间9.75min,此条件下剑麻果胶提取率的预测值为6.14%。为便于实际操作,将最佳提取工艺修正为pH1.3、微波功率534W、提取时间9.8min。
为验证响应面法所得结果的可靠性,在上述修正条件下,采用微波辅助提取法对同处理批次的剑麻渣粉进行果胶提取,进行3次验证实验,计算所得产品的得率,平均提取率为6.10%,结果与预测值相近。验证表明,拟合模型对于剑麻果胶提取率有较好的预测能力。
2.3 剑麻果胶的特征
剑麻果胶和标准品果胶(柑橘)的红外光谱对比如图5所示。由红外图谱可知,剑麻果胶在500~4000cm-1范围内具有糖类的特征吸收峰,其峰形和变化趋势与柑橘标准品果胶类似。在3100~3600cm-1之间存在碳环上的O—H的吸收宽峰,2950~2750cm-1附近的吸收峰则由半乳糖醛酸甲酯或碳环上(—CH3、—CH2、—CH)上的C—H的伸缩振动引起的。1760~1745cm-1与1640~1620cm-1处的强吸收峰分别由羧酸酯的羰基基团(COOR)和自由羧酸的羧基(COO—)伸缩振动引起[21]。1650~1550cm-1附近的吸收为非对称伸缩吸收峰,即羧基有两个谱带;1400cm-1附近出现较弱的吸收由饱和C—H键的弯曲振动吸收引起。这些吸收峰均属多糖化合物所特有的特征性吸收峰[22]。
通过测定,微波提取法获得的剑麻果胶的半乳糖醛酸含量能达到75.3%,酯化度达72.09%。可见,微波提取法获得的剑麻果胶纯度较高,酯化度也比较高。

图5 在优化的微波条件下获得的剑麻果胶的红外光谱图Fig.5 FTIR spectra of pectin standard and ASP extracted under the optimal conditions
3 结 论
溶液pH值、微波功率、提取时间对微波提取剑麻果胶均有不同程度的影响,其中pH值和微波功率对提取率的影响较大。本实验通过响应面分析法优化得出的最佳提取工艺条件为:pH1.3、微波功率534W、提取时间9.8min,与验证实验相符,在此条件下,剑麻果胶提取率为6.10%,半乳糖醛酸含量和酯化度分别为75.3%和72.09%。
[1] ROBERTA X S, ANA C S C, MARIANA B, et al. Action of sisal (Agave sisalana Perrine) extract in the in vitro development of sheep and goat gastrointestinal nematodes[J]. Experimental Parasitology, 2012, 131(2): 162-168.
[2] 吴学锋, 罗志祥, 陈海艳. 剑麻纤维生产与应用[J]. 中国纤检, 2010(2): 59-61.
[3] 薛刚, 王越川. 近十年世界剑麻生产与贸易概括[J]. 热带农业科学, 2010, 30(4): 62-66.
[4] 中国农业年鉴编辑委员会. 2009中国农业年鉴[M]. 北京: 中国农业出版社, 2009: 209-210.
[5] 国家中医药管理局中华本草编委会. 中华本草[M]. 上海: 科学技术出版社, 1999.
[6] OASHI M C G. Estudo da cadeia produtiva como subsídio para pesquisa e desenvolvimento do agronegócio do sisal na Paraíba[D]. Santa Catarina: Federal University of Santa Catarina, 1999.
[7] SANTOS J D G, BRANCO A, SILVA A F, et al. Antimicrobial activity of Agave sisalana[J]. African Journal of Biotechnology, 2009, 8: 6181-6184.
[8] 韩广甸, 马兆扬. 我国利用剑麻皂素合成甾体药物的研究进展[J].中国医药工业杂志, 2002, 33(9): 459-464.
[9] 韩耀玲. 剑麻的综合利用[D]. 南宁: 广西大学, 2004.
[10] 涂行浩, 张弘, 郑华, 等. 响应面法优化微波钝化玛咖黑芥子酶活[J].食品科学, 2011, 32(18): 148-153.
[11] KURT S, ZORBA O. Response surface optimization of pH and ionic strength for emulsion characteristics of egg yolk[J]. Poultry Science, 2009, 88: 2422-2427.
[12] 马少健, 梁玉石, 封金鹏, 等. 应用响应面设计分析法研究碳酸锰吸收微波的性能[J]. 有色金属: 冶炼部分, 2012(2): 9-15.
[13] BOX G E P, BEHNKEN D W. Some new three level designs for the study of quantitative variables[J]. Technometrics, 1960, 2: 455-475.
[14] SHEIN C C. Encyclopedia of biopharmaceutical statistics[M]. 3rd. London: Informa Healthcare, 2010: 1171-1179.
[15] 姚先超, 张雪红, 韦金锐, 等. 小波变换漫反射红外光谱法测定剑麻果胶的酯化度[J]. 分析测试学报, 2011, 30(3): 274-278.
[16] 丁建东, 张雪红, 姚先超, 等. 咔唑比色法测定剑麻果胶含量[J]. 食品研究与开发, 2010, 31(11): 138-140.
[17] 李蕾, 岳喜华, 于欢, 等. 响应面法优化酸浆果多糖的提取工艺[J].食品与生物技术学报, 2009(1): 53-56.
[18] 应芝, 励建荣, 韩晓祥. 响应面分析法优化桑叶多糖提取工艺的研究[J]. 中国食品学报, 2008, 8(4): 39-45.
[19] SHENGLI Y, HUI Z. Optimization of cholesterol oxidase production by Brevibacterium sp. employing response surface methodology[J]. African Journal of Biotechnology, 2012, 24: 8316-8322.
[20] 褚福红, 陆宁, 于新, 等. 响应面法优化微波提取野菊花抗氧化物质[J]. 食品科学, 2010, 31(24): 90-94.
[21] GNANASAMBANDAM R, PROCTOR A. Determination of pectin degree of esterifcation by disffuse reflectance Fourier transform infrared spectroscopy[J]. Food Chemistry, 2000, 68(3): 327-332.
[22] FELLAHA, ANJUKANDI P, WATERLAND M R, et al. Determining the degree of methyl esterification of pectin by ATR/ FT-IR: methodology optimisation and comparison with theoretical calculations[J]. Carbohydrate Polymers, 2009, 78(4): 847-853.
Optimization of Microwave-Assisted Extraction of Pectic Polysaccharides from Agave sisalana Perrine by Response Surface Methodology
YAO Xian-chao1,2,ZHANG Xue-hong1,LIANG Yu-shi3,ZHOU Hong1,LIN Cui-wu1,*
(1. School of Chemistry and Chemical Engineering, Guangxi University, Nanning 530004, China;2. School of Chemistry and Chemical Engineering, Guangxi University for Nationalities, Nanning 530006, China;3. Department of Facility and Laboratory Management, Guangxi University for Nationalities, Nanning 530006, China)
The microwave-assisted extraction of pectic polysaccharides from sisal wastes left over after fiber production was investigated. Response surface methodology (RSM) based on a three-level, three-variable Box-Behnken design was applied to optimize three extraction conditions including microwave output power, extraction time and solvent pH. The optimum extraction conditions were found to be 534 W, 9.8 min and pH 1.3. The yield of ASP (pectic from Agave sisalana Perrine) under the optimized conditions was 6.10% and galacturonic acid content and esterification degree of the extract were 75.3% and 72.09%, respectively.
response surface methodology;Agave sisalana;pectic;microwave;extraction
TQ432.71
A
1002-6630(2013)18-0056-05
10.7506/spkx1002-6630-201318012
2012-08-22
广西自然科学基金项目(2010GXNSFA013038;2011GXNSFA018051);广西博士研究生创新基金资助项目(105931001008);广西科技攻关项目(桂科攻1355003-15)
姚先超(1984—),男,硕士,研究方向为天然药物化学。E-mail:yxc2772552@163.com
*通信作者:林翠梧(1958—),女,教授,博士,研究方向为天然资源开发与利用。E-mail:lincuiwu@126.com
