基于混合床离子交换树脂脱盐的草鱼肽及其理化性质
2013-03-06陈季旺夏文水
崔 诚,陈 悦,陈季旺,*,夏文水,2
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.江南大学食品学院,江苏 无锡 214122)
基于混合床离子交换树脂脱盐的草鱼肽及其理化性质
崔 诚1,陈 悦1,陈季旺1,*,夏文水1,2
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.江南大学食品学院,江苏 无锡 214122)
研究混合床离子交换树脂对草鱼肽的脱盐工艺条件,并分析脱盐后草鱼肽的理化性质。结果表明:脱盐的较佳工艺条件为上样质量浓度10mg/mL、流速6BV/h、pH7.0、阴阳离子树脂混合比例为2:3。在该工艺条件下,脱盐率达到81.7%,肽回收率为80.5%,草鱼肽灰分从17.5%降低到3.2%,肽含量从80.9%增加到90.3%。脱盐后草鱼肽的相对分子质量分布范围主要集中在190~1000之间,含量达到了91.5%;溶解度在pH2~10范围内均大于95%,溶液质量浓度达到40g/100mL时,其黏度只有4.5mPa·s,具有高质量浓度、低黏度的特点。
草鱼肽;混合床离子交换树脂;理化性质
鱼源寡肽是利用蛋白酶特异性水解鱼类蛋白质产生的一类相对分子质量在200~10000之间的肽类物质。鱼源寡肽不仅具有鱼源蛋白质的优点,同时还具有良好的溶解性、热稳定性等理化性质以及易消化吸收等生理功能。目前,研究酶水解法制备寡肽成为鱼类加工中的一个前沿课题[1-3]。草鱼是7种大宗淡水鱼类之一,食性简单,饵料来源广泛,肉质肥嫩,味鲜美,且生长迅速,产量高。2010年,我国7种大宗淡水鱼的总产量为1623.4万t,草鱼产量占淡水鱼总产量的18%。因此,草鱼是一种良好的制备鱼源寡肽的原料来源[4]。
在酶解鱼源蛋白质生产寡肽的过程中,需不断地加入碱液中和酶解蛋白质产生的H+维持反应体系的pH值恒定,鱼源寡肽的盐分含量较高,主要为NaCl。这些盐分的存在影响了鱼源寡肽的风味、理化性质和生物活性,需要进行脱盐处理[5-6]。目前生物活性物质的脱盐方法主要有透析、超滤和纳滤等,但是这些方法对小分子物质脱盐效果不佳或无法实现[7-10]。尽管大孔吸附树脂用于小分子物质的脱盐具有选择性好、再生处理方便、吸附迅速以及解吸容易、对脱盐原料理化性质影响小等特点,但是由于其只吸附疏水性高的小分子物质,回收率不高,且我国对大孔吸附树脂在保健食品及其原料生产过程有严格的限制[11-14]。
离子交换树脂由于交换容量高、交换速度快、吸附容量大、选择性好、易于解吸附、化学性能稳定、不溶于酸、碱及任何有机溶剂等,常用于去除水中各种阴阳离子和氨基酸的分离[15-17]。传统的离子交换树脂脱盐采用分别通过阴阳离子交换树脂,脱盐过程繁琐,并且由于离子交换过程中会使体系的pH值不稳定,导致许多寡肽分子在溶液中带有电荷,造成了寡肽的损失[17]。混合床离子交换树脂脱盐过程中,体系pH值比较稳定以及阴阳离子的相互作用都会大大减少寡肽的损失[18]。
本实验通过研究混合床离子交换树脂对酶解制备草鱼肽的脱盐效果,确定其较佳脱盐工艺条件,并分析脱盐后草鱼肽的理化性质,为草鱼肽的工业化生产以及后续结构与生化性质关系分析提供依据。
1 材料与方法
1.1 材料与试剂
新鲜草鱼 武汉市购。
001×16(Na)型阳离子交换树脂、D301-G(Cl)型阴离子交换树脂 江苏苏青水处理工程集团有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Delta320精密pH计 梅特勒-托利多仪器(上海)有限公司;DDS-11C电导率仪 上海雷磁仪器厂;LD5-10型离心机 北京医用离心机厂;LG-3型冷冻干燥机 宁波市生化仪器厂;HL-2S恒流泵 上海沪西分析仪器厂;UV-2100紫外-可见分光光度计 上海尤尼柯仪器有限公司;TGL-16C高速离心机 上海安亭仪器有限公司;NDJ-79型旋转黏度计 上海昌吉地质仪器有限公司;超滤装置(聚砜中空纤维超滤膜,膜面积为0.1m2,尺寸为Ф40mm×300mm,截留相对分子质量10000) 上海亚东核级树脂有限公司;600高效液相色谱仪(配2487紫外检测器和Empower工作站) 美国Waters公司。
1.3 方法
1.3.1 原料成分分析
蛋白质含量的测定:采用微量凯氏定氮法(GB/T 5009.5—2010《食品中蛋白质的测定》),转换系数F=6.25;水分的测定:采用105℃恒质量法(GB/T 5009.3—2010《食品中水分的测定》);灰分的测定:采用550~600℃灰化法(GB/T 5009.4—2010《食品中灰分的测定》);肽含量测定:参考GB/T 22729—2008《海洋鱼低聚肽粉》。
1.3.2 草鱼肽的制备
草鱼肉经绞碎匀浆,配成30g/100mL的溶液,调pH9.0,在50℃条件下,按48AU/kg的酶与底物比加入一定量的碱性蛋白酶酶解2h,然后调pH7.0,按2:1的比例添加一定量的中性蛋白酶酶解30min,酶解完成后调pH5.5灭酶15min,3000r/min离心20min,收集上清液调节pH7.0进行超滤,真空浓缩,冷冻干燥得到草鱼肽。
1.3.3 超滤预处理
在室温条件下,操作压力为0.1MPa,将50mg/mL的草鱼肽溶液注入储槽中,在泵的推动力下,溶液经微滤后进入超滤膜中。从中空纤维膜的内壁渗透出来的小分子寡肽是超滤液,溶液中的大分子多肽等被截留浓缩,返回到储槽中;如此反复循环,收集超滤液[19]。
1.3.4 混合床离子交换树脂脱盐
1.3.4.1 不同流速对草鱼肽脱盐效果的影响
在室温条件下,将10mg/mL的草鱼肽溶液pH值调为7.0,分别以1、2、4、6、8BV/h的流速通过阴、阳离子按3:2的比例组成的混合床进行脱盐,收集流出液,测定电导率和肽含量,按式(1)、(2)计算电导率变化率和肽回收率,确定较佳的流速。

1.3.4.2 pH值对脱盐效果的影响
在室温条件下,将10mg/mL的草鱼肽溶液pH值分别调为5.0、6.0、7.0、8.0、9.0,以较佳的流速通过阴、阳离子按3:2的比例组成的混合床进行脱盐,收集流出液,测定电导率和肽含量,并计算肽回收率和电导率变化率,确定较佳的pH值。
1.3.4.3 阴阳离子交换树脂比例对脱盐效果的影响
在室温条件下,将10mg/mL的肽溶液调为较佳的pH值,以较佳的流速通过阴、阳离子按1:2、2:3、1:1、3:2、2:1比例组成的混合床进行脱盐,收集流出液,测定电导率和肽含量,并计算肽回收率和电导率变化率,确定较佳的树脂比例。
1.3.5 溶解性的测定
将2g草鱼肽加入100mL水中,用1.0mol/L盐酸和1.0mol/L氢氧化钠溶液调节pH2~10,室温条件下1000r/min搅拌1h,3000r/min离心20min,测上清液中肽含量[19],溶解度按公式(3)计算。

1.3.6 黏度的测定
在室温条件下,将草鱼肽配制成5、10、20、30g/100mL和40g/100mL,pH7.0的溶液,测定溶液的表观黏度。对比草鱼蛋白和草鱼肽的黏度,分析黏度的变化[19]。
1.3.7 相对分子质量分布测定
高效液相色谱仪:Waters 600/2487;色谱柱:TSKgel G2000 SWXL 300mm×7.8mm;流动相:乙腈-水-三氟乙酸(45:55:0.1,V/V);检测波长:220nm;柱温:30℃;流速:0.5mL/min。相对分子质量标准品:细胞色素C(Mr12500)、抑肽酶(Mr6500)、杆菌酶(Mr1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mr451)和乙氨酸-乙氨酸-乙氨酸(Mr189)[20]。
2 结果与分析
2.1 混合床离子交换树脂脱盐
2.1.1 不同流速对草鱼肽脱盐效果的影响
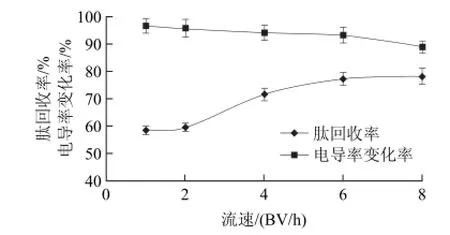
图1 不同流速条件下草鱼肽的肽回收率和电导率变化率Fig.1 Effect of sample loading flow rate on peptide recovery and conductivity
从图1可以看出,随着流速的增加,脱盐后的草鱼肽溶液电导率变化率不断减小,肽回收率不断增加。当流速从1BV/h增加到8BV/h时,脱盐后草鱼肽溶液的电导率从107.3μS/cm增加到292μS/cm,电导率变化率从96.6%降低到88.9%,肽回收率从58.6%增加到78.2%。这可能是由于流速过快时,草鱼肽溶液与树脂接触时间很短,脱盐率降低;流速较慢时,草鱼肽溶液与树脂接触时间很长,树脂对溶液中的草鱼肽分子吸附程度增加,造成了肽的损失较大,肽回收率较低[18]。综合考虑,选择流速为6BV/h,此时的电导率变化率为93.2%,肽回收率为77.2%。
2.1.2 pH值对草鱼肽脱盐效果的影响
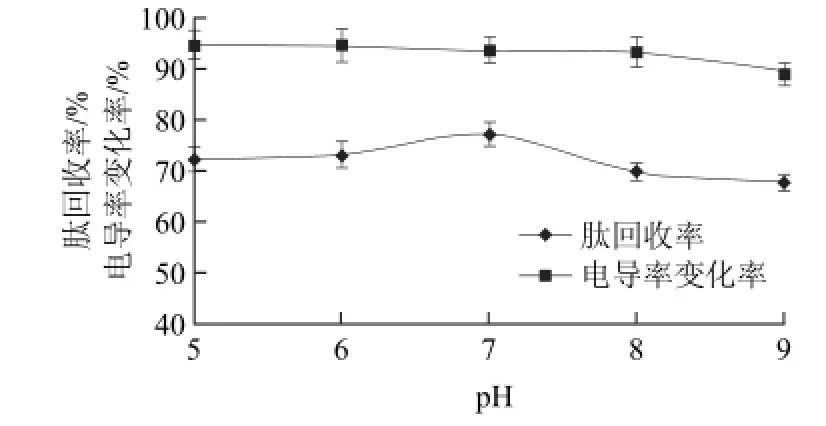
图2 不同pH值条件下草鱼肽的肽回收率和电导率变化率Fig.2 Effect of pH on peptide recovery and conductivity
从图2可以看出,pH值对肽回收率影响较大,对电导率变化率的影响不明显。pH5~7范围内,脱盐后的草鱼肽溶液电导率从170.6μS/cm增加到173.3μS/cm,电导率变化率从94.6%降低到93.7%,肽回收率从72.2%增加到77.2%;pH7~9范围内,脱盐后的草鱼肽溶液电导率从173.3μS/cm增加到347.0μS/cm,电导率变化率从93.7%降低到89.8%,肽回收率从77.2%降低到67.7%。这可能是由于溶液的pH值会影响到体系的离子化程度,当pH值偏小或偏大时,溶液的离子化程度较大,树脂对溶液中的草鱼肽分子吸附程度增加,肽损失较多[18]。综合考虑,选择pH7.0为较佳的pH值,此时的电导率变化率为93.7%,肽回收率为77.2%。
2.1.3 阴、阳离子交换树脂比例对草鱼肽脱盐效果的影响
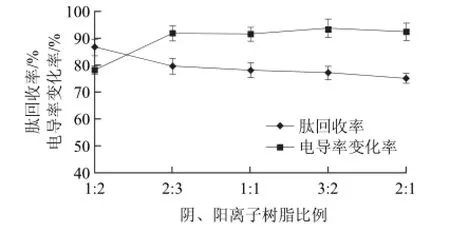
图3 不同树脂比例条件下草鱼肽的肽回收率和电导率变化率Fig.3 Effect of anion/cation exchange resin ratio on peptide recovery and conductivity
阴、阳离子树脂混合比例对草鱼肽脱盐效果的影响见图3。可以看出,阴、阳离子树脂混合比例在1:2~2:3范围,脱盐后草鱼肽溶液电导率从529.0μS/cm降低到191.1μS/cm,电导率变化率从78.3%增加到91.8%,肽回收率从86.7%降低到79.7%;阴、阳离子树脂混合比例在2:3~2:1范围,脱盐后草鱼肽溶液电导率变化率基本不变,肽回收率从79.7%降低到75.2%。这可能是由于大孔型离子交换树脂有较多的物理孔隙,吸附能力强,而凝胶型离子交换树脂吸附能力相对较弱。实验中的D301-G型阴离子树脂是大孔型离子交换树脂,001×16型阳离子树脂是凝胶型离子交换树脂,随着混合床中阴离子树脂所占比例的增加,体系对草鱼肽的吸附能力也不断增加,造成了肽的损失,同时阴、阳离子比例混合不当也会使脱盐过程中体系pH值发生比较明显的变化,从而造成寡肽的损失[18]。综合考虑,选择阴、阳离子树脂混合比例为2:3。
2.1.4 混合床阴阳离子交换树脂脱盐前后草鱼肽的成分
综合单因素试验结果,确定草鱼肽脱盐的较佳工艺条件为上样质量浓度10mg/mL、流速6BV/h、pH7.0、阴、阳离子树脂混合比例为2:3。在该工艺条件下对草鱼肽进行脱盐,收集的脱盐液经真空浓缩和冷冻干燥后得到草鱼肽,脱盐率为81.7%,肽回收率为80.5%,其成分分析结果见表1。脱盐后的草鱼肽肽含量明显增加,从80.9%增加到90.3%,灰分含量明显降低,从17.5%降低到3.2%,脱盐效果良好。
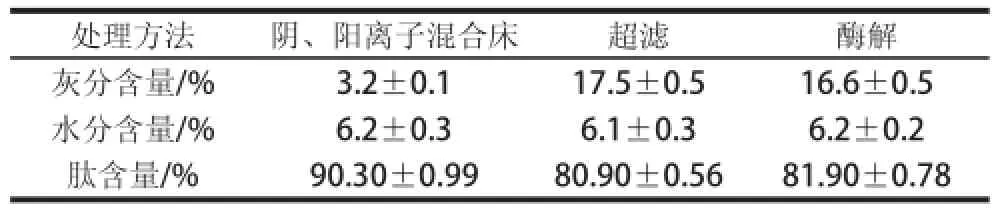
表1 草鱼肽脱盐前后的成分Table1 The components of grass carp peptides between desalination and undesalination
2.2 草鱼肽和草鱼蛋白的溶解性
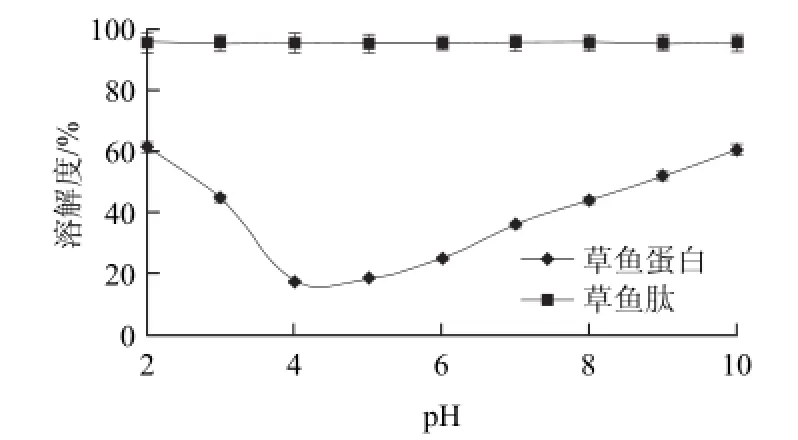
图4 草鱼蛋白和草鱼肽在不同pH值时的溶解性Fig.4 Comparison of the effect of different desalination techniques on components of GCPs
对草鱼蛋白和草鱼肽在pH2~10范围内的溶解度进行了测定,结果见图4。在pH2~10范围,脱盐后草鱼肽的溶解度明显高于草鱼蛋白。当在pH2~4范围,草鱼蛋白的溶解度由61.5%下降到17.7%;pH4~10范围,其溶解度由17.7%增加到60.8%。草鱼肽在pH2~10范围内,溶解度基本上没变化,并且均大于95%。可能是草鱼蛋白酶解后,极性基团(—COOH和—NH2)增加,分子表面电荷增多,加强了分子与水溶液之间的静电作用。由于草鱼肽具有良好的溶解性,且不受pH值的影响,因此适用于酸性和高蛋白饮品。
2.3 草鱼肽和草鱼蛋白溶液的黏度
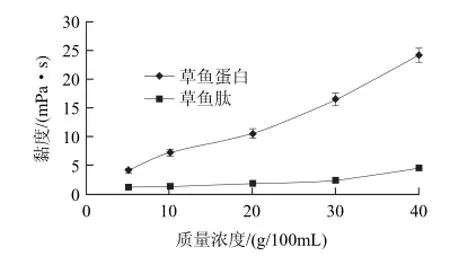
图5 不同质量浓度草鱼肽和草鱼蛋白的黏度Fig.5 Effect of peptide concentration on the viscosity of GCPs
不同质量浓度草鱼肽和草鱼蛋白的黏度变化见图5。在不同质量浓度范围内,脱盐后草鱼肽的黏度明显低于草鱼蛋白。可能是草鱼蛋白经酶解后,分子质量和分子体积减小,使得分子的有序性增加,导致黏度下降。草鱼肽的黏度随着质量浓度的增加而逐渐增大,在5~20g/100mL的低质量浓度范围,黏度很小且变化缓慢,从1.1mPa·s增加到1.8mPa·s。在20~40g/100mL的高质量浓度范围,黏度变化较快,从1.8mPa·s增加到4.5mPa·s。草鱼肽溶液质量浓度达到40g/100mL,其黏度只有4.5mPa·s,说明草鱼肽具有高质量浓度、低黏度的特点,适用于高蛋白流体食品。
2.4 草鱼肽和草鱼蛋白的相对分子质量分布
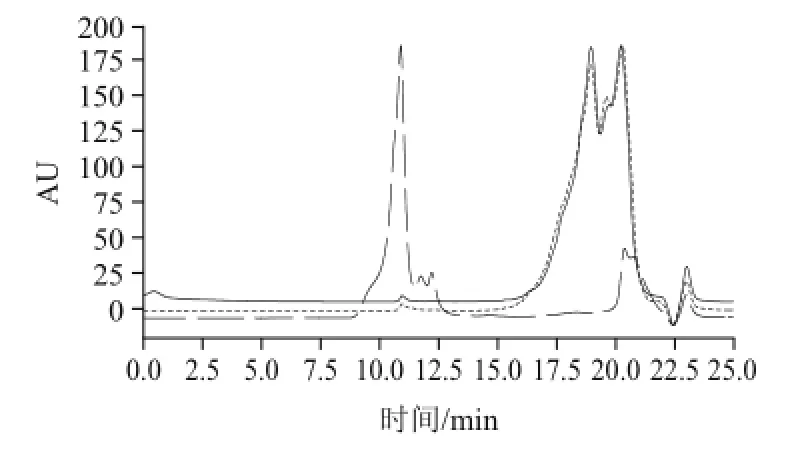
图6 草鱼蛋白、脱盐前后草鱼肽的相对分子质量分布Fig.6 HPLC patterns of grass carp protein, GCPs and desalinated GCPs
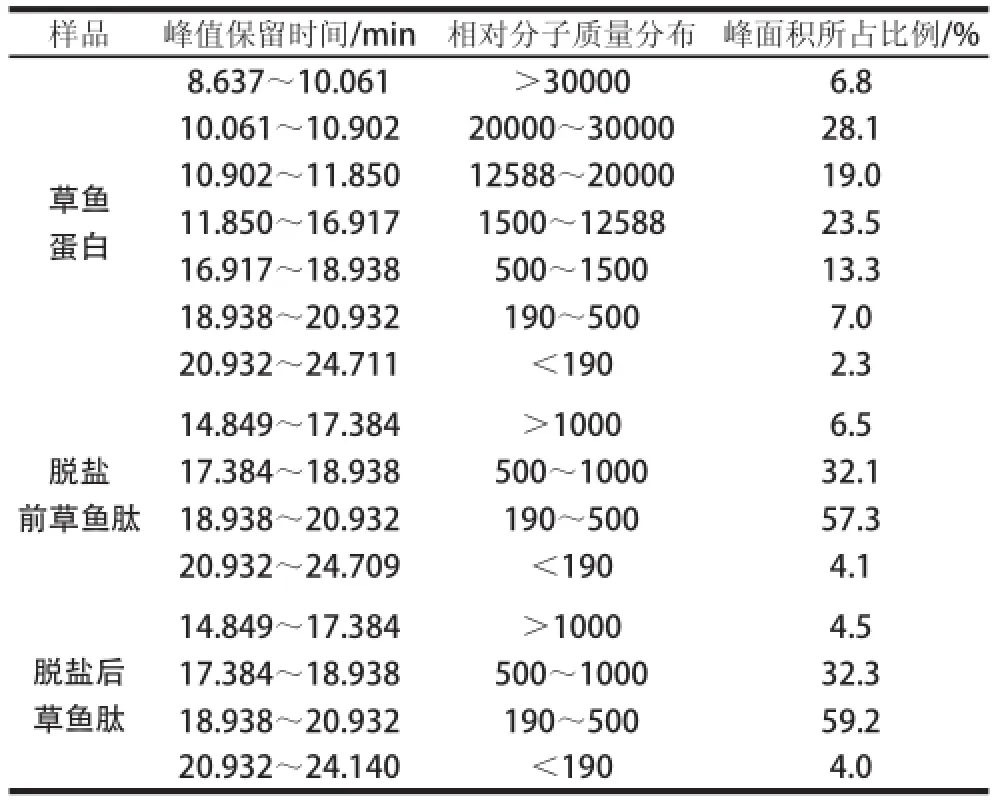
表2 草鱼蛋白、脱盐前后草鱼肽的相对分子质量分布Table2 Relative molecular mass distribution of grass carp protein, GCPs and desalinated GCPs
草鱼蛋白、脱盐前草鱼肽和脱盐后草鱼肽的相对分子质量分布结果见图6和表2。草鱼蛋白相对分子质量分布范围较广,相对分子质量大于1500的肽组分含量高达77.4%;酶解制备的草鱼肽相对分子质量明显降低且分布范围较窄,主要集中在190~1000之间;脱盐前后的草鱼肽相对分子质量分布基本没有变化,只是相对分子质量1000以上组分的含量从6.5%降低到4.5%,说明在精制脱盐过程中,损失了一定量的大分子多肽,小分子寡肽含量基本没有损失。脱盐后草鱼肽相对分子质量在1000以上和190以下组分的含量较低,分别为4.5%和4.0%;其次为相对分子质量在500~1000之间的组分,含量为32.3%;相对分子质量在190~500之间的组分含量最高,为59.2%。说明草鱼肽主要是由一些相对分子质量较低的寡肽组成。
3 结 论
3.1 混合床离子交换树脂对草鱼肽脱盐的较佳工艺条件为:上样质量浓度10mg/mL、流速6BV/h、pH7.0、阴阳离子树脂混合比例为2:3。在该工艺条件下脱盐率达到81.7%,肽回收率为80.5%。脱盐后的肽含量从超滤后的80.9%增加到90.3%,灰分从17.5%降低到3.2%,说明混合床离子交换树脂能较好的脱去草鱼肽中的盐,且小分子寡肽损失较少,可用于草鱼肽的工业化脱盐精制。
3.2 脱盐后草鱼肽的相对分子质量分布范围主要集中在190~1000之间,含量达到了91.5%;草鱼肽的溶解度在pH2~10范围内均大于95%以上,适用于酸性和高蛋白饮品;草鱼肽具有高质量浓度、低黏度的特点,适用于高蛋白流体食品。
[1] 夏文水, 姜启兴, 许艳顺. 我国水产加工业现状与进展: 下[J]. 科学养鱼, 2009(12): 1-3.
[2] NAJAFIAN L, BABJI A S. A review of fish-derived antioxidant and antimicrobial peptides: their production, assessment, and applications[J]. Peptides, 2012, 33(1): 178-185.
[3] SENEVIRATHNE M, KIM S K. Development of bioactive peptides from fish proteins and their health promoting ability[J]. Advances in Food and Nutrition Research, 2012, 65: 235-248.
[4] 中国农业年鉴编辑委员. 中国农业年鉴[M]. 北京: 中国农业出版社, 2010.
[5] ADLER-NISSEN J. Enzymatic hydrolysis of food protein[M]. London: Elsevier Applied Science Publishers LTD, 1986: 122-144.
[6] AGYEI D, DANQUAH M K. Industrial-scale manufacturing of pharmaceutical-grade bioactive peptides[J]. Biotechnology Advances, 2011, 29: 272-277.
[7] ZHANG X, LI C R, WANG X L, et al. Recovery of hydrochloric acid from simulated chemosynthesis aluminum foils wastewater: an integration of diffusion dialysis and conventional electrodialysis[J]. Journal of Membrane Science, 2012, 409/410: 257-263.
[8] BENHABILES M S, ABDI N, DROUICHE N, et al. Fish protein hydrolysate production from sardine solid waste by crude pepsin enzymatic hydrolysis in a bioreactor coupled to an ultrafiltration unit[J]. Materials Science and Engineering C, 2012, 32: 922-928.
[9] van der BRUGGEN B, M☒NTT☒RI M, NYSTR☒M M. Drawbacks of applying nanofiltration and how to avoid them: a review[J]. Separation and Purification Technology, 2008, 63: 251-263.
[10] HILAL N, A1-ZOUBI H, DARWISH N A, et al. A comprehensive review of nanofiltration membranes: treatment, pretreatment, modelling, and atomic force microscopy[J]. Desalination, 2004, 170: 281-308.
[11] MILLS G C. Removal of salts from aromatic amino acids, their metabolites and related compounds using an XAD-4 resin[J]. Journal of Chromatography A, 1986, 355: 193-200.
[12] 陈季旺, 孙勤, 夏文水. 鱼降压肽的大孔吸附树脂脱盐及理化性质[J]. 食品科学, 2009, 30(24): 158-162.
[13] ZHANG Fengxiang, WANG Zhang, XU Shiying. Macroporous resin purification of grass carp fish (Ctenopharyngodon idella) scale peptides with in vitro angiotensinⅠconverting enzyme (ACE) inhibitory ability[J]. Food Chemistry, 2009, 117(3): 387-392.
[14] 国食药监注[2005]202号. 应用大孔吸附树脂分离纯化工艺生产的保健食品申报与审评规定(试行)[S]. 北京: 国家食品药品监督管理局, 2005.
[15] CHIARLE S, RATTO M, ROVATTI M. Mercury removal from water by ion exchange resins adsorption[J]. Water Research, 2000, 34(11): 2971-2978.
[16] MOREIRA M J A, GANDO-FERREIRA L M. Separation of phenylalanine and tyrosine by ion-exchange using a strong-base anionic resin.Ⅰ. Breakthrough curves analysis[J]. Biochemical Engineering Journal, 2012, 67: 231-240.
[17] MOREL A, ZUO K C, XIA X, et al. Microbial desalination cells packed with ion-exchange resin to enhance water desalination rate[J]. Bioresource Technology, 2012, 118: 43-48.
[18] JANVION P, MOTELLIER S, PITSCH H. Ion-exchange mechanisms of some transition metals on a mixed-bed resin with a complexing eluent[J]. Journal of Chromatography A, 1995, 715: 105-115.
[19] 孙勤. 鱼降压肽的脱盐、纯化及生化性质[D]. 武汉: 武汉工业学院, 2009.
[20] 王毅梅. 草鱼源ACE抑制肽的分离纯化及定量构效研究[D]. 武汉:武汉工业学院, 2009.
Desalination Using Mixed-Bed Ion Exchange Resin and Physiochemical Properties of Grass Carp Peptides
CUI Chen1,CHEN Yue1,CHEN Ji-wang1,*,XIA Wen-shui1,2
(1. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China;2. School of Food Science and Technology, Jiangnan Unviersity, Wuxi 214122, China)
In the present study, we investigated the process conditions for desalinating grass carp peptides (GCPs) using mixed-bed ion exchange resin and characterized desalinated GCPs. The optimal desalination conditions for GCPs were sample concentration of 10 mg/mL, loading flow rate of 6 BV/h, pH 7.0 and anion/cation exchange resin ratio of 2:3. Under these conditions, the desalination rate was 81.7% and the peptide recovery was 80.5%; meanwhile, the ash content in GCPs was reduced from 17.5% to 3.2%, and the peptide content was increased from 80.9% to 90.3%. The relative molecular mass of desalinated GCPs was mostly distributed in the range of 190 to 1000 in an amount of 91.5%, solubility was greater than 95% in the pH range of 2 to 10, and viscosity was only 4.5 mPa•s at the concentration of 40 g/100 mL.
grass carp peptides;mixed-bed ion exchange resin;physiochemical properties
TS254.9
A
1002-6630(2013)18-0023-05
10.7506/spkx1002-6630-201318005
2012-08-21
国家现代农业产业技术体系建设专项(CARS-46);国家“863”计划项目(2010AA023003);武汉工业学院研究生创新基金项目(2010CX014)
崔诚(1988—),男,硕士,研究方向为水产品加工及贮藏工程。E-mail:Cuicheng.2008@163.com
*通信作者:陈季旺(1970—),男,教授,博士,研究方向为水产品加工及贮藏工程。E-mail:jiwangchen1970@126.com
