耐盐薄荷的离体培养与植株再生的研究
2013-03-06王贻莲魏艳丽李纪顺杨合同
王贻莲,魏艳丽,李纪顺,杨合同
(山东省科学院中日友好生物技术研究中心/山东省应用微生物重点实验室,济南,250014)
耐盐薄荷的离体培养与植株再生的研究
王贻莲,魏艳丽,李纪顺,杨合同
(山东省科学院中日友好生物技术研究中心/山东省应用微生物重点实验室,济南,250014)
为研究耐盐薄荷的快速繁育技术,以耐盐的椒样薄荷茎段为外植体,采用正交试验4(23)筛选其愈伤诱导培养基。研究结果表明,NAA是影响耐盐薄荷诱导愈伤能力的重要因素,其最适浓度为0.2 mg/L,愈伤诱导率达92%以上。在此基础上,通过扩大培养基中6-BA浓度进行不定芽增殖培养基筛选,最终确定增殖培养基为2/3 MS+5.0 mg/L 6-BA+0.2 mg/L NAA+30 g/L蔗糖+4 g/L琼脂,pH值6.0(灭菌前);此培养基下培养,增殖系数达19.23。在诱导生根培养基的筛选中,综合分析植株生长量(株高)、生根数量(根数)及根生长量(根长),确定生根培养基为1/2 MS+0.2 mg/L NAA+30 g/L蔗糖+4 g/L琼脂,pH值6.0。
椒样薄荷;离体培养;诱导;增殖;植株再生
土壤盐渍化问题是困扰农业生产的一大难题。当前,世界上灌溉地面积约为230 Mhm2,其中遭盐害影响的土壤约占45 Mhm2。旱地农业面积约为1 500 Mhm2,其中遭盐害影响的土壤约占32 Mhm2。耕地土壤盐渍化的退化面积正在以3 hm2/min的速度增长。据FAO估计,世界范围内,每年因盐害丧失生产力的土地面积达0.25 M~0.50 Mhm2[1]。就我国而言,在1亿hm2耕地中有667万hm2盐碱化土壤,另有0.346亿hm2盐碱荒地[2]。随着人口的剧增及工业的高速发展,我国可耕地面积急剧下降,同时,不合理灌溉又造成了大量良田的次生盐渍化。因此,开发和利用大面积盐渍化土地,利用耐盐植物资源发展盐渍地生态农业十分必要。
耐盐薄荷是山东省科学院中日友好生物技术研究中心经耐盐性试验筛选出的,系椒样薄荷的一种,耐受NaCl胁迫浓度为0.8%。耐盐薄荷除具有薄荷的一般功效外,还因具有耐盐碱性而作为药赏两用植物逐渐被关注。耐盐薄荷是水薄荷与绿薄荷杂交而成的一个不育性中间类型,以分株繁殖为主。但长期采用无性繁殖,易发生病害,引起品种退化和产量、质量下降[3,4]。研究证明,成熟完善的植物组织培养技术是解决品种退化和更新的有效手段之一[5,6]。因此,本研究以耐盐的椒样薄荷茎段为外植体,对其离体培养及植株再生条件进行了研究,以期为耐盐薄荷的品种改良和快速繁殖提供理论依据。
1 材料与方法
1.1 试验材料
供试薄荷外植体取自山东省科学院生物中心中澳盐生植物实验基地。
1.2 试验方法
①外植体灭菌 从苗圃中取生长旺盛的薄荷植株,去叶留茎和芽点,流水冲洗20 min后,用滤纸吸干水分,在超净工作台上用75%酒精消毒1 min、0.1%HgCl2溶液消毒8~10 min后,用无菌水冲洗4~5遍,吸干水后用手术剪对外植体进行修剪,截取长度2~3 cm的茎段,并将其接种在1/2 MS培养基中,置于光照培养箱中培养。3 d后挑取无污染茎段转接至愈伤诱导培养基中。
③不定芽增殖培养基的筛选 取3 cm长的健壮无菌苗,接种到不同浓度6-BA和NAA配比的2/3 MS培养基中,并添加30 g/L蔗糖和4 g/L琼脂进行不定芽诱导。培养50 d(期间转接1次)后,调查增殖系数。不定芽增殖系数(%)=不定芽总数/接种的茎段数×100%。

表1 愈伤诱导培养基正交试验因素和水平设计
④生根培养基的筛选取3 cm长的健壮无根苗,接种到不同浓度6-BA和NAA配比的1/2 MS培养基中,并添加30 g/L蔗糖和4 g/L琼脂进行生根诱导。培养2周后,统计植株生长量(株高)、生根数量(根数)及根生长量(根长),3周后进行比较分析。
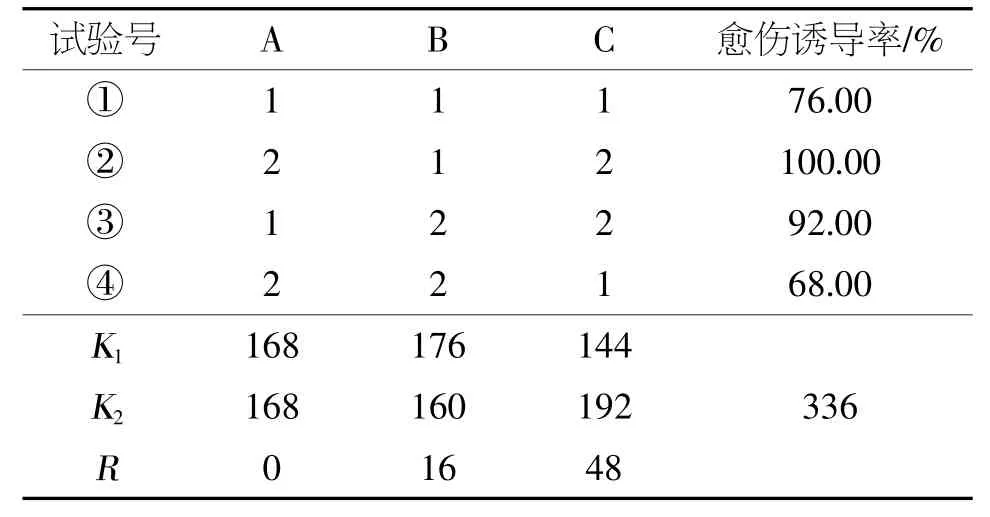
表2 正交试验结果
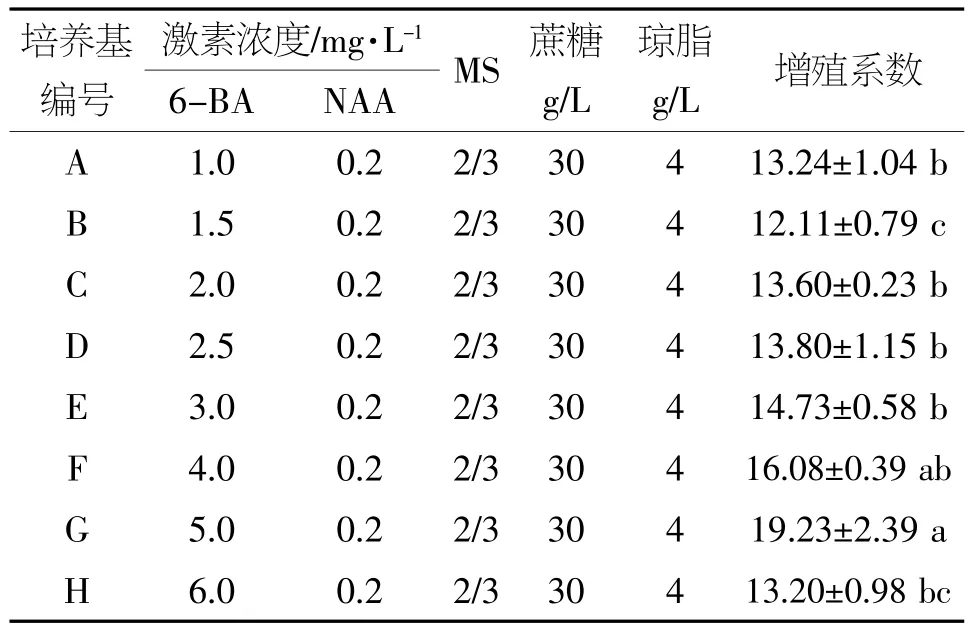
表3 不同培养基的增殖效果
⑤培养条件以上每个处理各接种5瓶,每瓶5株,重复5次。培养基pH值均为6.0(灭菌前),光照培养箱温度(24±2)℃,生根光照时间12 h/d(日光灯光照强度2 000 lx),其他光照时间14 h/d。
对所得数据用SPSS 10.0软件包计算方差,对处理间进行0.05水平上的差异显著性分析。
2 结果与分析
2.1 愈伤诱导培养基的筛选
由表2可知,正交优选配方为A(1,2)B1C2,即1/2 MS(2/3 MS)+1.0 mg/L 6-BA+0.2 mg/L NAA+30 g/L蔗糖+4 g/L琼脂。由值可知,NAA(C)是重要因素,6-BA(B)是较重要因素,MS(A)是影响较小因素,即影响因素C>B>A。因此,通过该试验确定NAA是耐盐薄荷诱导愈伤能力的重要因素,其最适浓度为0.2 mg/L,此条件下愈伤诱导率达92%以上。
2.2 不定芽增殖培养基的筛选
由表3可知,在NAA(0.2 mg/L)浓度相同,6-BA浓度小于6.0 mg/L的情况下,不定芽的增殖系数随6-BA浓度的增加而增加(配方B除外)。结果表明,配方G的增殖系数最高,达19.23,且与配方A,B,C,D,E,H间存在显著差异。因此,通过该试验确定耐盐薄荷的增殖培养基为2/3 MS+5.0 mg/L 6-BA+0.2 mg/L NAA+30 g/L蔗糖+4 g/L琼脂,pH值6.0。
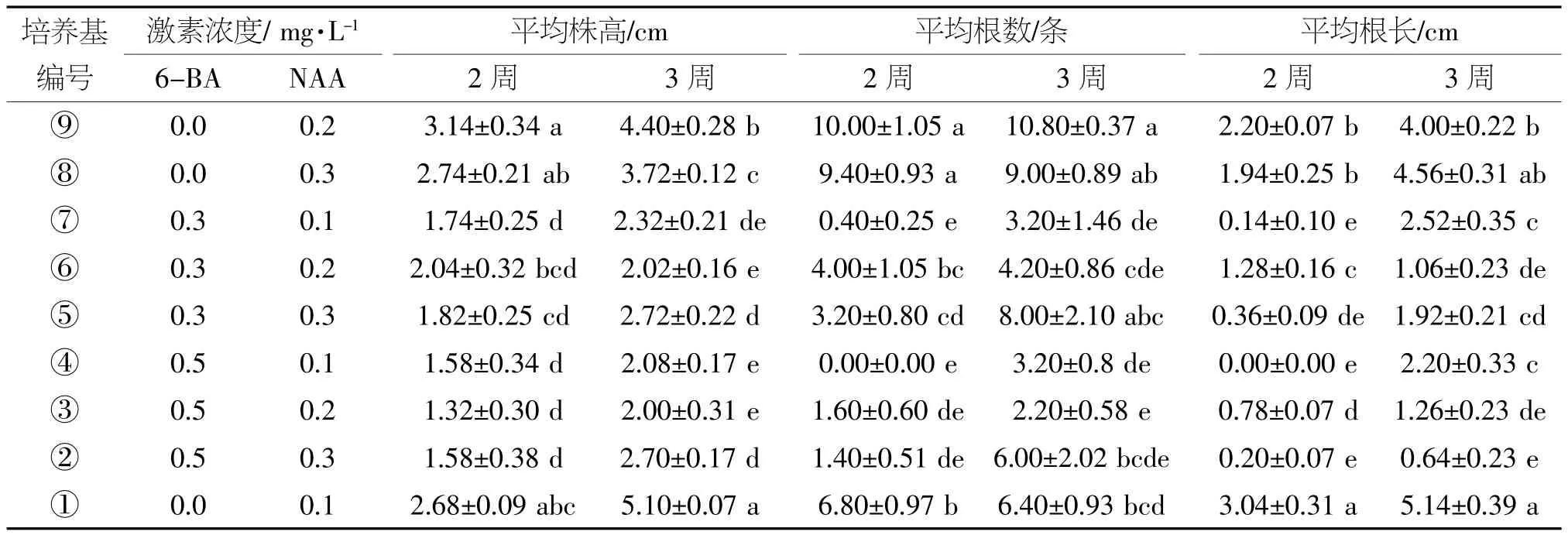
表4 不同培养基的诱根效果
2.3 生根培养基的筛选
由表4可知,耐盐薄荷在不同浓度6-BA和NAA配比的培养基中诱根效果不同。综合植株生长量(株高)、生根数量(根数)及根生长量(根长)来看,不添加6-BA更有利于耐盐薄荷生根,如配方①、⑧、⑨与其他配方之间差异显著。当6-BA浓度为0时,诱根效果并不是随NAA浓度的增加而增加,如诱根3周时,植株生长量基本是随NAA浓度的增加而递减的,且①、⑧、⑨号配方间差异显著,生根数量最多的是⑨号配方,根生长量最大的是①号配方。考虑到生根培养基应以生根数量为重要指标,故确定⑨号培养基为最佳配方,即1/2 MS+ 0.2 mg/L NAA+30 g/L蔗糖+4 g/L琼脂,pH值6.0。
3 结论与讨论
影响椒样薄荷组织培养的因素很多,如温度、光照、湿度、外植体种类、培养基成分、植物激素、接种密度等[4,7]。本试验是在外界培养条件不变的情况下,采用耐盐的椒样薄荷茎段为愈伤组织的诱导材料,在MS培养基中添加6-BA和NAA,筛选愈伤诱导培养基、不定芽增殖培养基及生根培养基。结果表明,NAA对愈伤组织的形成影响最大。在不定芽增殖过程中,NAA浓度为0.2 mg/L时,不定芽的增殖系数随6-BA浓度的增加而增大,但6-BA浓度不宜超过5.0 mg/L。因此,本研究确定分化耐盐薄荷不定芽的最佳培养基为2/3 MS+5.0 mg/L 6-BA+ 0.2 mg/L NAA+30 g/L蔗糖+4 g/L琼脂,pH值6.0。
据王小敏等[4]报道,椒样薄荷的组织培养较薄荷对激素浓度的要求低,椒样薄荷只需较低的植物激素即可满足分化增殖和生根的需要,这可能与不同植物内源激素含量不同相关。本试验表明,高浓度6-BA(5.0 mg/L)与低浓度NAA(0.2 mg/L)有利于耐盐椒样薄荷不定芽的增殖,增殖系数达19.23。耐盐椒样薄荷极易生根,只需在1/2 MS培养基的基础上,添加少量的NAA(0.2 mg/L)进行瓶内生根诱导即可,这与李晓东等[8]研究结果相一致。
[1]王小彬.关注水资源利用与气候变化对土壤盐渍化的重叠影响[J].中国土壤与肥料,2009(2):80.
[2]贾利霞,张众.NaCl胁迫对苜蓿种子萌发的影响[J].内蒙古草业,2008,20(1):40-42.
[3]张侠,宋莉璐,任艳,等.椒样薄荷对NaCl胁迫的生理响应[J].安徽农业科学,2009,37(13):5 967-5 969.
[4]王小敏,李维林,梁呈元,等.椒样薄荷的组织培养研究[J].安徽农业科学,2007,35(11):3 159-3 160,3 162.
[5]陈英.植物体细胞无性系变异与育种[M].南京:江苏科学技术出版社,1991:1-10.
[6]王茂斌,马宗新,赵红,等.薄荷品种提纯途径及程序[J].安徽农业科学,2002,28(2):235-236.
[7]钱森和,厉荣玉,王洲,等.薄荷离体培养及植株再生的研究[J].作物杂志,2008(6):41-44.
[8]李晓东,程智慧,文志华,等.唇萼薄荷的组织培养与植株再生[J].西北农林科技大学学报:自然科学版,2007,35(1): 87-90.
Tissue Culture and Plantlet Regeneration of Salt-tolerant Mint

In order to research the rapid propagation technology of salt-tolerant mint,we took the stem segments of salttolerant mint as explants to screen out suitable callus induction medium by using the orthogonal design4(23).The results showed that naphthylacetic acid(NAA)was the important factors affecting the callus induction ability of salt-tolerant mint, and its optimum concentration was 0.2 mg/L with the callus induction rate over 92%.On this basis,we screened out the proliferation medium by increasing the concentration of 6-BA,and the optimum proliferation medium was 2/3 MS+5.0 mg/L 6-BA+0.2 mg/L NAA+30 g/L sucrose+4 g/L gelose,with the pH value of 6.0(prior to sterilization),and the multiplication coefficient was 19.23.Taking plant growth(height),root number(root number)and root growth(root length)into account, the best rooting culture medium was 1/2 MS+0.2 mg/L NAA+30 g/L sucrose+4 g/L gelose,with the pH value of 6.0.
culture;Induction;Proliferation;Plantlet regeneration
10.3865/j.issn.1001-3547.2013.04.004
国际科技合作项目(2007DFA30630),国际科技合作项目(2011DFA30990)
王贻莲(1978-),女,硕士,助理研究员,从事应用生物的研究,电话:13573791095,E-mail:yilianwang@163.com
杨合同,通信作者,电话:13953109086,E-mail:yanght@keylab.net
2012-12-05
