甲霜灵在人参和土壤中的残留动态1)
2013-03-05王春伟许允成
王春伟 许允成 高 洁 王 燕
(吉林农业大学,长春,130118)
甲霜灵即N-(2-甲氧基乙酰基)-N-(2,6-二甲苯基)-D,L-丙氨,属酰胺类杀菌剂,高效低毒、残效期长,具有很强的保护和治疗作用[1],属于特异性位点抑制剂[2],作用机制是通过抑制卵菌纲真菌的蛋白质合成而起作用。甲霜灵能透过种皮,随着种子的萌发和生长,可内吸传导到植株的根茎叶,并随植物体内水分运转而转移到植物的各器官,可以做茎叶处理、种子处理和土壤处理。可有效防治霜霉病菌、疫霉病菌和腐病菌引起的多种作物霜霉病,瓜果蔬菜类的疫霉病、谷子白发病、烟草黑胫病、大豆根腐病、花生根腐病、棉花猝倒病、水稻烂秧病和向日葵霜霉病[3]。最近几年甲霜灵作为防治苗期根部病害和疫病的药剂在人参上得到了广泛应用[4]。
目前,国外对中药材中农药残留日益重视,并制定了严格的农药残留限量标准,农残问题已成为我国人参出口的主要障碍[5]。甲霜灵的检测方法主要有气相色谱法[6]、高效液相色谱法[7-8]、气质联用[9-11]、液质联用[12]等,其在水果、蔬菜上的残留检测方法和残留限量有报道[8-11],但在人参上的残留检测方法和残留限量未见报道。液相色谱—串联质谱法(LC-MS/MS)是以质谱仪为检测手段,集高效液相色谱(HPLC)高分离能力与质谱(MS)高灵敏度和高选择性于一体的分离分析方法,具有灵敏度高、广谱性强、抗干扰好等优点。为此,本试验采用液相色谱质谱联用技术研究了甲霜灵在人参和土壤中的检测方法并制定了最大残留限量。
1 材料与方法
1.1 仪器与试剂
Agilent1110 高效液相色谱仪(ChemStantion 工作站,美国安捷伦公司),色谱柱为Kromasil Eternity-5-C18,2.1 mm×150 mm;API 4000 液相色谱—质谱/质谱联用仪(美国Applied Biosystems 公司);组织捣碎机(20 000 r/min);T18 ULTRA-TURRAX 匀浆机(德国IKA 公司);旋转蒸发仪SA31(瑞士Büchi 公司);Mettler PL1500-s 电子天平(0.01 g);彩色单道移液枪(1、5、10 mL)(德国Eppendorf 有限公司);固相萃取柱:迪马公司ProElut GPR 固相萃取柱(1.5 g,12 mL);涡漩混匀器;离心机:10 000 r/min;医用注射器,0.22 μm 滤膜等。
甲苯为色谱纯;丙酮、乙腈、甲酸均为优级纯(GR);水为GB/T 6682 规定的一级水;甲霜灵标准品纯度为98.0%,由国家标准物质信息中心提供;35%甲霜灵拌种剂由浙江禾本农药化学有限公司生产。
1.2 方法
1.2.1 消解动态试验
人参上的消解动态试验为土壤拌土处理,一次施药,多次采样。施药剂量为5 250 g/hm2(推荐剂量的1.5 倍),小区面积为15 m2,3 次重复。分别在施药后的采样间隔为0(在施药后药液基本风干的2 h 之内)、7、14、21、28、35 d 采样。土壤采样每小区按对角线取5 点,深度为0 ~10 cm,四分法留样2.0 kg;人参五点法取样,样品为1.0 kg。同期采集空白样品,标签标记后于-20 ℃条件下保存待测[13]。
1.2.2 最终残留试验
设2 个处理分别为3 500 g/hm2和5 250 g/hm2,设空白小区,每处理设3 次重复。在施药后的14、21、35 d 和人参收获期采集人参样品,同期采集空白样品,采样方法同1.2.1。-20 ℃条件下保存待测。
1.2.3 样品前处理方法
提取方法:称取-20 ℃冷冻保存的鲜人参、土壤样品各100 g,依次用捣碎机将样品粉碎;取1 g 样品于50 mL 离心管中,加入丙酮20 mL,用涡漩混匀器混合1 min 后以8 000 r/min 离心5 min;取上清液,再向离心管中加入20 mL 丙酮,重复提取1 次;合并上清液于35 ℃下旋转蒸发至近干,加入5 mLV(乙腈)∶V(甲苯)=3 ∶1 乙腈—甲苯溶解,待净化。
固相萃取净化(SPE):10 mL V(乙腈)∶V(甲苯)= 3 ∶1 预淋洗GPR 固相萃取柱,流出液弃去。将5 mL 溶解液倾入GPR 固相萃取柱中,用20 mL V(乙腈)∶V(甲苯)=3 ∶1 进行洗脱。收集全部洗脱液于鸡心瓶中,于35 ℃水浴中旋转浓缩至近干。用乙腈溶解,并定容至1 mL,经0.22 μm 滤膜过滤后供LC-MS/MS 测定。
1.2.4 检测方法
色谱柱柱温度:40 ℃;流动相为V(甲酸水)∶V(乙腈)= 1 ∶9,其中甲酸水为V(甲酸)∶V(水)=1 ∶999;流速250 μL/min;离子源温度为725 ℃;进样量10 μL;正离子扫描,多反应监测(MRM);电离方式为电喷雾(ESI),电喷雾电压5 500 V,雾化气压力为0.483 MPa;气帘气压力为0.138 MPa,辅助加热气压力为0.379 MPa。甲霜灵的质谱检测条件见表1。

表1 甲霜灵的ESI-MS 的质谱检测条件
1.2.5 定性测定
利用串联质谱作为检测器进行定性分析,在上述条件下,甲霜灵的出峰时间为4.13 min。甲霜灵标准品(质量浓度为0.01 μg/g)的液相色谱串联质谱多反应监测(MRM)色谱图见图1。
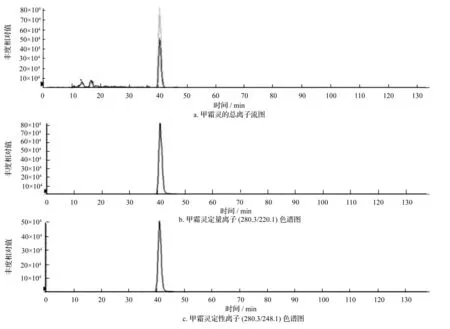
图1 甲霜灵液相色谱—串联质谱多反应监测(MRM)色谱图
在扣除背景后的样品谱图中,各定性离子的相对丰度与质量浓度接近,且与同样条件下的标准溶液谱图相比,最大允许相对偏差不超过表2中的规定范围。
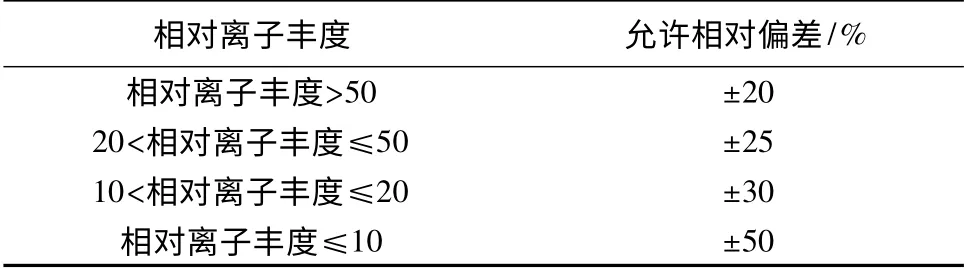
表2 定性确证时相对离子丰度的最大允许相对偏差
1.2.6 标准曲线的建立
分别准确称取甲霜灵标准品10 mg(精确至0.1 mg),置于100.0 mL 容量瓶中,用丙酮溶解,并定容至刻度配制成质量浓度100 mg/L 的标准储备液,用移液管准确移取标准贮备溶液,根据需要用空白基质液定容配制0.01、0.02、0.05、0.1、0.5 mg/L 5 个系列标准溶液。以质量浓度为横坐标,以峰面积为纵坐标建立标准曲线。
1.2.7 方法的准确度、精密度试验
准确称取空白对照区的1 g 土壤、1 g 人参空白试样,分别添加适量甲霜灵标准溶液,使添加质量分数分别为0.01、0.02、0.2 μg/g,按1.2.3 所述方法进行测定,每个添加试验设定10 个平行和1 个对照,计算添加回收率、变异系数和相对标准偏差。
1.2.8 方法的稳定性试验
准确称取不同基质的空白样品各1.0 g,分别添加适量甲霜灵标准溶液,使其质量分数为0.02 μg/g,5 h 后按1.2.3 所述方法进行测定,每个添加试验设定10 个平行和1 个对照,计算添加回收率、变异系数和相对标准偏差。
2 结果与分析
2.1 标准曲线
甲霜灵在0.01 ~0.5 mg/L 质量浓度范围内,其质量浓度与响应值有良好的线性关系,标准曲线见图2,线性方程为Y=30 300X+247 000,相关系数为0.999 3。

图2 甲霜灵的标准曲线
2.2 方法的准确度、精密度、最低检出限
方法的准确度用添加回收率来表示,精密度用相对标准偏差来表示。
对10 个近似空白的样本进行测定,得出响应值标准差,按最小检出限为空白值3 倍标准差计算,将峰面积换算成被测物质量分数,甲霜灵的最小检出限为0.01 μg/g。
取空白人参和土壤试样1.0 g,分别添加0.01、0.02、0.20 μg/g 3 个水平,甲霜灵在人参和土壤中的平均添加回收率分别为88.70% ~90.40%,86.56 ~92.70%,变异系数分别为6.60% ~8.51%,4.80% ~6.24%,符合残留试验要求,结果见表3。

表3 甲霜灵在人参及土壤中的添加回收率
2.3 方法的稳定性
当添加0.02 μg/g,5 h 后测定,甲霜灵在人参和土壤中的平均添加回收率分别为86.50%,83.50%,变异系数分别为6.70%,8.95%,见表3。通过对比2.2 试验结果,回收率、变异系数和相对标准偏差变化很小,表明本方法具有很好的稳定性。
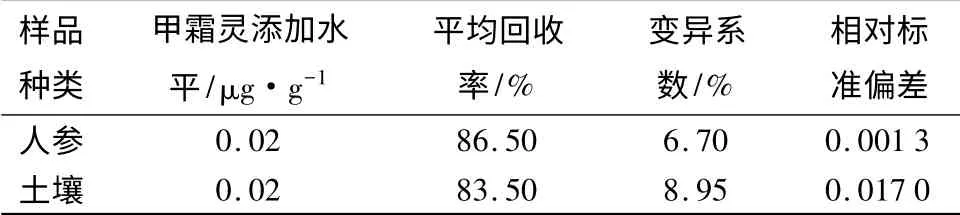
表3 甲霜灵在人参及土壤中的添加回收率
2.4 消解动态试验
通过2011年在吉林省抚松县的田间试验研究了甲霜灵在人参和土壤中的降解动态。从表4可知:甲霜灵在人参根和土壤中降解动态符合一级反应动力学方程Ct=C0e-Kt。其中:Ct为施药后间隔时间t 时农药质量分数;C0为施药后的原始沉积量;K为降解速率常数;t 为施药后的时间。由此可求出降解半衰期t1/2=ln2·K-1。试验结果经对数转换与回归分析,在5 250 g/hm2处理剂量下,甲霜灵在人参根和土壤中半衰期分别为15.04、6.67 d,属于易降解农药(t1/2<30 d)。
2.5 最终残留试验
试验结果表明:施用35%甲霜灵拌种剂,3 500 g/hm2剂量下人参和土壤中的残留量分别为0.009、0.004 8 μg/g;5 250 g/hm2剂量下人参和土壤中的残留量分别为0.017、0.010 4 μg/g,见表5。

表4 甲霜灵在人参根和土壤中的消解动态

表5 甲霜灵在人参和土壤中的最终残留
3 结束语
建立了液相色谱—串联质谱法检测甲霜灵在人参及土壤中的残留方法。研究结果表明,甲霜灵在人参和土壤中的平均添加回收率分别为88.70% ~90.40%和86.56 ~92.70%,变异系数分别为6.60% ~8.51%和4.80% ~6.24%。该方法测定人参及土壤中的甲霜灵残留,操作简单,定性、定量准确,精密度高,重现性好,检出限低,能满足生产上对甲霜灵检测限量的要求。
试验结果表明:按5 250 g/hm2剂量施药,甲霜灵在人参和土壤中的降解半衰期分别为15.04 d 和6.67 d,甲霜灵在土壤中的消解率明显快于人参,可能是因为土壤中微生物降解的作用。我国尚未制定甲霜灵在人参中最大残留限量标准,而韩国规定甲霜灵在红人参中最大残留限量为2 μg/g,在干人参中最大残留限量为0.5 μg/g,日本制订的人参残留限量标准为0.05 μg/g,欧盟制订的人参残留限量标准0.1 μg/g[14]。因此,参照以上残留限量规定及田间试验残留动态数据,35%甲霜灵拌种剂在施药剂量为3 500 ~5 250 g/hm2时,施药1 次,建议人参根中最大残留限量值为0.05 μg/g,人参的安全间隔期为14 d。
[1] 马志强,张小风,韩秀英,等.黄瓜霜霉病菌对甲霜灵的抗药性治理[J].植物保护学报,2005,32(2):223.
[2] 张鑫,赵晓军,周建波.太原市郊区黄瓜霜霉病菌对甲霜灵的抗药性检测[J].植物保护,2008,34(5):152-154.
[3] 崔丽丽.人参5 种农药多残留检测方法及嘧菌环胺在人参和土壤中的残留研究[D].长春:吉林农业大学,2011.
[4] 冯家.人参常见病虫害诊断与安全用药[M]. 长春:吉林出版集团,2010.
[5] 许允成,王春伟,高洁.乙撑硫脲在人参和土壤中残留分析与消解动态[J].东北林业大学学报,2012,40(4):117-119.
[6] 靳万贵.25%甲霜灵可湿性粉剂的气相色谱分析[J]. 农药,1998,37(1):24-25.
[7] 何书海,李腾崖,陈菲,等.高效液相色谱法对环境样品中甲基托布津与甲霜灵残留的测定[J].分析测试学报,2010,29(2):161-164.
[8] 殷春杭,朱国念,钱允辉,等.蔬菜中甲霜灵残留量的HPLC 分析[J].农药,2006,45(10):686-688.
[9] 王华.加速溶剂萃取结合GC-MS 法测定葡萄酒中甲霜灵的残留[D].杨凌:西北农林科技大学,2000.
[10] 李锋格,全晓盾,窦辉,等. 气相色谱—质谱法测定番茄酱中甲霜灵、苯霜灵、恶霜灵的残留量[J]. 中国卫生检验杂志,2007,17(3):388-389.
[11] 陈红平,刘新,汪庆华,等.气相色谱—串联质谱检测水果、蔬菜中抗蚜威、甲霜灵和克螨特残留量[J].质谱学报,2010,31(4):220-223.
[12] 徐娟,陈捷,林峰.液相色谱—串联质谱法测定八种食品中甲霜灵[J].食品科学,2010,31(4):175-178.
[13] 刘光学.NY/T 788—2004 农药残留试验准则[S].北京:中国农业出版社,2004.
[14] 章强华,董国堃,姚晗珺.人参常用农药国外残留量标准的分析及对策[J].人参研究,2009(1):2-10.
