西府海棠组织培养体系的建立与优化1)
2013-03-05李厚华付婉艺付林江刘媛媛
阙 怡 李厚华 付婉艺 梁 峥 付林江 刘媛媛
(西北农林科技大学,杨凌,712100) (大港油田园林绿化管理公司)
西府海棠为蔷薇科苹果属植物,落叶小乔木,树形峭立;叶长椭圆形,表面有光泽;花在蕾期为红色,开放后呈淡粉红,花径约4 cm;小果熟时泛红,萼洼梗洼均下陷。西府海棠春天开花时红粉相间,秋季小果缀满枝头,观赏价值极高,在我国已有悠久的栽培历史。并且该种耐旱、抗寒,在我国北方园林中常见栽培。明代王象晋在《群芳谱》中记载了“海棠四品”,西府海棠就是其中之一。
西府海棠是观赏海棠育种的优良亲本。为突破传统杂交育种的局限,近年来,越来越多的科学工作者展开了观赏海棠的分子育种。转基因育种相对传统杂交育种具有育种周期短、能突破种间生殖隔离等优点[1]。已有的研究表明,苹果属植物转基因育种多用农杆菌侵染叶盘法[2]。因此建立西府海棠的高效组培快繁体系和离体再生体系是顺利进行观赏海棠分子育种的基础。
目前,海棠的组培研究已取得一定的进展。2007年,张庆田等[3]对垂丝海棠组培再生体系进行了研究,并通过调节激素6 -BA 和NAA 的配比成功诱导叶盘再生不定芽。2009年,戴全胜等[4]对颐和园古西府海棠进行了组培快繁研究,优化了扩繁培养基,使其最高增殖倍数达到4.16,但未进行叶盘愈伤组织诱导和再生的研究。相比之下,苹果的组培快繁和离体再生体系研究得比较深入[5],很多研究表明,以山梨醇作为碳源,适当的暗培养有利于苹果属植物叶盘的愈伤组织诱导[6-7]。
本试验在前人研究的基础上,建立了系统、高效的西府海棠组培快繁体系,探索了离体叶盘再生体系,为进一步开展海棠的遗传转化、品种改良的研究奠定了基础。
1 材料与方法
外植体消毒:本研究选用种子作为外植体。2010年9月份,于西北农林科技大学海棠园内采取5年生以上西府海棠树上成熟健康的果实,清水洗净后置于加3 ~5 滴Tween20 的水中浸泡30 min,然后流水冲洗1 ~2 h。在超净工作台上用75%酒精摇晃消毒30 s,无菌水清洗2 次;然后用5% NaClO浸泡8 min,无菌水冲洗3 次。
初代及继代培养:在无菌操作环境下切开消毒好的果实,选取饱满的种子接种到MS 培养基上,放置于25 ℃、室内自然光照下培养,约1 个月后种子萌发长出无菌小苗。当苗长到2 ~3 cm 高时将其转接到本实验室所用的MS 培养基+1 mg·L-16 -BA+0.1 mg·L-1IBA 中进行初步继代培养,以获得更多数量的组培苗。
扩繁培养基的优化:采用2 因素3 水平的完全随机试验方法,研究不同激素质量浓度配比对组培苗增殖倍数的影响。以MS+30 g·L-1蔗糖+7 g·L-1琼脂为基础培养基;细胞分裂素选用6 -BA,设置0.5、1. 0、1. 5 mg·L-13 个水平;生长素选用IBA,设置0.05、0.10、0.20 mg·L-13 个水平。共设置9 种组合,每种组合接种15 个组培苗,重复2 次。30 d 后统计增殖与植株生长情况。增殖倍数=株高1 cm 以上的扩增组培苗数/原接种的组培苗数。株高用坐标纸粗略测量。健康指数分为3 个等级:1级,表现为扩增组培苗玻璃化、植株水渍状或植株叶片枯黄死亡;2 级,表现为组培苗无玻璃化,但茎干细弱,叶片过小或过大老化,可用于扩繁但不能取叶再生;3 级,表现为扩增组培苗生长健壮,叶片大小适中,叶片鲜绿。
叶片愈伤组织诱导及不定芽分化:选择继代培养30 d 后长出的健壮组培苗,取其顶部的幼嫩叶片,垂直于主叶脉横切成约0.5 cm2的叶盘,置于含不同质量浓度6 -BA 和NAA 的MS 培养基上培养。以30 g·L-1山梨醇作糖源,琼脂7 g·L-1,6 -BA设置1、2、4、6 mg·L-14 个水平,NAA 设0.1、0.5、1.0 mg·L-13 个水平,共12 种组合。25 ℃暗培养2周诱导出愈伤组织后转入光照下培养进行不定芽分化(光照强度1 500 ~2 000 lx,光周期为16 h 光/8 h暗)。每两周更换1 次培养基。每种组合10 片叶,重复3 次,14 d 后统计愈伤量,60 d 后统计不定芽分化情况。愈伤量分4 个等级,0 代表无愈伤组织;1代表仅在主叶脉的切口处有极少量愈伤组织;2 代表仅在一端切口处诱导出大量愈伤组织,另一端愈伤量较少或无;3 代表两端切口处均长满致密的愈伤组织[8]。
生根与移栽:以继代培养30 ~35 d 后长出的2 cm 以上的健壮组培苗为材料进行生根诱导试验,研究激素质量浓度、光照强度及基础培养基对生根率的影响。选择IBA 为生根诱导激素,设0.1、0.2、0.3 mg·L-13 个水平;光照强度分为正常组培光照(2 000 lx)和弱光(室内自然光);再在此试验基础上进行基础培养基的选择,设MS、1/2MS 和1/4MS 3个水平。每种处理9 个苗,重复3 次。40 d 后统计生根率及根生长情况。生根率= (生根的组培苗数/接种组培苗数)×100%。将生根苗进行炼苗移栽:洗净根部残留培养基,植于V(细沙)∶ V(腐殖质)∶ V(蛭石)=5∶ 8∶ 2 的基质中,加盖透光塑料杯,第一周每天喷3 ~5 次水,以后逐渐减少喷水量,2 周后去杯并移栽到大盆中。
数据分析方法:采用SPSS 18.0 统计软件对以上数据进行方差分析和多重比较分析。
2 结果与分析
2.1 不同质量浓度6 -BA 及IBA 组合对西府海棠组培苗增殖的影响
幼嫩组培苗接入新的培养基约1 周其底部切口处开始长出愈伤组织,2 周后开始分化出丛生芽。培养30 d 后的结果表明,丛生芽数量随着6 -BA 质量浓度的增加呈增多趋势,但随着6 -BA 质量浓度的增加,丛生芽长势变弱,玻璃化现象越来越严重,因此,在苗高大于1 cm 标准下的增殖倍数反而随6-BA 质量浓度增加呈递减趋势(表1)。在MS +0.5 mg·L-16 -BA+0.2 mg·L-1IBA 培养基中,西府海棠组培苗的增殖倍数为6.30,健康指数为3,为最适增殖培养基。
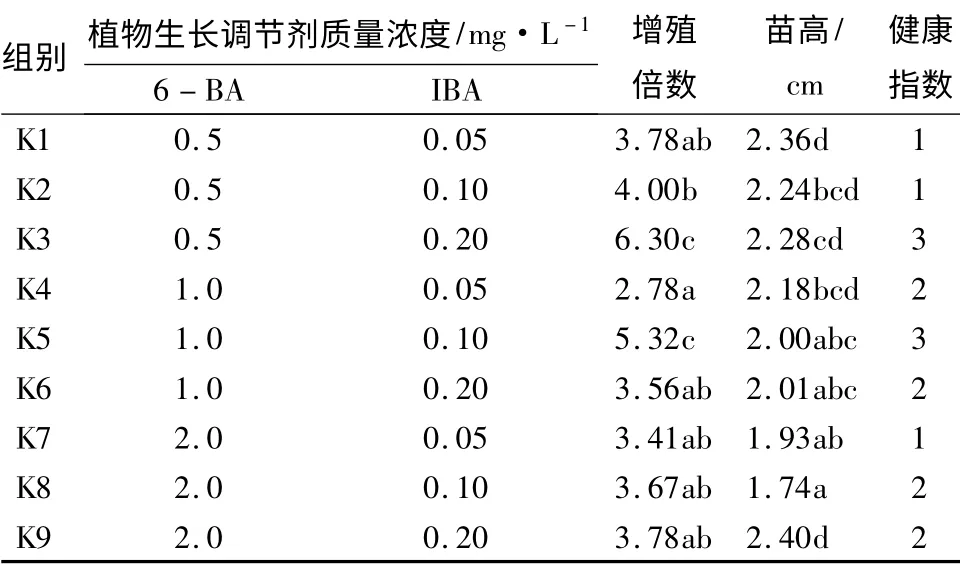
表1 不同激素质量浓度配比对西府海棠组培苗扩增及生长的影响
2.2 不同质量浓度6 -BA 和NAA 组合对西府海棠离体叶盘不定芽再生的影响
2 周暗培养结束后,所有的叶盘都能诱导出乳黄色的愈伤组织,但不同的激素配比诱导出的愈伤量差异显著(表2,图1D-F)。随NAA 质量浓度的升高,愈伤量显著增加。当6 -BA 质量浓度达到4 mg·L-1时,愈伤组织可以分化芽,但数量不多。总体而言,C8 组合诱导出的愈伤组织分化能力更强。
2.3 不同培养基及培养环境对西府海棠组培苗生根的影响
2.3.1 不同IBA 质量浓度对西府海棠组培苗生根的影响
IBA 质量浓度对组培苗生根诱导的试验结果表明,在1/2MS 培养基中,相同的光照条件下,生根率、每苗平均根数随IBA 质量浓度的升高呈递增的趋势(表3)。当IBA 质量浓度为0.3 mg·L-1时,植株生长健壮,叶色浓绿,生根率和每苗平均根数也最高,为试验组合中的最适激素质量浓度。
2.3.2 不同光照条件对西府海棠组培苗生根的影响
光照条件对组培苗生根影响的试验结果表明,在相同的激素质量浓度下,组培苗在弱光下诱导生根比在正常光照下诱导的生根率高(表3),并且弱光环境下出根时间比正常光照下短,平均5 d 就开始有生根现象,而正常光照下需1 周以上才能观察到生根。综上考虑,宜在弱光下进行生根诱导。
2.3.3 不同基础培养基对西府海棠组培苗生根影响
在IBA 质量浓度0.3 mg·L-1、弱光环境诱导的条件下,随着大量元素的减少,其生根率显著升高,但当使用1/4MS 培养基时,其生根率虽最高,但须根极少,且长势细弱。因此,仍选用1/2MS 作为最适基础培养基。
综上所述,西府海棠最适生根条件为在1/2MS+0.3 mg·L-1IBA 培养基中于弱光下诱导。
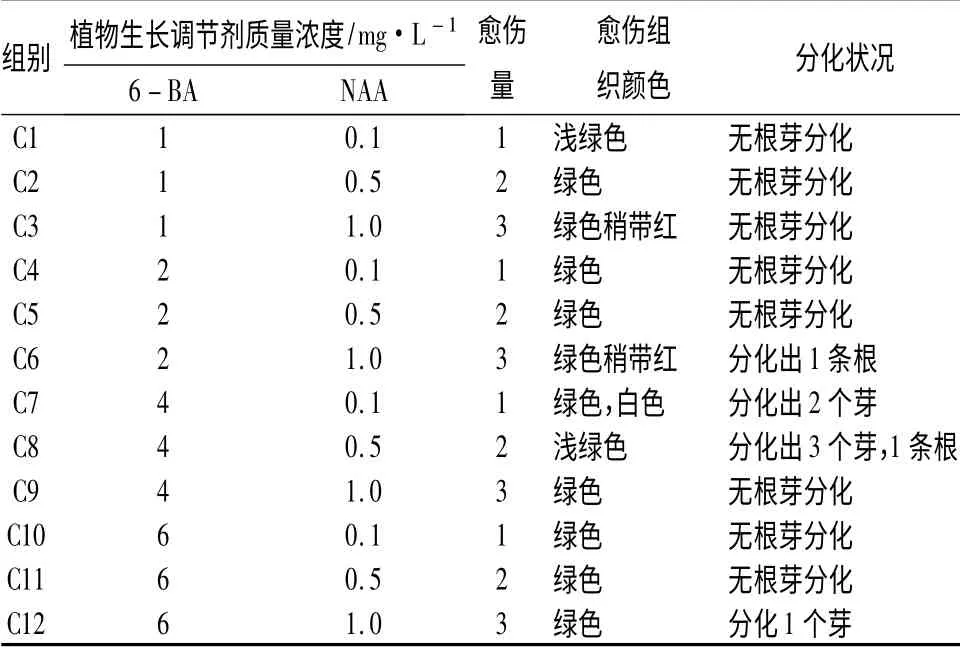
表2 不同激素质量浓度配比对西府海棠离体叶盘再生的影响

图1 西府海棠组织培养
3 结论与讨论
木本植物外植体的建立多选用带腋芽茎段,但常表现出高污染率和不同程度的褐化问题。本研究初期曾选择当年生带腋芽茎段为外植体进行消毒处理,但污染率太高(95%以上),可能是因为鳞片上有毛状附属物,不利于消毒。改用果实为外植体后,其污染率降至0。从果实中取种子比直接用种子进行消毒的好处在于,果实表面光滑,并且消毒液没有直接接触种子,起到保护作用。
不同质量浓度激素组合对西府海棠组培苗增殖的影响的试验结果表明,丛生芽数量随着6 -BA 质量浓度的增加呈增多趋势,当6 -BA 质量浓度增加到2 mg·L-1时,单株丛生芽数量最多能达10 以上,但大多数丛生芽有玻璃化、矮化现象,不能继续用于增殖。丛生芽玻璃化的发生可能是由高质量浓度的细胞分裂素所导致的[9-10];而丛生芽矮小不伸长可能是由于增殖苗数太多,营养物质和生长素供应不足而导致。因此,本研究统计了大于1 cm 的扩增苗数及组培苗的健康指数,以利于选择最适培养基。
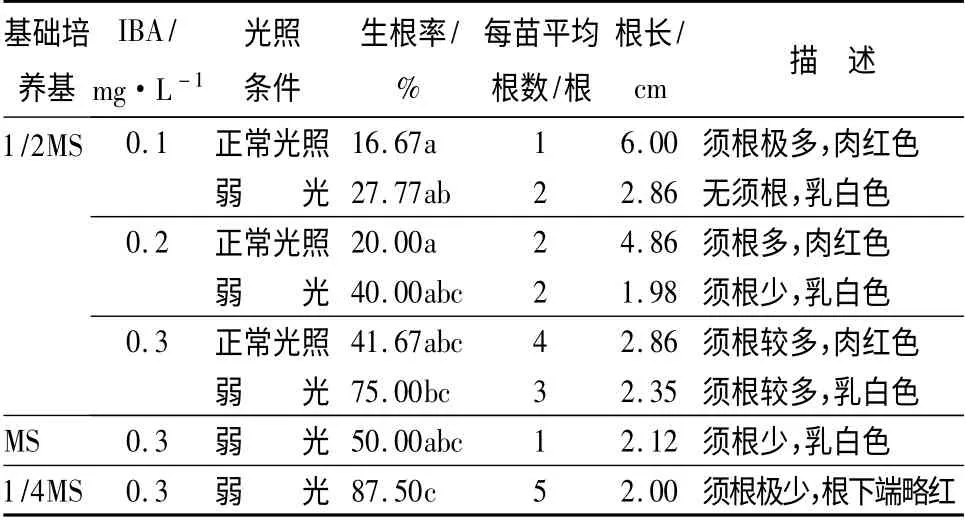
表3 不同培养基及光照条件对西府海棠组培苗生根的影响
西府海棠离体叶盘经14 d 暗培养后,很容易诱导出愈伤组织,但从愈伤组织分化不定芽却较困难,这与Jin et al.[11]的研究相似。适当增加生长素质量浓度,其愈伤组织有向根分化的趋势,用0.3 mg·L-16 -BA+2.0 mg·L-1IBA 的激素配比培养叶盘,45 d 后分化出大量丛生根(图1G)。当6 -BA 质量浓度增加到4 mg·L-1时有芽分化,虽然数量极少,但是可在此基础上进行西府海棠离体叶盘再生培养基的进一步优化。
生根培养结果表明,弱光环境有利于生根,且生根时间短。这可能是因为弱光环境利于愈伤组织向根的分化[12]。但弱光限制了光合作用,不利于地上部分的生长。因此,在弱光下成功诱导生根后,应将组培苗立即置于正常光照下培养[13]。在生根试验中随着基础培养基中大量元素的减少生根率反而呈升高的趋势,这可能是因为随着培养基中大量元素的减少,NH4NO3质量浓度逐渐降低,对植物生根的抑制作用减弱,从而导致了生根率的提高[14]。
[1] 陈赛华,江玲.转基因新品种产业化势在必行[J]. 种业导报,2012(3):35 -36.
[2] 周瑞金,杜国强,师校欣. 苹果转基因研究进展[J].农业科学与技术:英文版,2009,10(4):43 -46.
[3] 张庆田,夏阳,孙仲序,等.垂丝海棠组培再生体系建立的研究[J].生物技术,2007,17(3):73 -75.
[4] 戴全胜,王雅群,车晓航,等.颐和园古西府海棠的组织培养与快速繁殖[J].林业科技开发,2010,24(2):76 -78.
[5] 梁美霞,戴洪义.苹果组培苗离体叶片诱导不定芽分化[J].湖南农业大学学报:自然科学版,2009,35(5):470 -473.
[6] 师校欣,杜国强,高仪,等.黑暗培养对苹果组培快繁及叶片再生的影响[J].河北农业大学学报,2004,27(4):18 -21.
[7] 马锋旺,王飞.山梨醇作碳源对苹果微体繁殖的效应[J].西北农业大学学报,1996,24(4):102 -104.
[8] 谭黎霞,田强强,王敦,等.海棠花离体繁殖技术研究[J].西北林学院学报,2012,27(2):93 -97.
[9] 李胜,李唯,杨德龙,等.植物试管苗玻璃化现象研究进展[J].甘肃农业大学学报,2003,38(1):1 -15.
[10] Kataeva N V,Alexandrova I G,Butenko R G,et al. Effect of applied and internal hormones on vitrification and apical necrosis of different plants cultured in vitro[J]. Plant Cell,Tissue and Organ Culture,1991,27(2):149 -154.
[11] Jin Kaina,Zhang Jie,Liu Junli,et al. Establishment of high effective regeneration and propagation system of ornamental crabapple (Malus spp.)[J]. African Journal of Biotechnology,2011,10(34):6447 -6455.
[12] 王岳英.树莓组织培养生根炼苗技术[J]. 东北林业大学学报,2010,38(6):121 -123.
[13] Eliasson L,Brunes L. Light effects on root formation in aspen and willow cuttings[J]. Physiologia Piantarum,1980,48(2):261 -265.
[14] Druart P. Optimization of culture media for in vitro rooting of Malus domestica Borkh. cv. Compact Spartan[J]. Biologia Plantarum,1997,39(1):67 -77.
