阴香果实主要生物活性成分的提取工艺
2013-03-04朱明睿刁树平
张 镜,朱明睿,刁树平
(嘉应学院生命科学学院,广东 梅州 514015)
阴香果实主要生物活性成分的提取工艺
张 镜,朱明睿,刁树平
(嘉应学院生命科学学院,广东 梅州 514015)
研究阴香果实花色苷、原花青素及果胶的提取技术,以对其进行综合利用。以水为溶剂、5W/mL超声波处理,经单因素试验及正交试验表明,同时提取阴香果实3种活性成分的最佳条件为pH1、液料比13(mL/g)、50℃浸泡60min、5W/mL超声90s,经2次提取花色苷、原花青素及果胶提取率分别为92.55%、95.65%及96.51%。DM301树脂与提取液以1:40比例混合,花色苷及原花青素的吸附率分别为94.58%和96.63%,解吸率分别为96.47%和94.66%。以体积分数80%的乙醇溶液、1BV/h流速动态洗脱,洗脱峰体积为柱床体积的40%,花色苷和原花青素的洗脱率分别为92.23%与93.11%。结果表明水为溶剂、经超声波处理及树脂分离是同时提取阴香果实3种活性成分的有效方法。
阴香;果实;原花青素;花色苷;果胶;提取工艺
阴香(Cinnamomum burmannii)属樟科、樟属,多年生常绿乔木,长势旺,抗逆性强,在我国主要分布于广东、福建等地,是华南地区的优良行道树种与良好的生态树种。阴香也是多用途的经济林木,树皮、叶、果实可提取药用成分与制造香精、肥皂等的化工原料,也可提取对多种植物病原菌具有抑菌活性的物质[1],阴香材质细腻,是家具、建筑及室内装饰等用的优良木材。阴香树的结果率高、果实产量大,成熟果实果皮紫黑色,富含花色苷、原花青素、果胶、粗脂肪等多种成分[2]。
花色苷不仅因颜色鲜艳、食用安全而广泛用作食品、药品及化妆品的着色剂[3],亦因有很强的自由基清除、抗氧化活性等多种医疗保健功能,为保健品中重要的功能性成分[4]。原花青素是清除自由基、抗氧化活性更强,医疗保健作用更突出的天然活性物质[5-11]。果胶系植物活性多糖,不仅具有医疗保健功能,还可螯合锶、镉等重金属形成惰性化合物随粪便排出体外消除重金属的危害,果胶还可用作医药凝胶剂、食品增稠剂等[12-15]。
阴香果实成分复杂,活性成分的开发利用必须去除油脂,此外果实内果胶的吸水性强,有碍花色苷与原花青素的提取分离。目前,除笔者曾研究过阴香鲜果果肉花色苷的提取工艺外[16],尚未见从阴香干果中同时提取3种主要活性物质的报道。因此研究阴香果实活性成分经济有效的提取技术,对大量废弃阴香果实高价值成分的资源化利用具有积极的作用。
1 材料与方法
1.1 材料与试剂
成熟阴香果实采摘自广东省梅州市,除去病果、伤果,蒸馏水清洗果面尘土,晾干果面余水,冷冻干燥,粉碎,石油醚回流除脂,减压除净石油醚,再次粉碎,80筛目过筛,粉末物料冰箱保存备用。
无水甲醇、无水乙醇、硫酸、苯酚、正丁醇、盐酸、硫酸铁铵均为分析纯;吸附树脂DM301、AB-8、NKA9、DA201、DS401、NKA-Ⅱ、D107 天津树脂厂。
1.2 仪器与设备
YJ92-Ⅱ超声波细胞粉碎仪 宁波市郑州通杰实验仪器有限公司;JLL28-B 低速大容量离心机 上海安亭科学仪器厂;BT2K XL 冻干机 美国VirTis公司;U-2800 紫外-可见分光光度计 日本日立公司。
1.3 方法
1.3.1 提取效果测定
1.3.1.1 花色苷的测定
取适量提取液与无水乙醇按体积比1:5的比例混匀,20min后4℃、9000r/min离心20min,测定上清液于515nm波长处的吸光度,以吸光度为各处理花色苷提取效果的指标。测定不同pH值与花色苷提取效果的关系时,各处理提取液先调pH值为4,再测上清液于515nm波长处的吸光度。
1.3.1.2 原花青素的测定
取适量提取液与无水乙醇按1:5比例混匀,静置20min,4℃、9000r/min离心20min,收集清液冻干,蒸馏水定容得提取液。提取液1mL,加6mL体积比为95:5的正丁醇-盐酸溶液及0.2mL 2%硫酸铁铵混匀,沸水浴40min后水浴至室温,测定其于550nm波长处的吸光度(A2)[17]。取1mL提取液加6.2mL蒸馏水,沸水浴40min后冰水冷却至室温,测定其于550nm波长处的吸光度(A1),各处理以A2与A1的差值作为评价原花青素提取效果的标准。
1.3.1.3 果胶的测定
取适量提取液与无水乙醇按1:5比例混匀,静置20min,4500r/min离心20min,沉淀加1.0mL 5%苯酚溶液及5.0mL浓硫酸,迅速混匀,室温放置30min后测定其于490nm波长处的吸光度[18]。
1.3.2 超声波处理提取阴香果实活性成分
1.3.2.1 液料比对活性成分提取效果的影响
准确称取适量物料,按不同液料比(mL/g)加入蒸馏水,浸泡(同时搅拌)20min后室温放置1h,5W/mL超声波处理90s,4500r/min离心20min,取上清液测定液花色苷、原花青素及果胶的吸光度。
1.3.2.2 超声波处理时间对活性成分提取效果的影响
准确称取适量物料,按液料比13(mL/g)与蒸馏水混匀,浸泡(同时搅拌)20min后室温放置1h,5W/mL超声波处理不同时间,4500r/min离心20min,取上清液测定花色苷、原花青素及果胶的吸光度。
1.3.2.3 pH值对活性成分提取效果的影响
以HCl及NaOH调蒸馏水为不同的pH值,将物料与不同pH值的蒸馏水按液料比13(mL/g)混匀,浸泡(同时搅拌)20min后室温放置1h,超声波处理90s,4500r/min离心20min,取上清液测定花色苷、原花青素及果胶的吸光度。
1.3.2.4 温度对活性成分提取效果的影响
准确称取适量物料,按液料比13(mL/g)与蒸馏水混匀,浸泡(同时搅拌)20min后分别在不同温度下水浴处理1h,5W/mL超声波处理90s,4500r/min离心20min,取上清液测定花色苷、原花青素及果胶的吸光度。
1.3.2.5 浸泡时间对提取效果的影响
准确称取适量物料,按液料比13(mL/g)与蒸馏水混匀,浸泡(同时搅拌)不同时间后室温放置1h,5W/mL超声波处理90s,4500r/min离心20min,取上清液测定花色苷、原花青素及果胶的吸光度。
1.3.2.6 提取参数的正交试验优化
称取适量物料,以液料比、温度、超声波处理时间及溶液pH值进行4因素3水平L9(34)的正交试验,试验先将物料与相应pH值的蒸馏水及液料比混合、相应温度浸泡60min,再以5W/mL超声波处理不同时间,4500r/min离心20min,取上清液测定提取液花色苷、原花青素及果胶的吸光度。
1.3.2.7 提取次数对活性成分提取率的影响
称取适量物料,以13(mL/g)的液料比与pH1的蒸馏水混匀,搅拌20min,50℃水浴1h后5W/mL超声波处理90s,4500r/min离心20min,取上清液测定花色苷、原花青素及果胶的吸光度,提取次数5次,分别测定不同次数提取液吸光度,以5次提取吸光度的总和为100%提取率,各次提取的提取率为其吸光度占总吸光度的百分比。
1.3.3 阴香果实提取液活性成分的分离
1.3.3.1 提取液活性物质的树脂分离
供试大孔吸附树脂与提取液按1:40(m/V)的比例混合,振荡器28℃、150r/min静态吸附12h,分离树脂。提取液吸附前、后测定花色苷、原花青素及果胶吸光度,参考文献资料[2]计算供试树脂对3种物质的吸附率。准确称适量树脂与体积分数为80%的乙醇溶液按1:20(m/V)的比例混合,150r/min静态解吸12h后测定解吸液花色苷、原花青素的吸光度,计算解吸率。
1.3.3.2 树脂吸附成分的动态解吸
将1.3.3.1节分离的树脂以1倍体树脂体积的蒸馏水漂洗2min,取100mL装入层析柱,以80%乙醇溶液、流速1BV/h解吸,以10mL为1流份收集解吸液,分别测定各流份解吸液中花色苷及原花青素的吸光度,对高浓度的洗脱液先稀释,使其吸光度在0.1~1.0之间。
1.3.4 数据统计与分析
各处理重复3次,试验数据平均值以Excel 作图,用SPSS 11.0进行方差分析,相关数据进行Duncans’差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 液料比对活性成分提取效果的影响
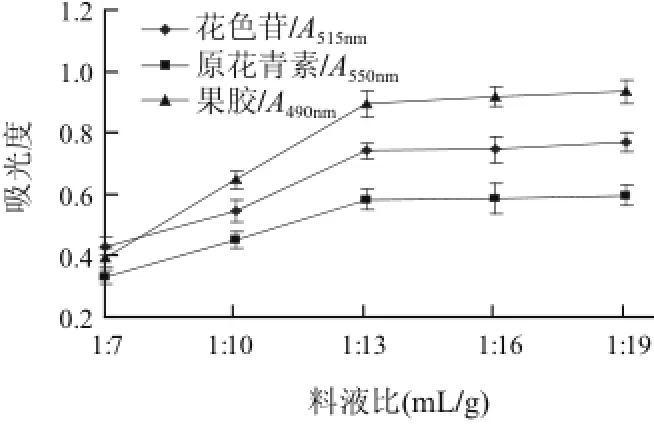
图1 料液比对活性成分提取效果的影响Fig.1 Effect of liquid/solid ratio on the extraction efficiency of active substances
由图1可知,花色苷、原花青素及果胶的提取效果均随液料比的增大相应提高,当液料比为13(mL/g)时提取效果较小于13(mL/g)的差异极显著(P<0.001),液料比大于13(mL/g)后提取液的吸光度间无显著差异(P<0.05),结果表明同时提取阴香果实3种物质的液料比以13(mL/g)为佳。此液料比较多种植物花色苷或原花青素提取的稍高,主要是因阴香果胶吸涨力大,待充分吸水后超声波处理方可充分液化,若加水不足,胶体液化程度较低,则会有碍花色苷与原花青素的溶解,从而影响提取效果。
2.2 超声波处理时间对活性成分提取效果的影响
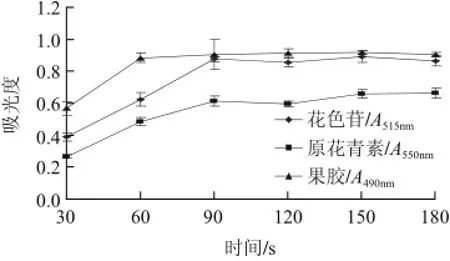
图2 超声波处理时间对活性成分提取效果的影响Fig.2 Effect of ultrasonic time on the extraction efficiency of active substances
由图2可知,超声波处理时间在30~90s范围内提取液花色苷的吸光度随时间延长而增大,处理时间大于90s后提取液的吸光度不再增大。超声波处理时间对原花青素提取效果的影响趋势与花色苷较接近,当处理时间为90s时的吸光度最大,但大于90s的吸光度未明显降低。处理时间为60s时果胶的吸光度最大,再延长超声波处理时间提取效果无明显变化。因此,同时提取阴香果实3种活性成分,超声波处理时间60~90s为佳。
2.3 溶液pH值对活性成分提取效果的影响
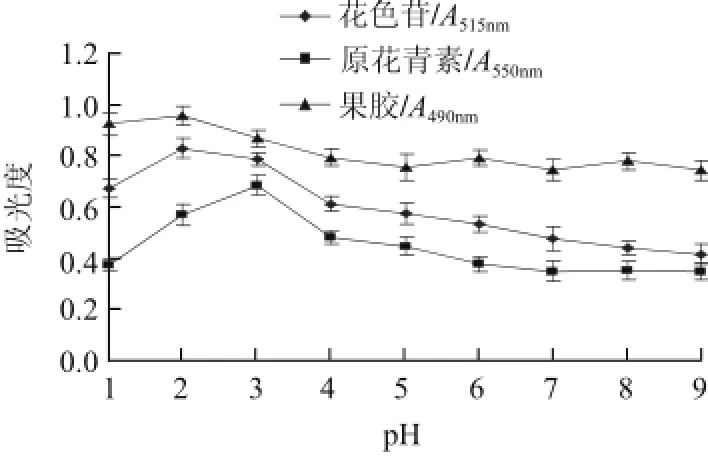
图3 pH值对活性成分提取效果的影响Fig.3 Effect of solvent pH on the extraction efficiency of active substances
由图3可知,溶液pH1~4时花色苷提取效果较好,pH2效果最好,pH>4时,随着pH值的上升花色苷提取效果逐渐降低,文献报道花色苷提取多以pH3~4为最佳,本实验结果与之有明显差异,可能因本实验提取溶液为纯水,在无有机溶剂的条件下酸度较高的溶液对细胞膜的破坏作用更大,利于胞内花色苷的溶解。溶液pH值为3时原花青素提取效果最好,pH>3时提取效果显著下降。pH值为1~2提取液果胶的吸光度高,pH>2提取效果无显著差异,文献资料报道植物果胶提取一般适宜的溶液pH值为1~2[22]。试验表明,提取阴香果实3种活性成分以pH1~3为宜。
2.4 温度对活性成分提取效果的影响

图4 温度对活性成分提取效果的影响Fig.4 Effect of temperature on the extraction efficiency of active substances
由图4可知,60℃加热提取高花色苷的效果最好,高于60℃提取液的吸光度有所下降。原花青素提取在50℃时的吸光度已获很好的效果,50~90℃的提取液的吸光度间无显著差异,文献报道的原花青素提取以40~50℃为佳。在80~90℃条件下花色苷与原花青素的提取没显著下降,可能是其热稳定性较好,或是果实中的果胶对其具一定的保护作用。40℃提取液中果胶的吸光度达最大,高于40℃处理提取液的吸光度与40℃提取的无显著差异。试验表明40~60℃内3种目的物的提取效果较理想。
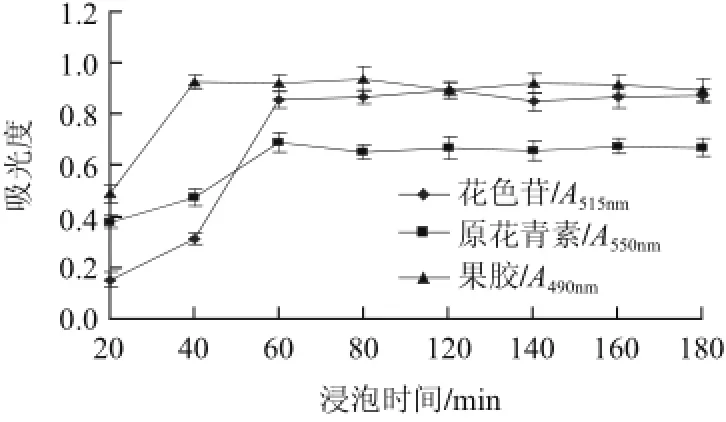
图5 浸泡时间对活性物质提取效果的影响Fig.5 Effect of immersion time on the extraction efficiency of active substances
2.5 浸泡时间对提取效果的影响由图5可知,经60min浸泡花色苷及原花青素的吸光度达最大,果胶提取效果则是40min最佳。结果表明3种成分经40~60min浸泡即可,此时间较多种植物原花青素等成分提取的时间短,可能与阴香果实内含大量脂类与果胶的特殊性有关,除脂的物料水易渗入胞内,对水亲和力强的果胶在较短时间内充分吸水,果胶吸水的膨压对细胞结构具有破坏作用,有利于花色苷与原花青素的提取。
2.6 提取参数的正交试验优化

表1 正交试验设计及结果Table1 Orthogonal array design matrix and results
由表1可知,花色苷提取效果影响较大的是超声波处理时间及温度,因花色苷存在于几乎无果胶的果肉中[2],当超声波处理使细胞破裂后就容易溶出;原花青素和果胶提取以超声波及液料比的影响较大,因原花青素和果胶都主要存在于果核[2],超声波既破裂细胞结构,又使果胶液化,而液料比影响果胶的吸水。由表1亦可知花色苷、原花青素及果胶提取效果最好的参数组合分别为A2B2C2D2、A2B2C2D3及A1B2C2D3,3个组合中均含B2C2,即对3种成分提取的影响一致。A因素中花色苷及原花青素提取以A2最佳,分别比A1和A3的吸光度高4.65%及5.23%,而A1提取果胶的吸光度比A2高11.99%。D因子中花色苷提取以D2为佳,另2种成分则以D3为佳,但D3提取液的吸光度均略大于D2,从同时提取3种成分获得更佳的效果与降低后续的分离、干燥费用综合考虑,认为以采用A1B2C2D2的参数组合更为适宜,即溶液的pH值为1、提取温度50℃、超声波处理时间90s和13(mL/g)的液料比。
2.7 提取次数对活性成分提取率的影响由表2可知,经2次提取后花色苷、原花青素及果胶的累计提取率分别为92.55%、95.65%和96.51%,表明阴香果实中3种活性成分经2次提取的提取率已经很高,实际应用的提取次数以2次提取即可。
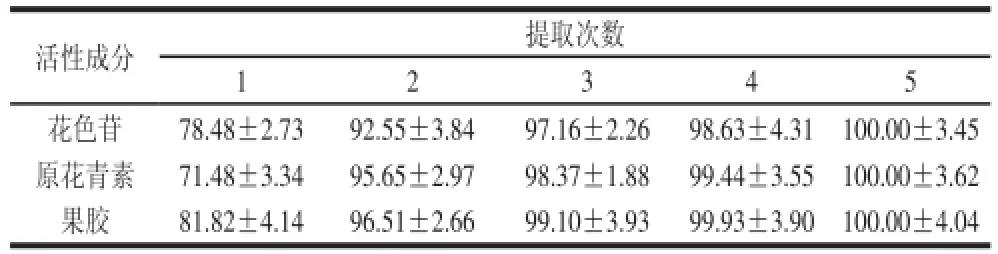
表2 3种活性成分不同提取次数的累计提取率Table2 Effect of number of extractions on the extraction efficiency of active substances %
2.8 提取液活性成分的分离
2.8.1 树脂种类对提取液中活性成分的分离效果
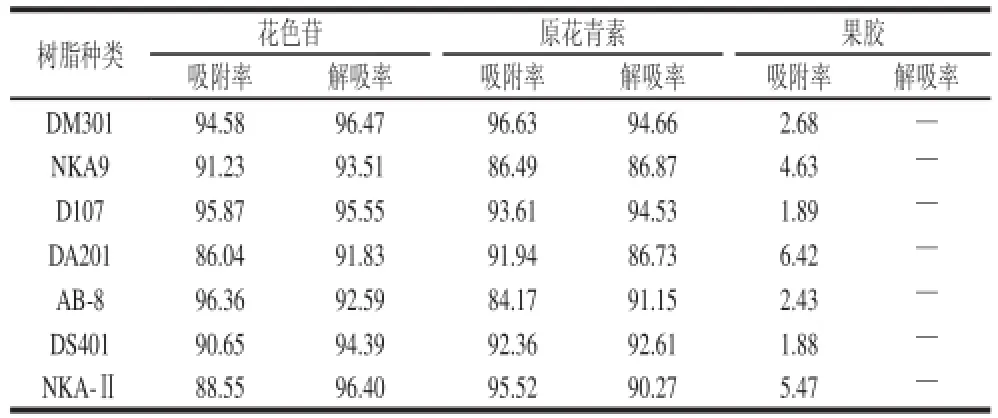
表3 供试树脂对活性成分的吸附效果Table3 Comparison of adsorption and desorption efficiencies of anthocyanins, proanthocyanidins and pectin on different types of macroporous resin %
由表3可知,静态吸附对提取液中花色苷吸附率较高的树脂有DM301、D107和AB-8,对原花青素吸附率较高的树脂为DM301、D107及NKA-Ⅱ,其中DM301对原花青素的吸附作用最强。对花色苷及原花青素解吸率均较高的为DM301及D107。供试树脂对果胶都无明显的吸附,虽然吸附后液果胶的吸光度有所下降,但这种结果可能系树脂表面附着,而非真正吸附的所致。综合结果表明,DM301对花色苷及原花青素的吸附与解吸率均高,是提取液中分离花色苷及原花青素较理想的树脂,而吸附后液经浓缩、醇沉可得较高纯度的果胶[2]。
2.8.2 DM301树脂吸附原花青素及花色苷的洗脱效果
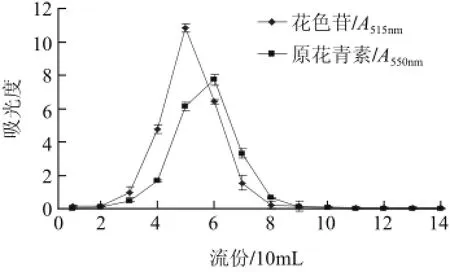
图6 DM301上花色苷及原花青素的洗脱效果Fig.6 Desorption curves of anthocyanins and proanthocyanidins on DM301 resin column
由图6可知,前洗脱的3流份(每流份体积为柱床体积的10%)中花色苷及原花青素的含量很少,第4~7流份(40%柱床体积的洗脱液)内为花色苷和原花青素的解吸高峰,从4~7流份内的高峰洗脱液中花色苷和原花青素吸光度分别为140mL洗脱体积液总吸光度的92.23%与93.11%。结果表明,不仅DM301吸附的2种物质的动态解吸率高,而且解吸峰时间接近。
3 讨 论
3.1 研究表明阴香干果物料中同时提取花色苷、原花青素和果胶3种活性物质以水为溶剂,提取前溶剂与物料混合室温浸泡、搅拌20min,主要参数经正交优化结果溶液pH值为1、50℃浸泡60min、液料比13(mL/g)及功率5W/mL超声波处理时间90s的参数组合为佳,2次提取后获较高的提取率。提取液中花色苷及原花青素以DM301树脂静态吸附,再以80%乙醇溶液动态解吸花色苷及原花青素,干燥后得花色苷及原花青素的精制混合物。提取液的吸附后液经蒸发浓缩,高浓度乙醇沉淀,收集沉淀可得纯度较高的果胶。
3.2 阴香果实含大量的脂类物质,果肉内脂的融点约10℃、果核中脂的熔点45℃左右[2],从阴香干果实中提取3种活性物质应先除尽脂类物质。果实先初步粉碎,破碎率越高越好,而粒径大小不重要,物料50~60℃温度压榨除脂,然后再除去物料内的残脂,再粉碎,过筛粉末物料方可用于提取3种活性成分。油脂的去除应彻底,否则影响提取效果。
目前植物活性成分的提取多采用有机溶剂提取,但阴香果实物料中果胶的含量高,以较高浓度的有机溶剂提取,不仅果胶不能溶解,反而阻碍花色苷及原花青素难以渗出,有机溶剂提取不可行。即使降低有机溶剂浓度、增大液料比后可使3种目的物质溶出,但吸附树脂分离花色苷及原花青素前需先除去其中的有机溶剂,致使提取的费用大幅增加。植物活性物质有用超临界萃取的报道[19-20],而阴香果实中有花色苷、原花青素及果胶3种不同类型的物质,超临界萃取难以同时提取3种物质,以纯水提取阴香干果活性成分为适。
阴香果实内果胶吸收数十倍体积水后仍为胶状,难以进行固液分离。果胶适当吸水后经超声波处理使果胶液化不仅有利于固液分离,而且超声波能使细胞破裂、促进胞内花色苷与原花青素等物质的溶解,若不经超声波处理就难以进行阴香果实成分的提取。超声波在植物产物如黄酮类、果胶等的提取上有较广泛的应用,但多是利用破坏细胞结构、促进胞内物质溶出的作用[21-22],而用于使胶体液化显著降低天然产物提取的液料比未见报道。
果胶等多糖是具重要生理活性的天然产物,活性强弱与分子大小有着密切的关系,一般黏度大的活性较低。超声波处理淀粉具有非随机降解性等优点,而且不同强度超声波处理作用性质也有差异,特定功率超声波处理所后数均分子质量趋于一个固定值,分子质量分布在一个相对窄的范围[23]。超声波处理使阴香果胶的分子质量降低、溶解度增大,活性可能比未处理的更高,但其处理功率大小、处理时间等与果胶处理后成分活性的关系有待深入研究。
树脂分离提取液中的花色苷及原花青素以大孔吸附树脂静态吸附为宜。树脂分离时不宜采用动态吸附,动态吸附可能有较多的较小分子果胶进入孔内,而解吸使用的有机溶剂会致果胶絮凝,影响树脂的重复使用。另外,静态吸附后的树脂上柱前应以适量清水漂洗,否则上柱后树脂表面附着的果胶与解吸液接触后絮凝沉积在树脂上亦影响着树脂的重复使用。
3.3 本工艺技术提取阴香花色苷及原花青素,以水为溶剂,提取液直接以树脂分离与精制。另外,工艺所用DM301树脂对花色苷与原花青素的吸附率和解吸率均高,且几乎同时被洗脱,洗脱液用量少,干燥过程的费用较低。因此,与目前同类物质提取常用技术相比,本工艺技术在节能、减排、降低成本方面具有明显优势。
参考文献:
[1] 骆焱平, 郑服丛, 谢 江. 阴香叶提取物的抑菌活性初步研究[J]. 现代农药, 2005, 4(2): 31-34.
[2] 张镜, 刘小玉, 廖富林, 等. 阴香果实主要成分分析[J]. 食品科学, 2009, 30(18): 240-244.
[3] 任雁, 张惟广. 花色苷的研究进展[J]. 中国食品添加剂, 2006(4): 71-77.
[4] CHRISTOPHER A. Analysis of pigments from aframomum angustifolium and carissa edulis fruit[D]. Kampala: Kampala Msc Thesis Makerere University, 1999.
[5] BAGCHI D, BAGCHI M, STOHS S J, et al. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention[J]. Toxicology, 2000, 148(3): 187-197.
[6] 赵艳, 吴坤. 原花青素生物学作用研究进展[J]. 中国公共卫生, 2006, 22(1): 110-111.
[7] KAZUMI M, TATSUYA H, KAI T, et al. Proanthocyanidin promotes free radical scavenging activity in muscle tissues and plasma[J]. Appl. Physiol. Nutr. Metab. 2007, 32(6): 1097-1104.
[8] JESS R, CRANBERRY F. Atherosclerosis and cardiovascular health[J]. Critical Reviews in Food Science and Nutrition, 2002, 42(Suppl): 301-316.
[9] MARK A W, BARBARA S H, WILHELMINA K, et al. Blueberry polyphenols increase lifespan and thermotolerance in Caenorhabditis elegans[J]. Aging Cell, 2006, 5(1): 59-68.
[10] MARTA R, EVA N, MARIA P, et al. Proanthocyanidins and the risk of colorectal cancer in Italy[J]. Cancer Causes Control, 2010, 21(2): 243-250. [11] SHIN M O, SIK Y, MOON J O. The proanthocyanidins inhibit dimethylnitrosamine-induced liver damage in rats[J]. Arch Pharm Res, 2010, 33(1): 167-173.
[12] DMITRII A Z, NATALYA M P. The composition and properties of pumpkin and sugarbeet pectins[J]. Food Hydrocolloids, 1995, 9(2): 147-149.
[13] GROUDEVA J, KRATCHANOVA M G, PANCHEV I N, et al. Application of granulatedapple pectininthetreatment of hyperlipoproteinaemia[J]. Z Lebensm Unters Forsch A, 1997, 204(5): 374-378.
[14] JENKINS D J, LEEDS A R, GASSULL M A, et al. Decrease in postprandial insulin and glucose concentrations by guar and pectin[J]. Annals of internal Medicine, 1977, 86(1): 20-23.
[15] KOH N. Binding of toxic cations to pectin: its oligomeric fragments and plant tissues[J]. Cabohydr Polym, 1982(2): 273-278.
[16] 张镜, 廖富林, 黄思梅, 等. 阴香果实花色苷提取工艺研究[J]. 食品科技, 2008, 33(11): 200-205.
[17] 陈健, 孙爱东, 高雪娟, 等. 响应面分析法优化超声波提取槟榔原花青素工艺[J]. 食品科学, 2011, 32(4): 82-86.
[18] 宋英, 周小初, 宋崎, 等. 党参中多糖的含量测定方法研究[J]. 中国药业, 2008, 17(23): 9-10.
[19] 吴清波, 罗士数, 张海德. 响应面法优化超临界萃取槟榔碱工艺[J].食品科技, 2011, 36(9): 251-256.
[20] BIMAKR M, RAHMAN R A, TAIP F S, et al. Supercritical carbon dioxide (SC-CO) extraction of catechin, epicatechin, rutin and luteolin from spearmint (Mentha spicata L.) leaves[J]. World Applied Sciences Journal, 2008, 5(4): 410-417.
[21] 张俊生, 陈莉华, 侯孝璇, 等. 超声波辅助乙醇提取垂盆草中总黄酮及其抗氧化活性[J]. 食品科学, 2012, 33(8): 18-23.
[22] 黄永春, 马月飞, 谢清若, 等. 超声波辅助提取西番莲果皮中果胶的研究[J]. 食品科学, 2006, 27(10): 341-344.
[23] 董爱文, 向中, 李立君, 等. 爬山虎红色素的定性定量分析[J]. 无锡轻工大学学报, 2003, 22(6): 99-102.
Extraction of Bioactive Substances from Cinnamonmum burmannii Fruits
ZHANG Jing,ZHU Ming-rui,DIAO Shu-ping
(College of Life Science, Jiaying University, Meizhou 514015, China )
An ultrasonic-assisted aqueous extraction method was proposed to simultaneously extract anthocyanins, proanthocyanidins and pectin from C. burmannii fruits. One-factor-at-a-time method combined with orthogonal array design was used to optimize the extraction process. The optimum extraction conditions were found to be immersion in pH1 acidic water at 50 ℃ for 60 min with a water/solid ratio of 13:1 (mL/g) followed by two cycles of ultrasonic treatment at a power of5 W/mL for 90 s. The extraction yields of anthocyanins, proanthocyanidins and pectin under the optimized conditions were 92.55%, 95.65% and 96.51%, respectively. When the resulting extract was mixed with DM301 resin at a ratio of 1:40, the adsorption and desorption rates were 94.58% and 96.47% for anthocyanins and 96.63% and 94.66% for proanthocyanidins, respectively. In dynamic desorption experiments, the desorption rates of anthocyanins and proanthocyanidins were 92.23% and 93.11%, respectively under the conditions of 80% ethanol as the desorbent,1 BV/h desorption flow rate, and 40% desorption volume (relative to the bed volume). The results of this study suggest that ultrasonic-assisted aqueous extraction and separation by macroporous resin chromatography can allow simultaneous extraction and separation of anthocyanins, proanthocyanidins and pectin from C. burmannii fruits.
C. burmannii;fruit;proanthocyanidin;anthocyanins;pectin;extraction process
Q946.836
A
1002-6630(2013)04-0065-06
2012-06-24
广东省科技计划项目(2009B011300015)
张镜(1957—),男,教授,硕士,研究方向为天然产物与应用微生物。E-mail:zhangcqf@jyu.edu.cn
