胃泌素对胃癌细胞MMP-2和E-Cadherin表达模式的影响*
2013-03-04张宇晴徐优慧黎文婷邹学森罗达亚陈文学黄秀珍
张宇晴,徐优慧,黎文婷,邹学森,罗达亚,陈文学,黄秀珍
(1.江西省肿瘤医院检验科,南昌330029;2.江西中医药大学病理教研室,南昌330004;3.江西省儿童医院,南昌330006;4.南昌大学医学院生化与分子生物学教研室,南昌330006)
胃泌素是一种胃肠激素,大量研究表明胃泌素对胃肠道肿瘤细胞生物学行为有影响,但其在促进胃癌细胞的侵袭、转移方面的机制目前还不清楚。胃癌高表达的基质金属蛋白酶-2(matrix metalloproteinases,MMP-2)可促进肿瘤细胞的组织浸润和扩散,E-钙黏蛋白(E-Cadherin)低表达可使胃癌细胞易于由基质解离而转移[1]。DNA甲基化是哺乳动物细胞重要的基因表达调控方式,主要发生在基因启动子区富含CpG岛的区域,一旦这些CpG岛被甲基化,则相应的基因便会处于失活状态,换言之,甲基化可以使这个基因低表达。基因表达模式变化将影响到细胞生物学行为,导致肿瘤细胞的分化与转移。本文旨在在胃泌素及其受体拮抗剂干预下观察胃癌细胞MMP-2和E-Cadherin基因甲基化变化情况,从而探讨胃泌素在胃癌细胞的侵袭、转移中的调控作用。
1 材料与方法
1.1 材料 MKN45胃癌细胞系由南昌大学一附院消化疾病研究所提供,5肽胃泌素购自上海丽珠东风生物技术公司,丙谷酰胺(分析纯)购自江苏金坛制药厂,甲基化和非甲基化引物由生工生物工程公司合成,DNA提取试剂盒购自北京全式金生物技术有限公司,荧光定量试剂盒(Takara Dalian)SYBR Premix Ex TaqTMⅡ,DA7600自动实时荧光PCR仪。
1.2 方法
1.2.1 细胞培养及实验分组 MKN45胃癌细胞系培养于DMEM培养液中,加10%小牛血清,置37℃、5%CO2恒温培养箱,隔天换液,3d传代1次。用含10%小牛血清的DMEM培养基将胃泌素浓度调为50μg/mL,丙谷胺浓度为64 μg/mL。实验共分4组:空白对照组、胃泌素组、丙谷胺组和胃泌素加丙谷胺组。
1.2.2 DNA提取 取传代后72h的细胞,用含10%小牛血清的培养液调整细胞浓度为1×105接种于6孔培养皿,每孔1.2mL,待细胞贴壁后弃去培养液,空白组加含10%小牛血清培养液10.0mL,胃泌素组加胃泌素液5.0mL,丙谷胺组加丙谷胺液5.0mL,再各加含10%小牛血清培养液5.0mL,胃泌素加丙谷胺组二者各加5.0mL。培养48h后,取出培养皿,从培养皿移去培养液,用胰蛋白酶消化方法收集细胞,按照EasyPureTM Genomic DNA试剂盒说明书进行DNA提取。提取的组DNA经2%琼脂糖电泳检测其完整性,经紫外分光光度计检测A260/A280均在1.8~2.0之间。
1.2.3 DNA硫化并纯化处理 基因组DNA首先经过亚硫酸氢钠化学修饰,若启动子区CpG岛未甲基化,则胞嘧啶(C)变为尿嘧啶(U),而已甲基化的胞嘧啶(Cm)则不变,再根据碱基的变化分别设计甲基化特异性引物(M)和未甲基化特异性引物(U)。DNA修饰后用吸附柱纯化去除游离亚硫酸氢钠后以此作为PCR反应的模板。
1.2.4 甲基化特异性PCR(methylation-specific PCR,MSP)的引物序列 E-Cadherin甲基化上游引物5′-TAA TTA GCG GTA CGG GGG GC-3′[2],下游引物5′-CGA AAA CAA ACG CCG AAT ACG-3′,产物大小170bp;非甲基化上游引物5′-TTA GTT AAT TAG TGG TAT GGG GGG TGG-3′下游引物5′-ACC AAA CAA AAA CAA ACA CCA AAT ACA-3′,产物大小182bp;MMP-2甲基化上游5′-GGT GGT TAT ATG TAT TGA GTT AGT GA-3′,下游引物5′-ACT CTT TAT CCA TTT TAA AAA CAAC-3′[3],产物大小210bp;非甲基化上游引物5′-GCG GTT ATA CGT ATC GAG TTA GC-3′下游引物:5′-ACT CTT TAT CCG TTT TAA AA A CGAC-3′,产物大小205bp。PCR的反应体积为20μL,2×SYBR Premix Ex Taq,DNA 模 板 2μL,上、下游引物(10 pmol/μL)各0.8μL,加水至20μL。循环扩增条件:E-Cadherin 95℃60s;95℃5s,64℃30s,40个循环;MMP-2:95℃60s;95℃5s,59℃30s,40个循环。溶解曲线可判断其特异性,系列稀释的DNA模板标准量观察扩增效率。
1.3 统计学处理 采用SPSS13.0软件对数据进行分析,计量资料采用±s表示。两样本均数比较,方差齐时采用两独立样本t检验,方差不齐时行秩和检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 MSP产物的确定和分析 熔解曲线分析显示,两基因相应两对引物都扩增出了特异性的产物,其峰值所对应的温度与预期产物的Tm值一致,未出现其他异常波形,波的形状也较锐利,见图1。表明实验中所应用的实时检测系统能分别扩增出各自特异性的产物。
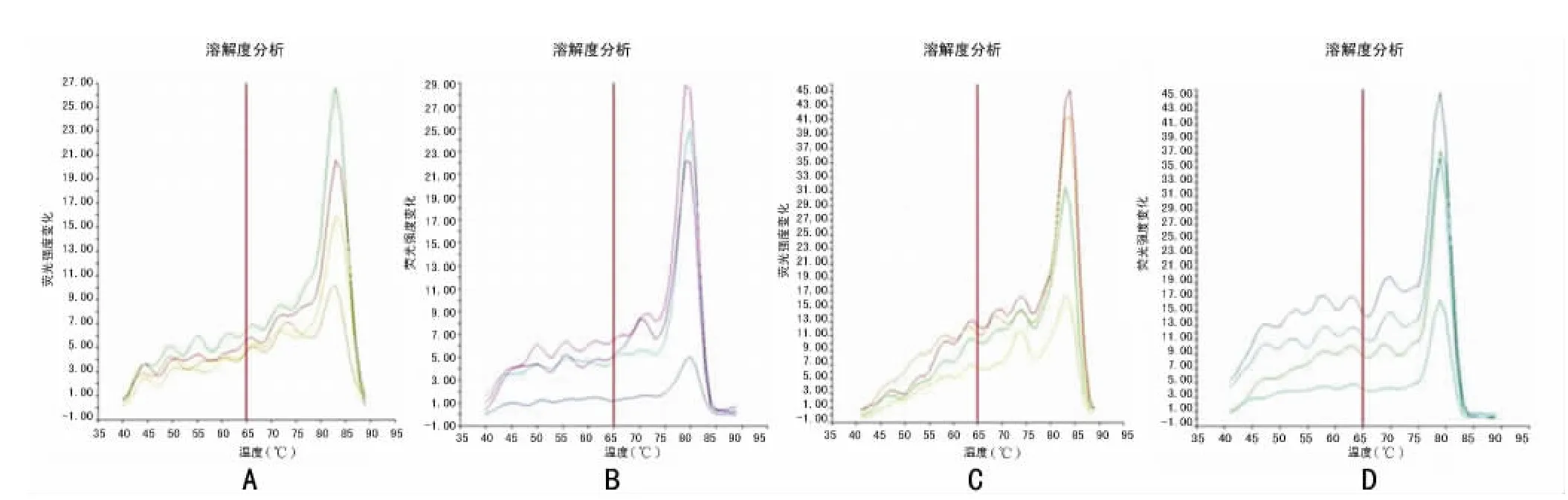
图1 MMP-2和E-Cadherin甲基化和非甲基化熔解分析曲线图
2.2 各组MSP检测产物琼脂糖凝胶电泳结果 如图2所示,甲基化产物与非甲基化产物均为单一条带且与预期片段大小一致。在空白组中,甲基化和非甲基化扩增产物中均电泳出单一条带,说明干预前两基因部分处于甲基化,部分处于非甲基化状态。在受到干预后,甲基化和非甲基化中均扩增出单一产物,说明在胃泌素干预前、后MMP-2和E-Cadherin基因均处于半甲基化状态。

图2 MMP-2和E-Cadherin各组MSP产物琼脂糖凝胶电泳结果
2.3 各干预组与空白组甲基化相对量比较 运用上述建立的MSP方法,分析胃泌素和丙谷酰胺对胃癌细胞中E-Cadherin和MMP-2基因甲基化的影响作用(n=5),采用比较Ct值法计算公式2-△t(△Ct= 甲基化Ct值-非甲基化Ct值)法来进行半定量,显示各组甲基化相对非甲基化水平改变。胃泌素组与空白组比较,MMP-2基因甲基化水平显著下降(P<0.05),而E-Cadherin基因甲基化水平明显升高(P<0.05),丙谷胺组和胃泌素加丙谷胺组相对空白组,MMP-2基因甲基化水平无明显变化(P>0.05),然而E-Cadherin基因甲基化水平则显著下降(P<0.05)。

图3 MMP-2和E-Cadherin各组甲基化相对非甲基化水平改变比较分析
3 讨 论
近年来,人们发现表观遗传在肿瘤的发生、发展过程中起着重要作用,DNA甲基化与癌症的发生、发展密切相关。特定基因启动子区域甲基化变化可以作为癌症的临床诊断的辅助性标志来预测癌症的发生、发展及预后[4]。基因甲基化不但是肿瘤发生的原因之一,而且在肿瘤浸润、转移过程中也发挥作用。胃癌细胞浸润和转移是必然的生物学过程,是否有淋巴结转移及远处转移是决定治疗原则最重要的因素,也是患者死亡的主要原因。而此过程与细胞黏附分子、降解酶类、癌细胞的运动等密切相关。多种研究证实胃癌组织存在E-Cadherin低表达和MMP-2[5-6]高表达,胃泌素可能对这两个基因的表达有一定控制作用。本实验用胃泌素干预MKN45胃癌细胞株,观察E-Cadherin和MMP-2基因启动子区CpG岛甲基化的生物学效应。
MMPs是一类高度保守的依赖于锌离子的内切蛋白水解酶家族,其可降解基底膜和细胞外基质的大多数蛋白质,与肿瘤的侵袭和转移有关。MMP-2是基质金属蛋白酶家族的重要成员之一,主要降解明胶及Ⅳ型胶原。多个研究显示胃癌中MMP-2异常高表达,并且有研究证实 MMP-2与胃癌的侵袭和转移有关[7]。实验数据表明胃泌素可以显著降低 MMP-2基因甲基化水平(P<0.05),丙谷酰胺组及胃泌素加丙谷酰胺组相对空白组能一定程度提高MMP-2基因甲基化水平,并且可以一定程度抑制胃泌素对细胞株的受体效应,但差异无统计学意义(P>0.05)。说明胃泌素在提高MMP-2基因表达方面发挥重要作用,而丙谷胺则可一定程度上抑制MMP-2的表达。胃泌素降低了MMP-2基因甲基化水平,则相应的基因便会处于活跃状态,基因启动子区呈开放状态,从而可促进MMP-2基因表达相应的蛋白。国内外研究表明MMP-2表达量与胃癌恶性程度相关[5-6],MMP-2降解细胞外基质,并重塑肿瘤组织循环,从而导致胃癌细胞浸润转移,这说明胃泌素通过MMP-2甲基化变化对胃癌细胞生物学行为方面有着重要影响[8]。丙谷酰胺和胃泌素加丙谷酰胺组能在一定程度上提高MMP-2基因甲基化水平,但不明显。以上结果说明胃泌素可通过MMP-2促进胃癌细胞转移,而丙谷胺可一定程度抑制其生物学行为。
E-Cadherin作为最重要的黏附分子,是一种肿瘤细胞侵袭转移抑制剂,其生理功能主要是介导上皮细胞黏附、维持组织结构完整性,并维持细胞极性和参与分化。E-Cadherin失活与多种肿瘤的浸润和转移有关,其失活机制主要有:基因突变、杂合性缺失、甲基化等。本实验探讨其甲基化变化,结果表明胃泌素可明显提高MKN45胃癌细胞E-Cadherin基因甲基化水平(P<0.05),其拮抗剂丙谷酰胺明显抑制E-Cadherin基因甲基化(P<0.05),在一定程度上可促进体外胃癌细胞E-Cadherin表达,而胃泌素抑制其表达。说明胃泌素在肿瘤侵袭方面起促进作用,而丙谷胺则可能起抑制作用。Sun等[9]证实人胃癌细胞株MKN-45在使用胃泌素受体拮抗剂后胃癌细胞更易于发生凋亡,并发现是通过上调细胞凋亡促进基因Bax基因和下调细胞凋亡抑制基因Bcl-2基因来实现的。丙谷胺可一方面抑制侵袭转移,另一方面可促进癌细胞凋亡。肿瘤细胞黏附相关基因的启动子区高甲基化导致基因沉默可引起肿瘤侵润转移能力的增强。
研究发现,肿瘤细胞的基因组甲基化水平与正常细胞相比有着特有DNA甲基化区域(cancer-specific differentially DNA-methylatedregion,cDMR),用基因组亚硫酸盐测序发现相同的cDMR随机的甲基化差异导致了不同类型的肿瘤,引起CpG岛的甲基化水平发生异常[10]。研究认为DNA甲基化模式的维持是由一系列甲基化、去甲基化、组蛋白乙酰化及多种甲基结合蛋白状态之间动态平衡所决定[11]。本实验也表明 MMP-2和E-Cadherin均存在半甲基化状态,它已成为经典的造成基因表达紊乱的"第二次打击模式"。王丽等[12]实验证明,胃泌素在胃正常上皮细胞、慢性萎缩性胃炎、胃上皮不典型增生的表达呈现递减的趋势,胃泌素表达水平的变化可能为胃癌发生前的一种状态。有实验用小干扰RNA干扰胃泌素基因的表达而降低胃泌素的表达,干扰胃泌素基因表达后可以显著抑制胃癌细胞的迁移[13],Ajani等[14]用胃泌素免疫抗原特异性的抗胃泌素抗体,从而抑制了肿瘤细胞的增殖和浸润。多种研究证实胃泌素参与了胃癌的发生、发展,随着肿瘤生长调节机制研究的不断深入,人们可望通过操纵激素的方法选择胃泌素依赖性胃癌进行内分泌治疗。
如何确定哪些基因的甲基化水平改变是导致癌症发生的主要原因,有研究者发现,癌细胞要生存必需有一些基因沉默表达,而主要是因为这些基因启动子区域是高度甲基化状态导致[15]。DNA甲基化是基于非序列改变所致表达水平变化,是可控、可调的变化。因此在癌症中高甲基化的基因可以作为癌症治疗的一个靶点,可以通过使用去甲基化试剂使高甲基化的基因恢复表达[16]。甲基化变化为人类在肿瘤发病机制研究及其早期诊断和治疗方面开辟新的途径。因此,针对胃泌素导致胃癌细胞相关基因表达模式变化,进行药物联用和寻找特异性调节甲基化酶活性的药物是胃癌治疗的一个方向。
[1]Graziano F,Humar B,Guilford P.The role of the E-Cadherin gene(CDHI)in diffuse gastric cancer susceptibility:from the laboratory to clinical practice[J].Ann Oncol,2003,14(12):1705-1713.
[2]Bornman DM,Mathew S,Alsruhe J,et al.Methylation of the E-Cadherin gene in bladder neoplasia and in normal urothelial epithelium from elderly individuals[J].Am J Pathol,2001,159(3):831-835.
[3]Farias,Lucyana Conceicao,Gomes,Carolina Cavalieri.Epigenetic regulation of matrix metalloproteinase expression in ameloblastoma[J].BMC Clin Pathol,2012(12):11.
[4]Deng D,Liu Z,Du Y,et al.Epigenetic alterations as cancer diagnostic,prognostic,and predictive biomarkers[J].Adv Genet,2010(71):125-176.
[5]Chen D,Wang Y,Zhang K,et al.Antisense oligonucleotide against clusterin regulates human hepatocellular carcinoma invasion through transcriptional regulation of matrix metalloproteinase-2and E-Cadherin[J].Int J Mol Sci,2012,13(8):10594-10607.
[6]Guo XT,Wang JF,Zhang LY,et al.Quantitative assessment of the effects of MMP-2polymorphisms on lung carcinoma risk[J].Asian Pac J Cancer Prev,2012,13(6):2853-2856.
[7]Curran S,Murray GI.Matrix metalloproteinases:molecular aspects of their roles in tumour invasion and metastasis[J].Eur J Cancer,2000,36(13):1621-1630.
[8]Zheng H,Takahashi H,Murai Y,et al.Expressions of MMP-2,MMP-9and VEGF are closely linked to growth,invasion,metastasis and angiogenesis of gastric carcinoma[J].Anticancer Res,2006,26(5A):3579-3583.
[9]Sun WH,Zhu F,Chen GS,et al.Blockade of cholecystokinin-2receptor and cyclooxygenase-2synergistically induces cell apoptosis,and inhibits the proliferation of human gastric cancer cells in vitro[J].Cancer Lett,2008,263(2):302-311.
[10]Hansen KD,Timp W,Bravo HC,et al.Increased methylation variation in epigenetic domains across cancer types[J].Nat Genet,2011,43(8):768-775.
[11]Rhee I,Bachman KE,park BH,et al.DNMT1and DNMT3bcoopcrate to silence genes in human cancer cells[J].Nature,2002,416(6880):552-556.
[12]王丽,周丽雅,李渊,等.胃泌素在胃炎与胃癌中表达的差异及意义[J].中国微创外科杂志,2011,5(11):435-436.
[13]茆家定,钱海鑫,吴佩,等.ERK-MAPK信号转导通路在胃泌素促进人结直肠癌细胞增殖中的作用及其机制[J].中华消化外科杂志,2013,12(2):139-144.
[14]Ajani JA,Hecht JR,Ho L,et al.An open-label,multinational,multicenter study of G17DT vaccination combined with cisplatin and 5-fluorouracil in patients with untreated,advanced gastric or gastroesophageal cancer:the GC4 study[J].Cancer,2006,106(9):1908-1916.
[15]De Carvalho DD,Sharma S,You JS,et al.DNA methylation screening identifies driver epigenetic events of cancer cell survival[J].Cancer Cell,2012,21(5):655-667.
[16]Yoo CB,Jones PA.Epigenetic therapy of cancer:past,present and future[J].Nat Rev Drug Discov,2006,5(1):37-50.
