卵巢癌生物标志物研究的现代进展
2013-02-28王继贵
王继贵
(中南大学湘雅二医院检验科,湖南长沙410011)
·述评·
卵巢癌生物标志物研究的现代进展
王继贵
(中南大学湘雅二医院检验科,湖南长沙410011)
卵巢癌是妇女中最普通的一种恶性肿瘤。由于卵巢癌临床症状含糊不清,大多数病人是在晚期阶段诊断出的。本文概述了用血清生物标志物对卵巢癌早期诊断及疾病进程监测的当前进展。
卵巢癌;生物标志物;检测
卵巢癌(Ovarian cancer,OC)的诊断主要基于临床症状、影像学及实验室生物标志物的检查。总的来说,已鉴别出200多种潜在的生物标志物,在OC时有不同的表达[1]。然而,已发现没有单一的生物标志物对于OC的诊断是满意的,当多种生物标志物联合使用时,对OC的诊断可增加敏感度和特异性。由于OC病人临床症状是难以捉摸和非特异的,大多数病人是在疾病的晚期阶段诊断出的,此时其5年生存率仅30%[2]。因此,早期诊断OC将显著改善病人的预后。本文将概述用血清生物标志物对OC的早期诊断及疾病进程监测的当前进展。
1 OC的分类
大多数OC是由三个生物类别的细胞发展而来;上皮细胞、性索基质细胞和生殖细胞。它们之中,上皮细胞癌占OC的90%。上皮细胞OC又被分成5个亚型:(1)浆液型,约占50%左右;(2)黏液型,约占5%~10%;(3)子宫内膜样型,约占10%~25%;(4)透明细胞型,约占4%~5%;(5)变迁型,罕见[3]。因为OC细胞有各种各样的组织型,可以表达不同的肿瘤标志物,重要的是用多种肿瘤标志物可以检测所有的OC。
2 卵巢癌的生物标志物
过去20年,用先进的技术,物别是质谱法,发现了大量的血清生物标志物同OC有关[1]。Cramer等[4]在多种癌症病人中,研究了OC生物标志物的过筛特性,发现了一些有希望的标志物。
2.1 糖链抗原125糖链抗原125(Carbohydrate antigen 125,CA125)在1981年由Bast等人发现的。当时他们用浆液性OC细胞株免疫鼠,产生了鼠单克隆抗体(OC125)。随后的研究显示:用参考界值35U/ml作为判断标准,发现在80%浆液型OC的CA125增加、黏液型有69%、子宫内膜样型有75%、透明细胞型有78%、未分化型OC有88%。良性卵巢疾病病人有2.2%~27.8%CA125升高,在健康妇女中也发现有0.2%~5.9%人群CA125升高。CA125升高在Ⅰ期OC病人中有50%、Ⅱ期有90%,Ⅲ和Ⅳ期OC病人则>90%。然而,在其他癌时,如子宫内膜癌、胰腺癌、肺癌、乳腺癌、结直肠癌及其他胃肠道癌,CA125水平也增加。
由于CA125的特异性有限,目前尚未用作常规诊断试验,但是用于监测治疗反应及检测疾病复发,它还是有用的[5]。最近,测定CA125被认为是对许多OC病人监测的医疗标准,妇产科癌症社会团体(GCIG)间已达成一致意见,推荐CA125只能用作评价治疗效果,CA125反应标准被定义为:同治疗前的样本比较,若治疗后CA125下降50%,或CA125浓度在治疗后下降到参考范围内,被认为是对治疗有完全的应答[6]。
Prat等[7]评价了CA125最低值在参考范围(<35U/ml)时的预后作用,继最初治疗之后,发现CA125水平绝对值增加≥5U/ml(同它的最低值比较),是OC复发的一个强烈预测指征。这个新的CA125预测进展的标准,得到的敏感度为90%,阳性预测值为96.4%,假阳性率为5.6%。这些研究证实适当应用CA125,可以帮助癌症专家检测OC的早期复发。
2.2 人附睾蛋白4人附睾蛋白4(Human epididymis 4,HE4)是一种低分子量的糖蛋白,一种人附睾蛋白的前身,且是稳定的4-二硫化物家族的一个成员。HE4主要在正常妇女生殖组织上皮细胞中表达,在严重OC病人中过表达者为93%,子宫内膜样癌为100%,透明细胞癌中为50%,但是
在黏液型或OC的生殖细胞中不表达[8]。Escudero等[9]在127例OC病人、292例良性妇科疾病病人及101例健康对照中研究了HE4和CA125的表达。以CA125界值35U/ml,HE4界值140nmol/ml作为判断标准,结果显示:在健康人,HE4结果异常者有1.1%,CA125有9.9%;在良性妇科疾病的病人中,HE4异常者有12.3%,CA125有37%,HE4增加的良性妇科疾病病中,肾衰竭是最普通的原因,与其他良性妇科病人比较,有显著差别(P= 0.001)。在OC同妇科良性疾病的鉴别诊断中,HE4的ROC曲线下面积比CA125显著增加(0.874比0.722),因此认为HE4对OC的诊断特异性比CA125显著高一些,而联合检测HE4和CA125,可显著改善所有阶段及组织型OC的诊断效率,由Anastasi等[10]的一份研究显示,在OC复发的病人中,在CA125之前5~8个月,HE4已增加,表明HE4对于监测OC复发可能是一个较好的新的早期标志物。
2.3 巢蛋白-2巢蛋白-2(Nidogen-2)是一种基底膜蛋白质,在基底膜成份中,巢蛋白家族有两个已知的基底膜蛋白质在细胞外基质中有重要的作用。在人类,已经鉴定出两种巢蛋白,巢蛋白-1(分子量150KDa)和巢蛋白-2(200KDa),两种蛋白质有46%主要序列完全相同。2010年,Kuk等[11]首先报告巢蛋白-2是OC的一种新的血清生物标志物,可用于早期诊断。研究包括100例OC病人、100例良性妇科疾病病人和100例健康对照。上述血清标本同时用Roche商品免疫试验测定CA125和非竞争Sandwich ELISA测定巢蛋白-2浓度。结果显示:正常对照组和良性妇科疾病组血清巢蛋白-2浓度平均值分别为13.2mg/L和12.1mg/L,两组之间无显著差异。然而,OC病人组血清巢蛋白-2浓度则升高,平均值为18.6mg/L,与正常对照组或良性妇科疾病组比较有显著差异(P<0.001)。在所有样本中发现CA125和巢蛋白-2浓度密切相关(P<0.001)。提示血清巢蛋白-2可能是OC的一个新血清标志物。
除了上述几种重要的生物标志物外,已报道的与OC有关的血清标志物还有很多,下面摘几种主要的(见表1),它们主要同其他生物标志物组合,联合测定用于OC的早期筛查,可以改善OC检测的敏感度和特异性。
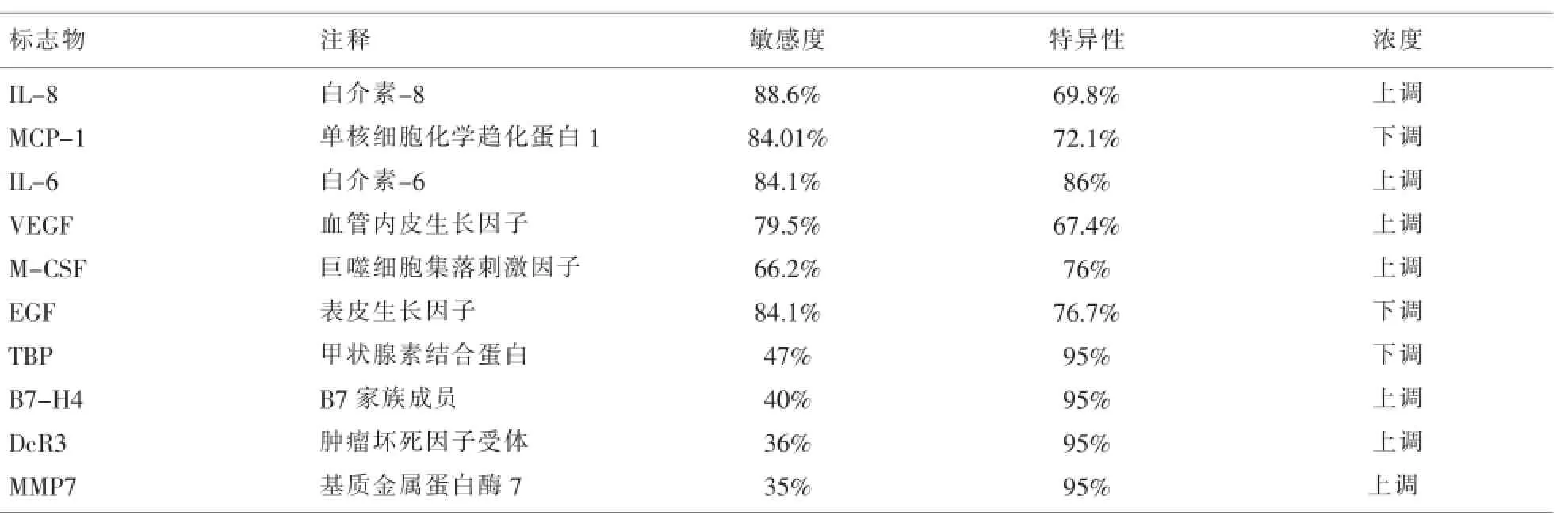
表1 同OC有关的重要血清标志物
3 多标志物组合用于OC的诊断
由于OC标志物的敏感度和特异性有限,当前尚没有单一的标志物被FDA批准用于OC的早期诊断。假阳性结果将导致不必要的手术和治疗,因此,过筛试验的特异性是极为重要的。由于单一标志物未成功地用于OC的早期诊断,研究转向联合多种生物标志物组合在一起用于OC的早期诊断。
Yurkovetsky等[2]研究了35种生物标志物,分别组合成4标志物的检测板,用于检测早期OC可增加敏感度,如一种检测板包括CA125、HE4、CEA和VCAM-1(血管细胞黏附分子-1)。此板有较好的检测效果,用于早期OC得到的敏感度为86%,特异性为93%;用于晚期OC特异性为98%。当前,大量研究已表明,多标志物平台比单用CA125改善了诊断效力,随后,有报告用5种和7种生物标志物组合一种检测板,用于筛查早期OC,现摘要于表2[12]。
多标志物组合进行联合检测,提升了对数学技术的需要,它不是以单个标志物在联合检测中的测定值来解释结果,而是将测定值经过数学处理,得来各种组合指数(Composite Index)进行评价。Zhang等[13]在研究中设计了一种人工神经网络(Artificial neural network)模拟工具,将联合测定中各标志物值输入计算出组合指数,显著改善了Ⅰ期
上皮细胞卵巢癌病人同健康妇女的鉴别诊断难度,提高了早期OC的诊断效率。
Gorelik等[14]用Sandwich免疫试验和玻璃微珠技术研究了细胞因子作为新的一组肿瘤标志物在OC诊断中的作用,共研究了24种细胞因子(包括细胞因子、化学趋化因子、生长因子和血管生成因子)。发现IL-6、IL-8、EGF、VEGF、MCP-1和CA125六种标志物组合的检测板,通过LabMAP(自动控制领域的一种软件中间件)技术分析,能很好地鉴别OC和健康对照,可以代表一个有希望的手段用于OC的早期检测。
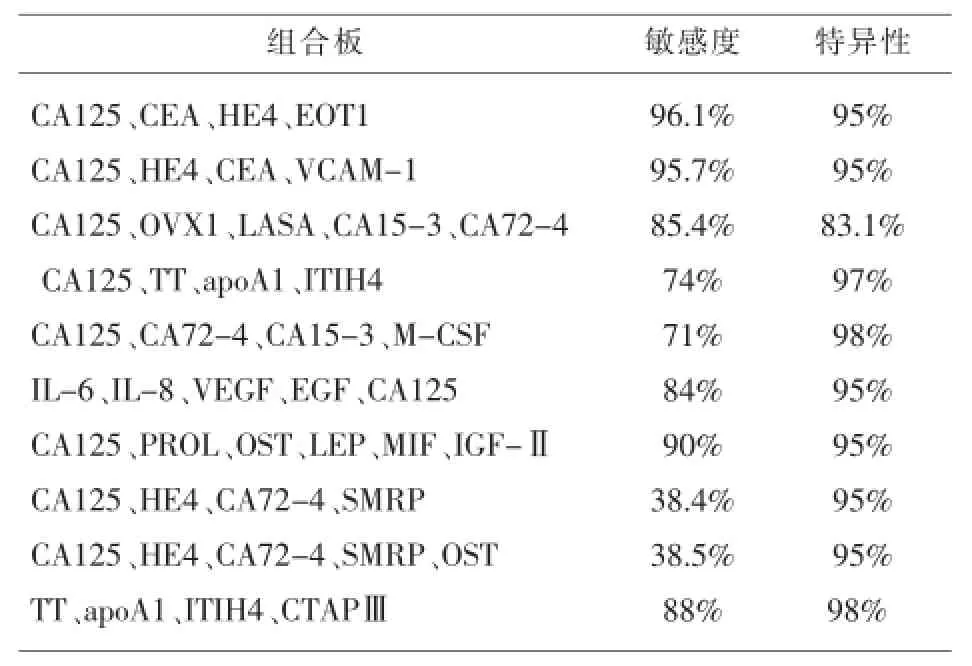
表2 多标志物板用于检测OC的敏感度和特异性
4 小结
对于OC早期诊断的挑战仍然存在,虽然已发现数百个生物标志物同OC有关,它们对早期诊断的用途至今尚未确定。用新的技术,如质谱法,预料将会发现同OC有关的另外的新的生物标志物,这时的义务将是发展多元的试验,它有可能在一个单一的检测板上同时测定多种生物标志物。联合使用多种生物标志物,包括CA125、HE4及其他生物标志物组合在一起对于OC的早期诊断、治疗反应的监测及预测疾病的复发是今后的一个研究方向。
[1]Lokshin AE.The quest for ovarian cancer screening biomarkers: are we on the right road?[J].Int J Gynecol Cancer,2012 22(suppl 1):S35-40.
[2]Yurkovetsky Z,Skates S,Lomakin A,et al.Development of a multimarker assay for early detection of ovarian cancer[J].J Clin Oncol, 2010,28(13):2159-2166.
[3]Chen VW,Ruiz B,Killeen JL,et al.Pathology and classification of ovarian tumors[J].Cancer,2003,97(10 suppl):2631-2642.
[4]Cramer DW,Bast Jr RC,Berg CD,et al.Ovarian cancer biomarker performaceinprostate,lungcolorectalandovariancancer screening trial specimens[J].Cancer Prev Res(Phila)2011,4(3): 365-374.
[5]Lutz AM,Willmann JK,Drescher CW,et al.Early diagnosis of ovarian carcinoma:is a solution in sight?[J].Radiology 2011,259 (2):329-345.
[6]Rustin GJ,Vergote I,Eisenhauer E,et al.Definition for response and progression in ovarian cancer clinical trials incorporating RECIST 1.1 and CA125 agreed by the Gynecological Cancer Intergroup(GCIG)[J].Int J Gynecol Cancer,2011,21(2):419-423.
[7]Prat A,Parera M,Peralta S,et al.Nadir CA125 concentration in the normal range as an independent prognostic factor for optimally treated advanced epithelial ovarian cancer[J].Ann Oncol,2008, 19(2):327-331.
[8]Drapkin R,von Horsten HH,Lin Y,et al.Human epididymis protein 4(HE4)is a secreted glycoprotein that is overexpressed by serous and endometrioid ovarian carcinomas[J].Cancer Res, 2005,65(6):2162-2169.
[9]Escudero JM,Auge JM,Filella X,et al.Comparison of serum human epididymis protein 4with cancer antigen 125 as a tumor marker in patients with malignant and nonmalignant diseases[J].Clin Chem,2011,57(11):1534-1544.
[10]Anastasi E,Marchei GG,Viggiani V,et al.HE4:a new potential early biomarker for the recurrence of ovarian cancer[J].Tumour Biol,2010,31(2):113-119.
[11]Kuk C,Gunawardana CG,Soosaipillai A,et al.Nidogen-2:A new serum biomarker for ovarian cancer[J].Clin Biochem,2010,43(4~5):355-361.
[12]Zengliu Su,Whitney SG,Yusheng Zhu.Detection and monitoring of ovarian cancer[J].Clin Chim Acta,2013,415:341-345.
[13]Zhang Z,Yu Y,Xu F,et al.Combining multiple serum tumor markers improves detection of stage 1 epithelial ovarian cancer[J]. Gynecol Oncol,2007,107(3):526-531.
[14]Gorelik E,Landsittel DP,Marrangoni AM,et al.Multiplexed immunobead-based cytokine profiling for early detection of ovarian cancer[J].Cancer Epidemiol Biomarkers Prev,2005,14(4):981-987.
R737.31,R730.43
A
1674-1129(2013)06-0515-03
10.3969/j.issn.1674-1129.2013.06.001
王继贵,男,1937年生,湘雅二医院检验科原主任,主任检验师,研究方向为临床生物化学。
