IL-17、COX-2在口腔扁平苔藓和口腔鳞癌中的表达分析
2013-02-27徐佳瑛杨丽丽陈启林
徐佳瑛 杨丽丽 马 超 陈启林
口腔癌是我国常见的恶性肿瘤之一,发病率较高[1],近年来在东亚国家及地区均有上升的趋势。口腔癌容易复发,复发率为20% ~48%,5年生存率约60%,且部分患者发病年龄较低,有年轻化趋势。近年来研究发现炎性因子可通过改变局部微环境而影响肿瘤的发生、发展,而环氧化酶-2(COX-2)与细胞凋亡、肿瘤发生等密切相关[2]。本研究通过观察白介素-17(IL-17)与COX-2在口腔扁平苔藓、口腔鳞状细胞癌中的表达情况,分析两者的关系和临床意义。
1 材料与方法
1.1 一般资料
选取2009年1月至2012年1月我科初诊的20例口腔扁平苔藓和20例口腔鳞癌患者的病理组织为研究对象,分别纳入扁平苔藓组和鳞癌组。所有病理组织均取自手术切除并经石蜡包埋处理,术前未进行免疫、激素、放疗、化疗等相关治疗,患者本身未合并其他自身免疫性疾病。选取20例正常口腔黏膜组织作为对照组,均取自口腔外伤患者,排除口腔黏膜疾病或全身免疫系统疾病,镜下组织表现为复层鳞状上皮,包括基底层、棘细胞层、颗粒层、角化层。
1.2 方法
1.2.1 仪器和试剂 超净工作台,微型常温离心机,超纯水及除菌系统,电冰箱,OLYMPUS光学显微镜及数码成像系统等。兔抗人IL-17单克隆抗体,购自北京博奥森生物有限公司;抗COX-2多克隆抗体购自美国SantaCruz公司;SP免疫组化试剂盒以及DAB显色试剂盒购自北京中山生物有限公司。
1.2.2 试验步骤 切片机连续切片,厚度取4 μm,并置于经多聚赖氨酸处理的载玻片上。常规脱蜡水洗后置于3%双氧水中约10 min,灭活内源性过氧化物酶。室温下采用柠檬酸缓冲液,微波加热修复抗原,并以正常羊血清封闭20 min,蒸馏水冲洗后将载玻片上的水渍擦干。滴加一抗,37℃下孵育1 h,滴加山羊抗小鼠IgG,37℃下静置30 min,然后滴加SP复合物,静置30 min,DAB浓缩试剂盒显色,显微镜下控制显色时间,冲洗后苏木精复染,然后脱水、透明、封片。所有实验步骤及操作严格按试剂盒说明进行,设立阴性对照并将PBS代替一抗重复操作。
1.3 评价标准
所有切片均在镜下随机选取5个以上高倍视野(×400)观察,浅黄色-棕褐色细颗粒状为阳性表现,计算阳性细胞百分比。按阳性细胞所占的百分比进行分级,阳性细胞表达率<10%为阴性(-),≥10% ~20%为弱阳性(+),>20% ~50%为阳性 (++),>50%为强阳性(+++)。
1.4 统计学处理
研究数据均由SPSS13.0软件进行统计学分析,计数资料采用χ2检验,双侧检验水准 α=0.05,以 P<0.05为有统计学意义。
2 结果
2.1 IL-17在正常口腔黏膜,口腔扁平苔藓及口腔鳞癌组织中的表达
对照组中14例(70.0%)呈不同程度的阳性表达,主要位于胞质,分布于颗粒层、角化层、部分棘细胞层,间质细胞中可见少量阳性表达;扁平苔藓组19例(95.0%)呈阳性表达,主要在固有层浅层上皮细胞内表达。鳞癌组中均有阳性表达,肿瘤细胞及周围间质细胞均可见阳性表达。经比较发现,IL-17在扁平苔藓组与鳞癌组中的阳性表达率均显著高于对照组(P<0.05),但扁平苔藓组与鳞癌组IL-17阳性率无统计学差异(P >0.05),见表1。
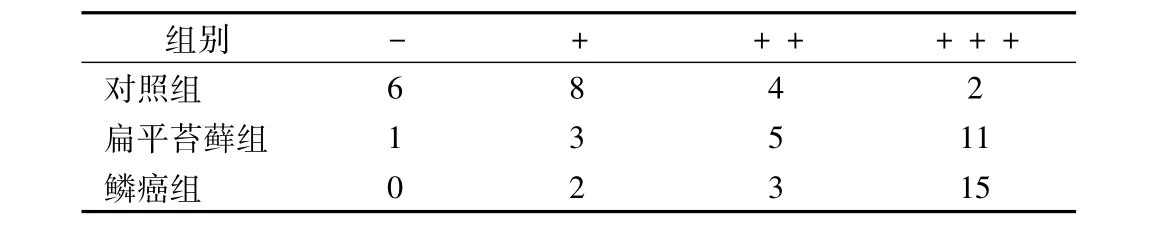
表1 IL-17在正常口腔黏膜,口腔扁平苔藓及口腔鳞癌组织中的表达(例)
2.2 COX-2在正常口腔黏膜,口腔扁平苔藓及口腔鳞癌组织中的表达
对照组中未见COX-2阳性表达,扁平苔藓组中10例(50.0%)阳性表达,以细胞胞质或核膜为主,多见于上皮棘细胞层、颗粒层以及角化层,基底细胞未见阳性表达;在鳞癌组中16例(80.0%)阳性表达,鳞状癌细胞中呈强阳性表达。经比较发现,COX-2在扁平苔藓组与鳞癌组中的阳性表达率均显著高于对照组(P<0.05),且鳞癌组高于扁平苔藓组(P <0.05),见表2。

表2 COX-2在正常口腔黏膜,口腔扁平苔藓及口腔鳞癌组织中的表达(例)
3 讨论
口腔扁平苔藓是口腔黏膜的慢性非感染性炎性疾病,Th1/Th2失衡等免疫因素在疾病的发生、发展中具有重要作用。因口腔扁平苔藓具有癌变潜能,故WHO将其列入潜在恶性病变范畴。大量研究发现,口腔扁平苔藓病损区以T淋巴细胞聚集为主,包括辅助性和抑制性T细胞,而B细胞、自然杀伤细胞却相对少见。活化的T淋巴细胞可产生多种炎性因子来调控、促进免疫反应过程,引起大量活化的T淋巴细胞在局部组织浸润[3]。部分 T淋巴细胞可分泌 IL-17(Th17亚群),并可促进炎症反应、调节免疫应答,促进炎细胞因子分泌,在自身免疫性疾病中具有重要作用[4]。
口腔扁平苔藓具有慢性持续性、免疫抑制功能降低,病变区可见毒性T细胞克隆等自身免疫性疾病的特征。目前在实体瘤与周围间质关系的研究中发现,慢性炎症过程中细胞因子的变化可影响局部微环境,进而改变正常细胞的存活、增殖、分化周期,是肿瘤起始、进展并具有侵袭性和转移能力的关键因素之一[5]。在胃癌、非小细胞肺癌、卵巢癌、肝癌、肠癌、乳腺癌恶性肿瘤中均可发现Th17细胞及IL-17;进一步研究局部微环境,发现恶性肿瘤细胞可分泌MCP-1、促炎因子等,促进Th17细胞分化并维持其生长过程[6]。本次研究发现,约30%的正常口腔黏膜组织不表达IL-17,70%阳性表达于胞质,包括颗粒层、角化层、部分棘细胞层以及间质细胞。95%扁平苔藓组织IL-17呈阳性表达,多见于固有层浅层上皮细胞,而鳞癌组织中均有阳性表达,肿瘤细胞及周围间质细胞均可见阳性表达。经比较发现,IL-17在扁平苔藓组与鳞癌组阳性表达率均显著高于对照组,扁平苔藓组与鳞癌组IL-17阳性率无显著差异,但鳞癌组强阳性表达率显著高于扁平苔藓组。IL-17在口腔扁平苔藓、口腔鳞癌中均有高度表达,提示口腔扁平苔藓上皮长期受炎症细胞浸润,随着局部细胞因子水平改变,炎性因子网络化激活可能促进口腔鳞癌的发生。但也有学者认为,IL-17高表达是非霍奇金淋巴瘤预后较好的指标之一[7]。因此,IL-17在癌前病变及鳞癌中的表达水平与预后的关系尚需进一步深入研究。
COX-2属于诱导型酶,在大多数正常组织中不表达,在炎性因素等刺激下可诱导性表达,有学者发现其在癌基因、生长因子的作用下也可表达。COX-2的过度表达在癌前病变组织中较早出现,甚至早于细胞凋亡周期改变。有学者研究发现舌鳞状细胞癌中COX-2表达水平与肿瘤侵袭性、转移能力、预后等相关[8]。近年来对肿瘤微环境及发生、发展的研究发现,COX-2表达水平上升与肿瘤血管形成关系密切[9-10]。本次研究发现,COX-2在正常口腔黏膜细胞中几乎不表达,50.0%的扁平苔藓阳性表达,80.0%鳞癌阳性表达。经比较发现,COX-2在扁平苔藓组与鳞癌组阳性表达率均显著高于对照组,且鳞癌组阳性率高于扁平苔藓组,与其他学者研究结果相近。Pandey等研究发现COX-2在正常口腔黏膜、癌前病变、口腔鳞癌中表达水平逐渐增高[11]。
口腔黏膜癌变的机制是临床研究的热点之一,特别是癌前病变进展为肿瘤的过程,例如局部微环境的变化,细胞因子间的正、负反馈网络,多种因子共同作用引起细胞生长周期变化,刺激肿瘤血管生成等等[12]。本次研究初步发现IL-17与COX-2在口腔扁平苔藓及鳞癌中均有不同程度的表达,但具体机制及对肿瘤微环境的影响尚需进一步深入研究,例如动态观察肿瘤的发生与发展与IL-17、COX-2的关系,从而为临床治疗、预后评估提供参考。
[1]付荣明.原癌基因eIF4E在口腔鳞癌及切缘中的表达及其意义〔J〕.实用癌症杂志,2009,24(5):477.
[2]钱 毅,乔文静,马叶华,等.人健康和炎性牙槽骨成骨细胞 COX-2、PGE2、OPG,RANKL 的表达〔J〕.口腔医学研究,2010,26(4):529.
[3]卢 锐,周 刚.辅助性T淋巴细胞极化相关细胞因子在口腔扁平苔藓中的研究进展〔J〕.国际口腔医学杂志,2008,35(6):627.
[4]Nguyen CQ,Hu MH,Li Y,et al.Salivary gland tissue expression of interleukin-23 and interleukin-17 in Sjogren's syndrome:findings in humans and mice〔J〕.Arthritis Rheum,2008,58(3):734.
[5]刘国林,闫 威,陈 勇,等.口腔扁平苔藓癌变的研究进展〔J〕.肿瘤防治研究,2010,37(7):848.
[6]Su XM,Ye J,Hsueh EC,et al.Tumor microenvironments direct the recruitment and expansion of human Th17 cells〔J〕.J Immunol,2010,184(3):1630.
[7]Yang ZZ,Novak AJ,Ziesmer SC,et al.Malignant B cells skew the balance of regulatory T cells and TH17 cells in B-cell non-Hodgkin's lymphoma〔J〕.Cancer Res,2009,69(13):5522.
[8]Renkonen J,Wolff H,Paavonen Y.Expression of cyclo-oxygenase-2 in human tongue carcinoma and its precursor lesions〔J〕.Virchows Arch,2002,440(6):594.
[9]胡贤杰,郭贵龙,顾 馨,等.环氧化酶-2在甲状腺乳头癌中的表达及对淋巴管生成的影响〔J〕.实用肿瘤杂志,2008,23(4):338.
[10]冯正虎,李春青,杨 兰,等.口腔鳞状细胞癌中环氧化酶2的表达与淋巴管生成的相关性〔J〕.现代口腔医学杂志,2010,24(2):131.
[11]Pandey M,Prakash O,Santhi WS,et al.Overexpression of COX-2gene in oral cancer is independent of stage of disease and degree of differentiation〔J〕.Int J Oral Maxillofac Surg,2008,37(4):379.
[12]Sudha VM,Hemavathy S.Role of bcl-2 oncoprotein in oral potentially malignant disorders and squamous cell carcinoma:an immunohistochemical study[J].Indian J Dent Res,2011,22(4):520.
