米非司酮抑制卵巢癌细胞紫杉醇耐药性产生的研究
2013-02-27叶连红李东红
史 欣 叶连红 李东红
本试验模拟卵巢癌细胞产生耐药的过程,以米非司酮作为逆转剂,在化疗的同时同步使用,探讨在冲击法的紫杉醇诱导下,米非司酮能否抑制或减慢卵巢癌耐药性的表达,并探讨其作用机制、机理。
1 材料与方法
1.1 材料
卵巢癌细胞系A2780、skov3:A2780购买于北京伯乐生命科学发展有限公司(细胞由上海生物化学与细胞生物学研究所保存);skov3购买于青岛医学院附属医院科研中心,分别置于37℃、相对湿度90%、含5%CO2的培养箱中,于含有10%小牛血清的DMEM、RPMI-1640培养基中培养。
1.2 试剂和药品
RPMI-1640及 DMEM购于 Gibco公司,紫杉醇Taxol(6 mg/ml)购自美国百时美施贵宝公司,米非司酮系浙江仙琚制药股份公司生产,罗丹明(Rh123)购买于Sigma公司,鼠抗人MDR1单克隆抗体系购买于Boster公司,SP免疫组化试剂盒系购于北京中山金桥生物技术公司。
1.3 实验方法
紫杉醇诱导A2780:取对数生长期的A2780,置于含有紫杉醇 (Taxol 0.2 μmol/ml)及10%小牛血清的DMEM完全培养液中1 h后,用磷酸盐缓冲液洗3遍,换不含有Taxol 10%小牛血清的DMEM完全培养液培养,直至细胞恢复对数生长,作为阳性对照;实验组置于含有0.2 μmol/ml紫杉醇10%小牛血清的 DMEM培养液中,然后加入 1 μm 、2.5 μm、10 μm 米非司酮(RU486)作用1 h,各组均进行30次诱导;A2780直接传代,以不加用紫杉醇诱导耐药的作为阴性对照。
紫杉醇诱导skov3:同样取对数生长期的skov3细胞,应用含有1.5 μmol/ml紫杉醇 (Taxol)10%小牛血清的RPMI-1640完全培养液作用1 h,用磷酸盐缓冲液洗3遍,然后换用不含有Taxol的10%小牛血清的RPMI-1640完全培养液培养,至细胞恢复对数生长,作为阳性对照;实验组分别置于1.5 μmol/ml紫杉醇的10%小牛血清的RPMI-1640完全培养液中,然后加入 1 μM、2.5 μM、10 μM 的米非司酮 (RU486),同样作用1 h,各组均进行30次诱导;同时以skov3直接传代后不加紫杉醇的作为阴性对照。
细胞形态观察及绘制生长曲线:取对数生长期各组细胞,接种于24孔培养板中,细胞取5 000个/孔,放置于37℃、相对湿度90%、含5%CO2的培养箱中,待细胞贴壁生长后,每天取其中3孔细胞进行细胞计数,连续观察8天,从而绘制各组细胞的生长曲线。
采用四甲基偶氮唑蓝(MTT)法检测各组细胞半数致死浓度即IC50值。应用流式细胞仪检测各组细胞P-gp外排功能。
SP染色:应用3%H2O2孵育已制好的细胞爬片10 min,封闭后依次滴加鼠抗人MDR1单克隆抗体(1∶50),DAB显色,复染,脱水,封片,最后观察P-gp表达情况。
Western Blotting法:取对数生长期的各组细胞,用蛋白裂解液裂解细胞,检测P-gp浓度后,以1∶4的比例加上样缓冲液,沸水水浴5 min。采用SDS-多聚丙烯酰胺凝胶电泳法,PVC膜转膜,以鼠抗人MDR1单克隆抗体作为一抗,4℃孵育过夜,PBST 3次洗膜后加入二抗孵育2 h。重复上述PBST洗膜方法于暗室发光显带。实验重复3次。
1.4 统计学分析
应用SPSS统计软件进行数据处理及统计分析。
2 结果
2.1 各组细胞诱导后的形态观察
A2780细胞诱导前细胞生长良好,形态规则,透亮度好,贴壁生长后伸展成梭形。紫杉醇药物诱导后,细胞变小,贴壁后细胞两尖端变长,细胞有呈团簇状生长的趋势。加用米非司酮的各组细胞也呈现出上述特点,作用过程中米非司酮浓度高组细胞坏死情况越明显,其恢复对数生长期的时间越长。skov3传代及其实验诱导耐药的各组细胞均为贴壁生长,于光镜下观察,skov3边界清晰,细胞呈梭状,上皮样生长,细胞折光性好。经紫杉醇诱导后,大部分细胞发生坏死及凋亡,存活细胞的形态发生明显变化,细胞变长、形态不规则,大小不一,边界模糊。诱导过程中形态发生明显变化,呈不规则状,突起增多,胞质出现空泡,细胞间隙较大。细胞畸形核多见,多伸出许多伪足,细胞质颗粒明显增多。胞质内则常有颗粒状囊泡,突起增多。至恢复对数生长期时,细胞的形态又慢慢恢复。加米非司酮的各组细胞也呈现出上述特点,作用过程中米非司酮浓度高组细胞坏死情况越明显,其恢复对数生长期的时间越长。
2.2 各组生长曲线
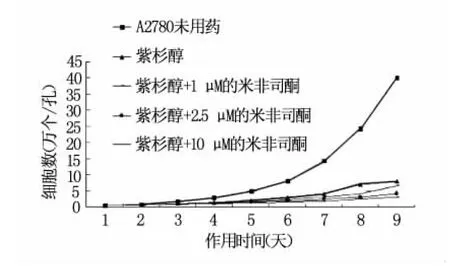
图1 紫杉醇作用A2780后各组生长曲线

图2 紫杉醇作用skov3后各组生长曲线
由图1、图2可见,紫杉醇诱导体外卵巢癌细胞系(A2780、skov3),可以使细胞亚克隆的筛选倾向于生长周期长或分裂增殖相对不旺盛的亚群。加入米非司酮可以使这种筛选的倾向性更加明显,米非司酮的浓度越高,筛选出的亚克隆生长越不活跃。
2.3 各组细胞紫杉醇24 h的半数致死浓度(IC50值)
A2780原代细胞 IC50:(0.061 ±0.002) μmol/ml;紫杉醇 +10 μM RU486 组 IC50:(0.082 ±0.003)μmol/ml;紫杉醇 +2.5 μM RU486 组 IC50:(0.096 ±0.004) μmol/ml;紫杉醇 +1 μM RU486 组 IC50:(0.110 ±0.003) μmol/ml;紫杉醇组 IC50:(0.127 ±0.008) μmol/ml。因此,应用 0.2 μmol/ml紫杉醇诱导30次后:各组A2780细胞对紫杉醇的耐药性明显提高,各组与原代A2780细胞对紫杉醇的耐药性比较有显著性差异(P<0.05)。使用米非司酮的各组与不使用的阳性对照组对紫杉醇耐药性比较也有显著性差异(P<0.05)。不同浓度米非司酮实验组间对紫杉醇的耐药性存在差异,而且呈一定量效关系,应用高浓度米非司酮的实验组耐药性产生较慢,即能相对地保持对紫杉醇的敏感性。
skov3原代细胞 IC50:(0.020±0.002) μmol/ml;紫杉醇 +10 μM RU486 组 IC50:(0.151 ± 0.011)μmol/ml;紫杉醇+2.5μM RU486 组 IC50:(0.237 ±0.027) μmol/ml;紫杉醇 +1 μM RU486 组IC50:(0.442 ±0.018) μmol/ml,紫杉醇组 IC50:(0.512±0.023) μmol/ml。因此,使用紫杉醇(Taxol)1.5 μmol/ml诱导skov3 30次后:各组skov3细胞对于紫杉醇的耐药性明显提高,各组与原代skov3细胞对紫杉醇的耐药性比较有显著性差异(P<0.05)。米非司酮各组与不使用的阳性对照组对紫杉醇的耐药性比较也有显著性差异(P<0.05)。3组使用不同浓度米非司酮的实验组间对紫杉醇的耐药性存在差异,而且有一定量效关系,应用高浓度米非司酮的实验组其耐药性产生较慢,即能相对地保持对紫杉醇的敏感性(P<0.05)。
2.4 流式细胞仪检测荧光强度
A2780组中A2780原代细胞荧光强度为(98.1±1.3);紫杉醇 +10 μM RU486 组为(82.4 ±2.1);紫杉醇 +2.5 μM RU486 组为(72.7 ±3.2);紫杉醇 +1 μM RU486 组为(54.2 ±2.9);单用紫杉醇组为(46.6±2.1)。skov3组中skov3原代细胞荧光强度为(93.6±2.3);紫杉醇 +10 μM RU486 组为(78.8 ±1.8);紫杉醇 +2.5 μM RU486 组为(63.3 ±4.5);紫杉醇 +1 μM RU486 组为(34.7 ±3.9),单用紫杉醇组为(18.2±2.7)。因此,加入不同浓度米非司酮的诱导耐药组与单纯使用紫杉醇组荧光强度比较有显著性差异(P<0.05)。由此表明,不同浓度的米非司酮可以不同程度地增加罗丹明在A2780、skov3两组细胞内的蓄积。
2.5 免疫组化SP染色结果
P-gp在A2780、skov3原代细胞中均无表达;而在使用不同浓度米非司酮的各组细胞中均呈阳性表达;在单用紫杉醇诱导的A2780、skov3细胞中呈强阳性表达。
2.6 Western Blotting法检测P-gp蛋白定量
经过紫杉醇的诱导后,加入不同剂量的米非司酮组均呈现P-gp表达,且有一定的量效关系,P-gp表达量与诱导同时加入米非司酮的浓度呈负相关,即米非司酮浓度越高则产生的P-gp量越少,见图3、图4,结果说明诱导耐药产生的同时加入米非司酮可减慢卵巢癌细胞耐药性的产生。

图3 应用紫杉醇后A2780各组P-gp含量
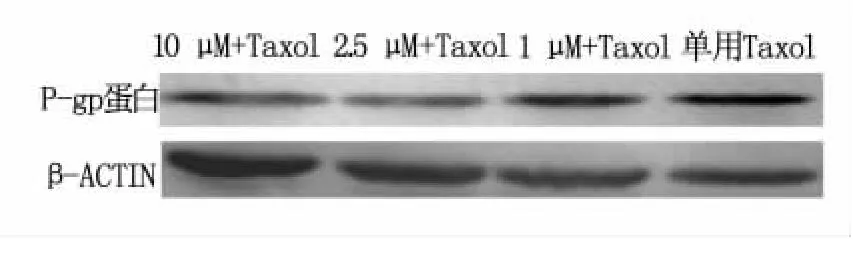
图4 应用紫杉醇后skov3各组P-gp含量
3 讨论
卵巢癌肿瘤细胞减灭术及术后化疗是目前治疗卵巢癌的主要方法,由于卵巢癌具有发现晚,手术不易彻底切除的特点,化疗在卵巢癌治疗中起了极为重要的作用[1]。但随着化疗疗程的增加,大部分化疗患者出现了耐药性,导致化疗失败,5年生存率无明显改善,这些年来,MDR基因及其表达物P糖蛋白介导的多重耐药是肿瘤细胞耐药研究的热点,MDR基因的表达与多种癌症细胞化疗耐药相关[2]。P糖蛋白介导的多重耐药是各类肿瘤细胞产生耐药的经典途径,是目前研究相对较为深入,同时机理较为清晰的途径。现发现许多肿瘤细胞的多重耐药的产生与MDR1基因扩增,进而使的MDR1 mRNA转录增加、P-gP产生及增多有关[3-4];同时,另一些耐药肿瘤细胞虽无MDR1基因扩增,但却有mRNA转录增加,最终使的P-gP表达增加[5],抑制 MDR 的表达可以抑制耐药性的产生[6]。同时,近年发现米非司酮等药物对妇科恶性肿瘤的治疗具有一定的潜力,作为逆转耐药的药物[7],至今尚未成功用于临床。因此,探讨对卵巢癌常用药物紫杉醇的耐药及逆转耐药的机理就成了提高患者生存期的关键。米非司酮对耐药的卵巢癌细胞有逆转耐药的作用,本实验旨在研究米非司酮如何抑制紫杉醇诱导卵巢癌细胞A2780、skov3的耐药性产生过程中所起的作用,是否有降低其耐药性产生速度的可能。
实验通过在紫杉醇诱导A2780、skov3产生耐药过程同时使用不同浓度的米非司酮产生出各不同浓度的米非司酮与紫杉醇诱导后的A2780、skov3细胞亚株,观察各细胞亚株P糖蛋白(P-gp)表达情况及各细胞亚株的P-gp的含量、检测其生长曲线、IC50;以罗丹明123(Rh123)作为荧光探针观察各细胞亚株胞内罗丹明含量来研究米非司酮如何抑制紫杉醇诱导卵巢癌细胞株A2780、skov3的耐药性的产生。结果显示:①A2780、skov3细胞诱导后细胞较诱导前变小,细胞有呈团簇状生长的趋势。加用米非司酮的各组细胞也呈现出上述变化的特点,但加入米非司酮浓度大者细胞坏死出现的越明显,其恢复对数生长期的时间越长。②两组生长曲线检测:使用紫杉醇冲击法诱导体外卵巢癌细胞系(A2780、skov3)可以使细胞亚克隆的筛选倾向于生长周期长或分裂增殖相对不旺盛的亚群。加入米非司酮的浓度越大,筛选出的亚克隆生长越不活跃。③通过对半数致死浓度(IC50值)的测定,使用紫杉醇作为诱导剂后:首先各组细胞对于紫杉醇的耐药性明显提高,各组与原代A2780、skov3细胞对于紫杉醇的耐药性有显著性差异。其次,使用米非司酮的各组与不使用的阳性对照组对于紫杉醇的耐药性也有显著性差异。最后3组实验组对紫杉醇的耐药性存在差异,而且有一定的量效关系,使用高浓度米非司酮的实验组耐药性产生的较慢即能相对的保持对紫杉醇的敏感性。A2780、skov3两组细胞表现出类似的实验结果,说明化疗同时使用非司酮能保持对卵巢癌细胞对紫杉醇的敏感性。④应用流式细胞仪检测P-gp功能,罗丹明荧光强度说明在加入了不同浓度米非司酮后,在模拟临床化疗,诱导产生耐药的过程中,米非司酮可以增加罗丹明在A2780、skov3两组细胞内的蓄积,并与其用量相关。这使得我们从功能上了解了米非司酮抑制耐药性的可能机理应该与减低细胞非特异性外排的机能高度相关。⑤免疫组化及Western Blotting结果显示,使用紫杉醇诱导A2780组呈现出与紫杉醇诱导skov3组相似的结果,经过紫杉醇的诱导后,加入不同剂量的米非司酮均有P-gp表达出现,且有一定的量效关系,P-gp表达量与诱导同时加入米非司酮的量呈负相关,即加入剂量越大的米非司酮则产生的P-gp越少,这从机理上验证了由前面MTT实验结果得出的、在诱导耐药产生的同时加入米非司酮,减慢了卵巢癌细胞的耐药性的产生。
米非司酮对人耐药卵巢癌细胞的增殖有一定的抑制作用,而且随着药物浓度的增加,抑制作用增强。米非司酮抑制耐药性表现应该与减低细胞非特异性外排的机能有关,其对卵巢癌的治疗具有进一步的临床研究价值。
[1]Lubin J,Markowska A,Knapp P.Factors affecting response of chemotherapy in women with ovarian cancer〔J〕.Eur Gynaecol Oncol,2012,33(6):644.
[2]谢红旗,徐显辉,柯明耀,等.多药耐药相关蛋白基因在肺癌组织中的表达及意义〔J〕.实用癌症杂志,2010,25(2):152.
[3]Januchowski R,Wojtowicz K,Sujka-Kordowska P,et al.MDR gene expression analysis of six drug-resistant ovarian cancer cell lines〔J〕.Biomed Res Int,2013,2013:241763.
[4]Sedláková I,Laco J,Tošner J,et al.Proteins of resistance and drug resistance in ovarian carcinoma patients〔J〕.Klin Onkol,2012,25(6):457.
[5]Ding S,Chamberlain M,McLaren A,et al.Related Articles,Links Cross-talk between signalling pathways and the multidrug resistant protein MDR-1〔J〕.Cancer,2008,85(8):1175.
[6]Zhang H,Wang J,Cai K,et al.Downregulation of gene MDR1 by shRNA to reverse multidrug-resistance of ovarian cancer A2780 cells〔J〕.Cancer Res Ther,2012,8(2):226.
[7]Qiu J,Fu YF,Cheng Q,et al.Reversing paclitaxel-resistance of skov3-TR30 cell line by curcumin〔J〕.Zhonghua Yi Xue Za Zhi,2012,92(27):1926.
