初诊2型糖尿病患者血清中miR-29a和miR-375表达变化及其与糖、脂标志物相关性研究
2013-02-24梁国威邵冬华何美琳
梁国威,宋 燕,邵冬华,徐 旭,何美琳
(航天中心医院 检验科,北京 100049)
MicroRNA(miRNA)是一组由19-24个核苷酸组成,含有茎环结构,非编码蛋白质的小分子RNA,其主要通过与靶mRNA的3’端非编码区完全或不完全的碱基互补结合,在蛋白质翻译水平上进行调控[1-2]。目前,大量的研究显示 miRNA在心血管、感染、肿瘤以及糖尿病等疾病过程中呈现特异性的表达并起到重要作用[3-4]。
目前,在2型糖尿病(DM)患者循环血液中miRNA的变化情况已有文献报道。Zampetaki A等[5]通过基因芯片扫描和荧光定量PCR检测确证,在DM患者血循环中有13个miRNA表达异常,其中 miR-15a、miR-29b、miR-126、miR-223表达下调和miR-28-3p表达上调在2型糖尿病早期即可发生。Kong L等[6]通过文献检索选择7个miRNA,并进一步检测了它们在DM前期和新发DM患者血清中的表达水平,结果显示,miR-9、miR-29a、miR-34a、miR-146a、miR-375在新发DM患者中表达皆显著高于健康对照和糖尿病前期组。但在DM患者中,疾病相关miRNA表达变化和糖、脂标志物的相关性研究国内外未见研究报道。本研究经文献检索选择miR-375和miR-29a作为标志物,通过检测其血清中表达情况,探讨上述2个标志在初诊DM患者中表达差异,及其变化与糖、脂标志物的相关性。
1 材料与方法
1.1 研究对象及分组 收集2011年12月-2012年3月我院资料完整的健康体检者者,并根据体检者自述排除既往已确诊的DM的体检者,按1999年WHO的DM诊断标准,所有研究对象均行75克葡萄糖(OGTT)实验,根据空腹血糖(FPG)和2 h血糖(2 hPG)将研究对象分为糖代谢正常组和DM组。具体标准为:健康对照组:FPG<6.1 mmol/L和2 h PG<7.8 mmol/L;DM 组:FPG ≧ 7.0 mmol/L和/或2hPG ≧11.1 mmol/L。通过筛查共分为2组,2型糖尿病患者组(DM组):48例,男27例,女21例,年龄35-72岁(平均54.9±9.8岁);健康对照组:38例,男22例,女16例,年龄40-72岁(平均55.0±9.3岁)。
1.2 常规指标检测 (1)临床基本资料调查:由专人调查体检人员的身高、体重,并计算体重指数(BMI);血压测量方法为休息15min后坐位测量右上臂肱动脉收缩压(SBP)和舒张压(DBP),取3次测量平均值。(2)实验室检查:空腹10 h后,使用真空采血管(美国BD公司提供)抽取空腹及服糖后2 h肘静脉血,血液离体2 h内检测完毕。采用全自动生化分析仪(AU2700,Olympus,日本)测定甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、FPG 和2h PG,试剂由日本OLYMPUS公司配套提供。糖化血红蛋白(Hb A1c)采用高效液相色谱法(HLC-73G7,Tosoh,日本)测定。
1.3 血清miRNA提取 采用mir Vana PARIS RNA试剂盒(编号AM1556,ABI公司,美国),取6 h内空腹新鲜血清400μl,严格按照试剂盒说明操作,提取100μl总RNA,RNA提取后立即-80℃保存。
1.4 miRNA相对定量检测 (1)逆转录:采用Taqman microRNA逆转录试剂盒(编号4366596,ABI公司,美国),在Gene Amp 9700 PCR仪(ABI公司,美国)上进行逆转录。反应体系15μl,包括:提取总 RNA按1∶1稀释后取5μl,100 m M d NTPs 0.15μl,MultiScribe Reverse Transcriptase 1μl,10×Reverse Transcription Buffer 1.5μl,RNase Inhibitor 0.19μl,水4.16μl,逆转录引物3 μl。反应条件为:16℃30 min,42℃30 min,85℃5 min,4℃ ∞,逆转录产物(c DNA)立即进行实时荧光定量PCR检测。(2)实时荧光定量PCR检测:采用7500 Real Time PCR System(ABI公司,美国),每个cDNA样本同时检测3次,循环阈值(Ct值)取3次平均值。反应体系20μl,包括:cDNA按1∶1稀释后取5μl,Taq Man Universal Master Mix II(ABI公司,美国)10μl,水4μl,引物及探针1μl。循环条件为:95℃10 min;95℃15 s,60℃1 min,40个循环。逆转录和荧光实时定量PCR检测所用引物和探针由美国ABI公司提供,编号分别是:RNU6B:001093;hsa-miR-375:000564;hsa-miR-29a:002112。
1.5 统计学处理 由于RNU6B(非编码小RNA)作为内参基因被广泛应用于miRNA研究之中[6],本研究选择RNU6B作为内参基因。miR-29a和miR-375相对表达量以 △Ct表示,△Ct为目的基因Ct值与RNU6B Ct值的差值。采用SPSS10.0统计软件,计量资料采用±s表示,其中不符合正态分布者以中位数(25%,75%)表示,并取自然对数后进行组间比较。计量资料组间比较采用独立样本T检验,计数资料采用卡方检验。相关性检验采用Pearson相关分析。以P<0.05做为差别有显著性的标准。
2 结果
2.1 研究对象的基本资料
DM组和对照组的FPG分别为5.1±0.5 mmol/L和8.8±1.55.1 mmol/L、2hPG 分别是6.7±0.5 mmol/L和15.4±4.3 mmol/L,Hb A1c是5.6±0.3%和8.4±1.5%,DM 组均显著高于对照组(P<0.001)。与对照组比较,DM 组的BMI、SBP、DBP、TG、HDL-C 显 著 高 于 对 照 组 (P<0.05)。对照组和DM 组间的性别、年龄、TC、LDLC无显著性差异(P>0.05)。

表1 研究对象的基本资料
2.2 外周血中 miR-29a、miR-375的ΔCt值变化情况
miR-29a在对照组和DM组血清中ΔCt值分别是-9.15±1.29和10.2±1.45,DM 组血清中miR-29a表达量显著高于对照组(P=0.001);miR-375在对照组和DM组血清中ΔCt值分别是-5.76±1.1.67和-7.18±1.93,DM 组中的 miR-375表达量显著高于对照组(P=0.001)。
用对照组和DM组外周血中的△Ct平均值计算差值(△△Ct值),miR-29a的△△Ct值为1.05,计算2△△ct=2.07,即DM患者外周血中miR-29a表达量约为正常人的2.07倍,同理,miR-375的△△Ct值为1.42,DM患者外周血中miR-375表达量约为正常人的2.68倍。
2.3 血清中 miR-29a、miR-375的 ΔCt值与糖、脂检测指标相关性分析
所有研究对象(n=86例)中的相关分析显示,miR-29a的ΔCt值与TG、TC、HDL-C、LDL-C皆无显著相关性(P>0.05),与FPG(r=-0.422,P<0.001)、2hPG(r=-0.417,P<0.001)和 Hb A1c(r=-0.548,P<0.001)显著负相关,显示随FPG、2hPG和Hb A1c升高血清中miR-29a的表达量显著增加;miR-375的 ΔCt值与 TG、TC、HDL-C、LDL-C也皆无显著相关性(P>0.05),与FPG(r=-0.400,P<0.001)、2hPG(r= -0.464,P<0.001)和 Hb A1c(r=-0.588,P<0.001)也显著负相关,显示随FPG、2h PG和 Hb A1c升高血清中miR-375的表达量也显著增加。见表2。
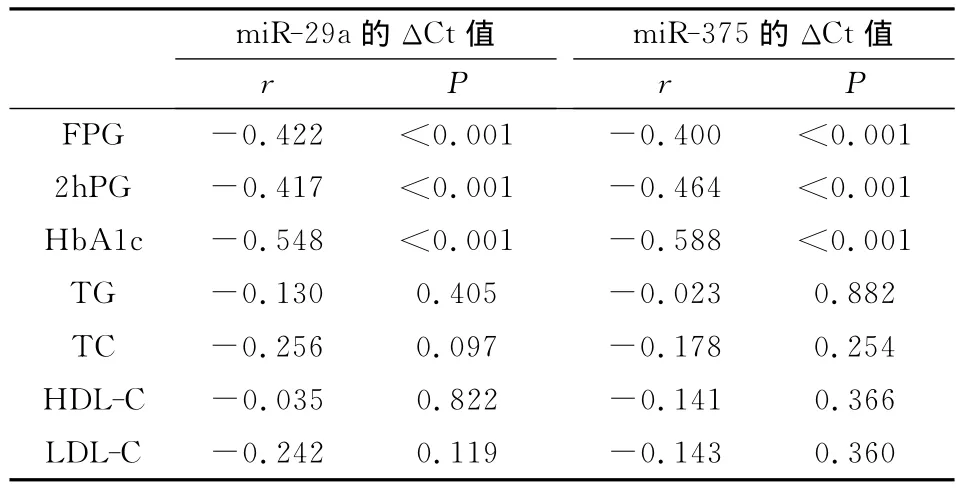
表2 miR-29a、miR-375的ΔCt值与糖、脂检测指标相关性分析
2.4 miR-29a和miR-375的ΔCt值相关性分析
所有研究对象(n=86例)中的相关分析显示,miR-29a和 miR-375的 ΔCt值的相关系数r=0.828,P<0.001,显示 miR-29a和 miR-375在 DM患者血清中表达量具有显著正相关性。
3 讨论
胰岛素抵抗和胰岛β细胞功能障碍是2型糖尿病发病的两大机制。本研究选择在初诊2型糖尿病患者血清中检测miR-29a和miR-375,是由于大量基础研究皆显示miR-29a和miR-375与胰岛β细胞分化、胰岛素表达和分泌,以及血糖水平变化和胰岛素抵抗等2型糖尿病的发生、发展的关键因素具有显著关系。
研究显示,miR-29a在血糖刺激的胰岛素分泌和胰岛素抵抗中起重要作用。He A[7]等人的研究标明,在糖尿病小鼠的骨骼肌、脂肪组织和肝脏中miR-29a表达明显上调。相反,在3T3-L1脂肪细胞中通过高表达miR-29a可显著抑制胰岛素刺激的血糖吸收,导致胰岛素抵抗的发生。最新研究显示,血糖水平变化可显著上调人和鼠的胰岛β细胞中miR-29a表达,而miR-29a表达上调可显著降低血糖刺激的胰岛素分泌。由于下调miR-29a表达可显著提高胰岛β细胞的分泌功能,提示miR-29a表达上调在糖代谢紊乱至糖尿病的发展过程起重要作用[8]。
miR-375在胰岛β细胞分化和胰岛素分泌中起重要作用。在miR-375基因敲除的小鼠模型中[9],胰岛β细胞分化受损而减少,出现高血糖症,胰腺α细胞生成增加,糖异生和肝糖输出增加,提示miR-375在维持血糖稳态、胰岛α和β细胞生长,以及由胰岛素抵抗所致胰岛β细胞分化方面具有中重要作用。进一步研究标明[10],在胰岛β细胞中高表达的miR-375可能通过作用于肌侵蛋白(Myotrophin)抑制血糖诱导的胰岛素分泌。相反,抑制miR-375表达可加强胰岛素分泌,显示miR-375对胰岛素的分泌有负性调节作用。而El Ouaamari A等[11]研究显示,miR-375可直接抑制3′-磷酸肌醇依赖性蛋白激酶1(PDK1)的翻译,降低血糖刺激的胰岛素基因表达和合成,高血糖则可升高PDK1蛋白表达并同时降低miR-375表达。
尽管在组织和器官中 miR-29a和miR-375与糖代谢相关因素关系的研究已有大量文献报道,由于认识上的局限性,2008年才首次发表了血清中存在大量的 miRNA[12-13]。目前,血清中 miR-29a和miR-375表达变化与糖尿病的相互关系研究报道较少。Kong L等[6]在血清中的研究显示,与健康对照组和糖尿病前期组比较,在新诊断的2型糖尿病患者血清中 miR-29a和 miR-375表达皆显著上调。我们的研究除证实2型糖尿病患者血清中miR-29a和 miR-375皆表达上调外,miR-29a和 miR-375表达量的变化与空腹血糖、OGTT 2h血糖和Hb A1c具有显著的正相关性,提示miR-29a和miR-375在血清中表达变化有可能作为诊断2型糖尿病的分子标志物,或从治疗的角度作为2型糖尿病患者治疗新的分子靶点。
尽管有基础研究显示,miR-375可在脂肪细胞分化过程中起重要作用[14]。本研究显示,血清中miR-375表达量的变化与 TG、TC、HDL-C、LDL-C皆无显著相关性。尽管有文献报道高血糖可刺激脂肪细胞中 miR-29a的高表达[15],但 miR-29a与脂肪细胞分化、脂肪代谢的相关性未见文献报道。本研究也证实血清miR-29a表达量与血脂各指标无显著相关性。
由于每个miRNA可以有多个靶基因,而几个miRNAs也可以调节同一个基因。这种复杂的调节网络既可以通过一个miRNA来调控多个基因的表达,也可以通过几个miRNAs的组合来精细调控某个基因的表达[1,2]。我们研究结果显示血清中miR-29a和miR-375表达量的变化具有显著正相关性,提示miR-29a和miR-375在2型糖尿病的发生、发展中可能具有协同调控作用,其作用机理有待于进一步研究。
综上所述,本研究证实DM患者血清中的miR-29a和miR-375表达量皆显著高于对照组。血清中miR-29a和 miR-375表达量的变化与空腹血糖、OGTT 2h血糖和Hb A1c呈显著正相关,提示miR-29a和miR-375在血清中表达变化有可能作为诊断2型糖尿病的分子标志物。而血清中miR-29a和miR-375表达量的变化具有显著正相关性提示miR-29a和miR-375在2型糖尿病的发生、发展中可能具有协同调控作用。
[1]Bartel DP.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215.
[2]Pillai RS,Bhattacharyya SN,Filipowicz W.Repression of protein synthesis by miRNAs:how many mechanisms[J].Trends Cell Biol,2007,17(3):118.
[3]Urbich C,Kuehbacher A,Dimmeler S.Role of microRNAs in vascular diseases,inflammation,and angiogenesis[J].Cardiovasc Res,2008,79(4):581.
[4]Kumar M,Nath S,Prasad HK,et al.MicroRNAs:a new ray of hope for diabetes mellitus[J].Protein Cell,2012,3(10):726.
[5]Zampetaki A,Kiechl S,Drozdov I,et al.Plasma microRNA profiling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes[J].Circ Res,2010,107(6):810.
[6]Kong L,Zhu J,Han W,et al.Significance of serum microRNAs in pre-diabetes and newly diagnosed type 2 diabetes:a clinical study[J].Acta Diabetol,2011,48(1):61.
[7]He A,Zhu L,Gupta N,et al.Overexpression of micro ribonucleic acid 29,highly up-regulated in diabetic rats,leads to insulin resistance in 3T3-L1 adipocytes[J].Mol Endocrinol,2007,21(11):2785.
[8]Bagge A,Clausen TR,Larsen S,et al.MicroRNA-29a is up-regulated in beta-cells by glucose and decreases glucose-stimulated insulin secretion[J].Biochem Biophys Res Commun,2012,426(2):266.
[9]Poy MN,Hausser J,Trajkovski M,et al.miR-375 maintains normal pancreatic alpha-and beta-cell mass[J].Proc Natl Acad Sci U S A,2009,106(14):5813.
[10]Poy MN,Eliasson L,Krutzfeldt J,et al.A pancreatic islet-specific microRNA regulates insulin secretion[J].Nature,2004,432(7014):226.
[11]El Ouaamari A,Baroukh N,Martens GA,et al.miR-375 targets 3'-phosphoinositide-dependent protein kinase-1 and regulates glucose-induced biological responses in pancreatic beta-cells[J].Diabetes,2008,57(10):2708.
[12]Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:A novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18:997.
[13]Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci USA,2008,105:10513.
[14]Ling HY,Wen GB,Feng SD,et al.MicroRNA-375 promotes 3T3-L1 adipocyte differentiation through modulation of extracellular signal-regulated kinase signalling[J].Clin Exp Pharmacol Physiol,2011 ,38(4):239.
[15]Herrera BM,Lockstone HE,Taylor JM,et al.Global microRNA expression profiles in insulin target tissues in a spontaneous rat model of type 2 diabetes[J].Diabetologia,2010,53(6):1099.
