多次小剂量STZ处理建立糖尿病大鼠模型及EGF与Gastrin联合应用对胰岛素分泌的影响
2013-02-24孟召祥张俊辉刘静秋倪劲松
孟召祥,高 静,张俊辉,刘静秋,杨 丽,倪劲松*
(1.吉林省人口生命科学技术研究院,吉林 长春 130041;2.吉林大学第一医院 病理科,吉林 长春 130021;3.吉林大学人兽共患病教育部重点实验室 人兽共患病研究所,长春 130062;4.吉林省产品质量监督检验院)
2型糖尿病患者早期具有胰岛素抵抗和胰岛素分泌缺陷的双重因素,但不少患者在疾病晚期也出现胰岛素分泌严重不足,需要外源性胰岛素治疗。糖尿病患者不但遭受胰岛素注射所带来的不便和痛苦,而且不能完全控制血糖稳定并避免远期并发症的发生。EGF与Gastrin联合应用可增加STZ诱导的糖尿病大鼠胰岛中的β细胞数量,降低血糖[1],并能使四氧嘧啶诱导的糖尿病小鼠的血糖恢复正常[2]。Wilma L等发现EGF与Gastrin短期应用即可使自发性糖尿病NOD鼠的胰岛细胞群数量增多,并且逆转NOD鼠的高血糖状态[3]。本文采用小剂量STZ多次诱导糖尿病大鼠模型,通过免疫荧光和生化检测技术,分析EGF与Gastrin联合应用对糖尿病大鼠模型胰腺功能的影响。
1 材料和方法
1.1 糖尿病模型动物制备
清洁级健康 Wistar雄性大鼠48只,体重180 g-220 g,由本校基础医学院实验动物中心提供(中心许可证号:SCXK吉2003-001)。大鼠随机分为两组,其中实验组35只,对照组13只。实验组大鼠按照35 mg·Kg-1腹腔注射STZ-枸橼酸钠缓冲液,每周1次,连续4周。对照组大鼠给予p H4.0枸橼酸钠缓冲液腹腔注射,鼠尾采血测试血糖,以最后一次检测血糖值≥11.1 mmol·L-1和尿糖≥ +++为成模标准。计算大鼠成模率及存活率,评估造模效果。
1.2 实验分组
将29只实验组成模大鼠随机分为三组,即:Insulin治疗组10只,EGF/Gastrin联合治疗组10只及DM对照组9只,另设正常对照组大鼠10只。EGF/Gastrin组给予 EGF(1μg·Kg-1)/Gastrin(3μg·Kg-1),每日1次皮下注射,连续14日;Insulin组给予长效胰岛素2 U/d,连续14日;DM对照组及正常对照组给予p H8.0 Tris-cl缓冲液。
1.3 实验检测指标
(1)大鼠一般情况:给药期间观察大鼠饮水量、尿量、体重变化及一般状态。
(2)空腹血糖值:所有动物处死前禁食不禁水8 h,鼠尾静脉采血检测空腹血糖值。
(3)血清胰岛素及C肽含量:实验动物麻醉后腹主静脉取血,离心后分离上层血清,放射免疫法检测大鼠血清胰岛素及C肽含量,评估胰岛功能。
(4)胰岛中Insulin阳性表达细胞的变化
各组大鼠处死后,取胰腺于10%中性福尔马林固定,石蜡包埋切片。免疫荧光染色检测Insulin表达情况。激光共聚焦显微镜观察并采集图像,分析不同实验组大鼠胰腺Insulin阳性细胞数量及荧光强度的变化,评估胰岛功能及损伤恢复情况。
1.4 统计学处理
所有实验数据用SPSS17.0统计软件进行处理,计量数据以±s表示,各组间数据根据比较对象不同分别采用方差分析,q检验。P<0.05认为有统计学意义。
2 结果
2.1 大鼠糖尿病模型的建立
实验组大鼠注射STZ1周后,少数出现多尿现象,4周后表现尿量明显增加,并出现多饮多食。实验组大鼠没有出现死亡。每周体重检测结果显示实验组大鼠体重相对于正常对照组大鼠体重上升趋势减缓。4次注射STZ后24 h,禁食8 h鼠尾采血法检测大鼠空腹血糖值。35只实验组大鼠中有33只血糖值≥11.1 mmol·L-1,占总数的94%。33只达到成模标准的实验组大鼠的平均血糖值为15.6±3.01 mmol·L-1,较正常对照组显著增高,见表1(P<0.05)。腹腔注射STZ4周,每周检测大鼠尿糖变化。第1、2、3、4周出现尿糖阳性3+及以上的累计数量分别为6只,12只,20只,32只。分别占总数的17%、34%、57%、91%。根据成模标准,选取空腹血糖值≥11.1 mmol·L-1同时尿糖阳性3+及以上的实验组大鼠为糖尿病模型大鼠,共32只,成模率为91%。

表1 实验大鼠血糖值变化
组织学结果观察发现,正常大鼠胰岛为椭圆形或圆形细胞团,数量较多,均匀分布于胰腺腺泡之间。镜下观察胰岛结构清晰,无淋巴细胞浸润。而成模大鼠的胰岛数量明显减少,分布不均匀并出现不同程度的萎缩,胰岛β细胞数量明显减少并出现空泡变性,胰岛空虚。胰岛内可见以淋巴细胞、单核细胞为主的炎性细胞浸润(图1)。Insulin免疫组织化学染色结果显示,成模大鼠胰岛内Insulin染色阳性的细胞明显减少;且残存胰岛β细胞Insulin染色强度低于正常对照组(图2),提示注射STZ后,胰岛出现明显的损伤,胰岛β细胞被破坏、减少,残存的β细胞Insulin合成功能下降。

图1 HE染色检测胰岛破环情况
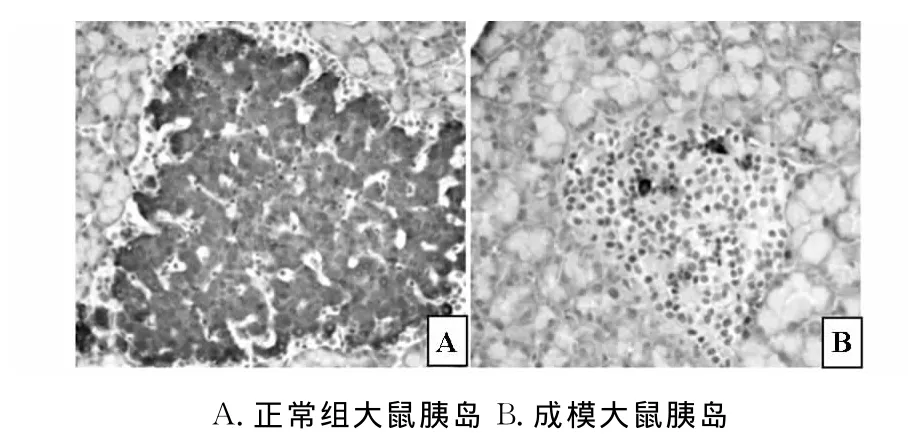
图2 免疫组织化学染色检测Insulin表达
2.2 EGF与Gastrin联合应用对糖尿病大鼠模型胰腺功能的影响
连续14天外源性胰岛素治疗后,间隔12小时鼠尾静脉采血测量空腹血糖值。结果显示10只Insulin组大鼠中有8只血糖值低于11.1 mmol·L-1,其中6只低于7.8 mmol·L-1,平均血糖值为8.0±4.38 mmol·L-1。EGF/Gastrin组大鼠中6只血糖值低于11.1 mmol·L-1,其中5只低于7.8 mmol·L-1,平均血糖值为11.2±6.43 mmol·L-1。DM组大鼠的血糖值随着时间的推移变化较大。最高值为26.1 mmol·L-1,平均值为20.3±3.78 mmol·L-1。Insulin组大鼠血糖值同DM 组相比显著降低(P<0.05)。EGF/Gastrin组大鼠血糖值同DM组相比显著降低(P<0.05),但仍高于正常对照组与Insulin组(表2)。

表2 实验大鼠4次STZ注射前后空腹血糖值变化
2.3 血清胰岛素含量及C肽含量变化
各组大鼠腹主静脉取血,离心分离血清,放射免疫法检测血清胰岛素含量及C肽含量。统计结果显示,DM组中血清胰岛素及C肽含量显著低于正常对照组(P<0.05),而Insulin组及EGF/Gastrin组均显著高于DM组(P<0.05)。说明Insulin及EGF/Gastrin联合应用均能促进糖尿病大鼠胰岛素的分泌(表3)。

表3 血清中胰岛素及C肽含量
2.4 胰岛β细胞Insulin表达变化
各组大鼠胰腺组织经10%中性福尔马林固定、石蜡包埋、切片后,采用免疫荧光染色法检测Insulin表达情况。结果显示在正常大鼠胰岛中,Insulin阳性细胞分布均匀;DM组大鼠胰岛中仅有少数几个残存的β细胞表达Insulin,且表达强度明显低于正常对照组,与DM组比较,Insulin组及EGF/Gastrin组大鼠胰岛中Insulin表达细胞明显增多,有部分细胞呈强阳性表达(图3)。

图3 免疫荧光染色检测不同实验组中Insulin表达情况
3 讨论
传统的糖尿病模型复制方法,一般采用一次性大剂量注射STZ(>60 mg/kg)诱导急性糖尿病的发生,注射72小时后血糖可稳定升高,动物出现三多一少的症状。但动物死亡率高,且STZ集中大量破坏β细胞,使糖尿病很快发生,短期内即达到糖尿病的临床症状期,与发生在自身免疫性胰岛炎基础上的糖尿病在病程及发病机制方面存在较大差异,即免疫因素参与发病的特点不能被该模型所模拟。目前,较多学者开始致力于多次小剂量注射STZ诱导糖尿病模型的研究。一般认为,小剂量STZ注射可破坏少量β细胞,死亡的β细胞作为抗原被巨噬细胞吞噬,产生TH1刺激因子(IL-12),使TH1细胞占优势而产生IL-2及氧自由基NO、H2O2等,杀伤少量β细胞,并诱导细胞凋亡,死亡细胞再次以自身抗原释放,并呈递给APC细胞进行处理,释放细胞因子,放大细胞的损伤效应,最终导致糖尿病的发生[4,5]。
在本实验中,采用35 mg·Kg-1STZ腹腔注射,每周1次,连续4周,诱导雄性Wistar大鼠糖尿病模型,并对模型建立后大鼠的一般状况、体重、血糖及尿糖等进行检测,对其死亡率进行统计进而评价造模效果。结果显示:首次注射STZ 1周后,少数大鼠出现多尿现象。4次注射后STZ诱导的糖尿病模型鼠表现出明显的糖尿病症状和病理改变。表现为饮水量、进食量及尿量明显增加,毛色失去光泽,鼠精神状态差,血糖、尿糖水平明显升高;病理学检测发现β细胞数量明显减少,呈现淋巴细胞浸润的胰岛炎改变。4次STZ注射后实验组大鼠没有出现死亡,每周体重检测结果显示实验组大鼠体重较对照组大鼠体重上升趋势减缓。第4次注射STZ后24小时,鼠尾静脉采血检测大鼠血糖,94%的大鼠血糖值≥11.1 mmol·L-1。而且血糖持续在较高水平为出现波动。每周检测大鼠尿糖变化,发现尿糖+++以上的鼠随注射STZ次数的增加而增多。这一现象说明单次给药时较难出现糖尿病的临床症状,可能因为此时β细胞破坏较少未达到失代偿水平,或者残存β细胞发生代偿而致糖尿病临床症状不明显。随着STZ累积剂量的增加,β细胞被大量破坏并释放自身抗原,不断强化自身免疫反应,破坏免疫抑制机制,最终导致稳定持久的糖尿病的发生。且本实验模型建立过程中无大鼠死亡,说明多次小剂量STZ注射可明显降低实验动物的死亡率,在动物模型存活方面占有明显优势。可见,小剂量多次注射STZ诱导的糖尿病模型可有效模拟人类糖尿病的发病机制及病程,并且动物成模率高、死亡率低,模型稳定。是糖尿病研究较理想的动物模型。
胚胎时期胰岛前体干细胞在多种生长因子的刺激下最终发育为成熟的β细胞;成体的胰腺组织在发生胰腺炎或胰腺损伤后,胰腺修复再生过程中同样出现表皮生长因子(EGF)等生长因子的表达增加。我们通过对血糖、血清胰岛素及C肽的检测发现,EGF/Gastrin治疗组大鼠的血糖明显低于糖尿病大鼠,但其仍然高于正常组大鼠。血清胰岛素和C肽水平显著高于糖尿病组大鼠。说明给予EGF/Gastrin联合治疗后大鼠的胰岛功能有所恢复并开始合成内源性胰岛素。
EGF/Gastrin联合治疗糖尿病的作用机制尚不明确。有人认为 给予EGF/Gastrin后可导致胰岛β细胞群增多,其分泌的胰岛素足以维持血糖的正常水平[6]。也有资料表明,发生了糖尿病的NOD鼠给予EGF/Gastrin短期治疗后即可导致β细胞数目的增多及胰岛素含量的增加,并能降低胰岛炎性反应,逆转高血糖状态,这些改变伴随着免疫调节细胞的参与[7-9]。因此认为,EGF/Gastrin联合应用在抑制自身免疫性β细胞破坏的同时可诱导β细胞再生。
[1]Fosgerau K,Jessen L,Lind Tolborg J.The novel GLP-1-gastrin dual agonist,ZP3022,increasesβ-cell mass and prevents diabetes in db/db mice[J].Diabetes Obes Metab,2013,15(1):62.
[2]Rooman L,Bouwens L.Combined gastrin and epidermal growth factor treatment induces islet regeneration and restores normoglycemia in C57B16/J mice treated with alloxan[J].Diabetologia,2004 ,47:259.
[3]Rooman,L.J.Lardon,D.Flamez,F.Schuit & L.Bouwens:Mitogenic effect of gastrin and of gastrin reoeptors in duct-like cells of rat pancreas[J].Gastroenterology,2001,121:940.
[4]Suarez-Pinzon W,Rajotte RV,Mosmann TR,et al.Both CD4+and CD8+T-cells in the syngenic islet in NOD mice produce interferon-gamma during beta-cell destruction[J].Diabetes,1996,45:1350.
[5]Zheng XX,Steele AW,Hancock WW,et al.A nomcutolytic IL10/Fc fusion protein prewents diabetes,blocks autoimmunity,and peomotes suppressor phenomena in NOD mice[J].Immunol,1997,158:4507.
[6]Wilma L.Suarez-Pinzon,Jonathan R.T.Lakey,et al.Combination Therapy with Epidermal Growth Factor and Gastrin Induces Neogenesis of Huaman Isletβ-Cells from Pancreatic Duct Cells and an Increase in Functionalβ-Cell Mass[J].Dlabetes,september 2005,54.
[7]Wilma L.Suarez-Pinzon,Yanhua Yan,et al.Combination Therapy With Epidermal Growth Factor and Gastrin Increasesβ-Cell Mass and Reverses Hyperglycemia in Diabetic NOD Mice[J].Diabetes,Vol.54,September 2005.
[8]Suarez-Pinzon WL,Lakey JR,Rabinovitch A.Combination therapy with glucagon-like peptide-1 and gastrin induces beta-cell neogenesis from pancreatic duct cells in human islets transplanted in immunodeficient diabetic mice[J].Cell Transplant,2008,17(6):631.
[9]Suarez-Pinzon WL,Rabinovitch A.Combination therapy with a dipeptidyl peptidase-4 inhibitor and a proton pump inhibitor inducesβ-cell neogenesis from adult human pancreatic duct cells implanted in immunodeficient mice[J].Cell Transplant,2011,20(9):1343.
