白桃成熟胚试管苗培养研究
2013-02-22汤燕姗赖钟雄
汤燕姗,赖钟雄
(福建农林大学 园艺植物生物工程研究所,福建 福州 350002)
白桃皮白、味浓、肉细、甜略有酸味,耐储运,可鲜食,亦可做桃罐头,深受广大消费者的欢迎。桃作为一种木本果树,传统育种周期长,易受自然灾害影响[1]。组织培养可以克服以上的这些缺点,为加快桃树的育种工作带来许多方便。胚培养是桃组培的主要方式之一[2-10],20 世纪40 年代起胚培养技术开始广泛应用于果树育种。目前,胚培养在克服桃远缘杂交育种胚的早期败育、胚挽救、砧木快繁等研究领域发挥着重要作用[11-13],而且借助于胚培养技术可以获得优良的特早熟品种[14]。目前桃转基因的困难还较大,主要原因在于高效稳定的再生体系还未完全建立(存在茎尖枯死等问题[15]),而利用成年材料(与母本一致的)做为外植体进行再生体系建立难度则更大,因此用胚做材料也是一种较为现实的选择。文献中关于桃离体培养的报道多以下胚轴、枝条、叶片,未成熟的胚,茎尖等为外植体进行研究为主[16-20],对桃成熟胚培养研究的报道较少。本试验对白桃成熟胚试管苗培养进行研究,以期为建立高频稳定的再生体系提供依据。
1 材料与方法
1.1 取材
以白桃成熟的种子为材料(2010 年6 月取自福建农林大学园艺学院果树实验基地)。
1.2 培养条件
光照强度 1 500 lx,光照时间 12 h/d,培养温度(25 ±2)℃,培养基 pH 值 5.8。
1.3 方法
1.3.1 白桃成熟胚无菌萌发 取白桃硬核期的种子,用体积分数为75%酒精(30 s)+1 g/LHgCl2(5 min)+无菌水(24 h)+1 g/LHgCl2(3 min)方法在超净工作台上对桃种子进行消毒,然后用无菌水冲洗5 次,去种皮后,接种于MS 培养基上,进行无菌萌发。
1.3.2 不同激素浓度对白桃试管苗增殖的影响 待胚萌发后将胚苗切成1.5 ~2.0 cm 的茎段,接到不同的增殖培养基上,30 d 后观察各组试管苗增殖情况。以MS 为基本培养基,附加蔗糖30.0 g/L+琼脂6 g/L,分别添加了 IBA、6 - BA 等 2 种激素,IBA 质量浓度分别为 0,0.2,0.4 mg/L,6 -BA 质量浓度分别为0,0.5,1.0 mg/L,进行二因素完全随机设计,组成 9 种组合。
1.3.3 不同因素对白桃试管苗生根的影响 当新梢生长得比较健壮时,就可以进行诱导生根。将试管苗切成1.5 ~2.0 cm 的茎段接到不同的生根培养基上,30 d 后观察各组试管苗生根的情况。考虑3 个因素:①基本培养基(MS、1/2MS、1/4MS)②IBA(0.0,0.3,0.5 mg/L)③NAA(0,0.2,0.4 mg/L),进行L9(34)正交试验。
1.4 数据的记录与统计
每种处理接15 瓶,每瓶接1 个(1 株),重复3 次。接种后每隔5 d 观察其增殖及生根情况。第30天统计数据,用DPS 软件进行分析。

2 结果与分析
2.1 白桃成熟胚无菌萌发
取白桃硬核期的种子,表面消毒后接种于MS 培养基上进行无菌萌发,30 d 后,萌发率达86.67%(图版 I-A)。
2.2 不同质量浓度激素对白桃试管苗增殖的影响
待胚萌发后接种在增殖培养基上试管苗顶芽或侧芽于在接种5 ~7 d 后开始萌动抽梢,10 d 后开始展叶,30 d 观察其增殖情况(表1)。从表1 中可以看出,以M3 培养基的的增殖效果最好,试管苗增殖系数最大,且试管苗的生长健壮,颜色深绿(图版I -B)。在培养过程中发现,当6 -BA 达1.0 mg/L时,虽然其增殖系数会比较大,但当IBA 质量浓度进一步上升时,植株的叶片比较短且比较容易畸形、卷曲(图版I-C),当6 -BA 为0.0 mg/L 时,基本上没有新芽分化的现象产生,说明6 -BA 在白桃试管苗的增殖培养中起到重要的作用。且当6 -BA 为0 mg/L,IBA 从0 mg/L 开始上升时,有部分试管苗基部产生愈伤且伴有生根现象的产生(图版I-D),并随着IBA 质量浓度的增大生根试管苗数也会随之增大,说明IBA 与白桃试管苗的生根有一定的关系。
为了进一步研究不同激素对试管苗增殖的影响,对桃增殖系数进行方差分析。从表2 中可以看出,6 -BA 对增殖系数的影响均达到了显著水平,而IBA 对增殖系数的影响不显著。因此,综上所述,白桃最适合的增殖培养基是MS+6 -BA1.0 mg/L+IBA 0 mg/L+蔗糖30 g/L+琼脂6 g/L。
2.3 不同因素对白桃试管苗生根的影响
从表3 中可以看出,试管苗在Y3 培养基上生根率最高,为82.22%。且根系生长状况良好,粗且长(图版I-E)。在Y7 培养基上,桃试管苗的生根系数最高(图版I-F),为5.96,但根较为粗短。随着IBA、NAA 质量浓度的不断提高,根基部会有愈伤产生。为了进一步分析各因素对试管苗生根的影响,对生根率、生根系数进行极差、方差分析,并对各处理间进行显著性检验。

表1 不同激素浓度对白桃增殖的影响Tab.1 Efiects of different concentrations of hormone on the mutiplication of the white peach
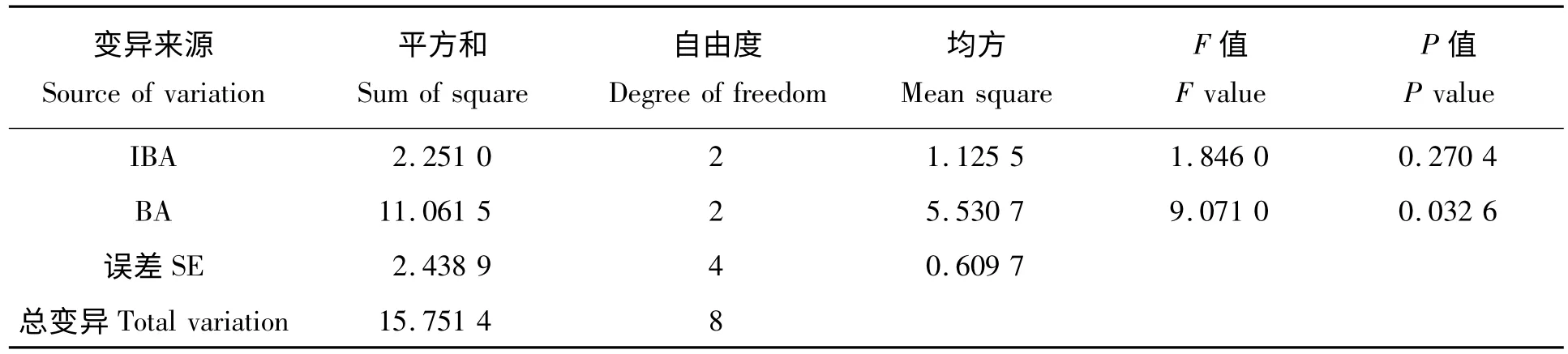
表2 不同因素对白桃增殖系数的方差分析Tab.2 The variance analysis of the effect of different factors on the mutiplication rate of the white peach

表3 不同因素对白桃试管苗生根的影响Tab.3 Efiects of different factors on the rooting of the white peach
从表4 中对各个因素进行极差分析中可以看出,基本培养基对桃试管苗生根率的影响最大,NAA次之,IBA 最小。表5 为不同因素对生根率的方差分析,从表中可以看出,各个因素对试管苗生根率的影响均达到了极显著的水平。F 值越大,该因素对试管苗生根率的影响也越大。从表5 中可以看出,对桃试管苗生根率影响的主次顺序分别为基本培养基>NAA >IBA,与极差分析的结果一致。表6 是对各处理进行显著性检测,处理3 与其它处理间有极显著的差异。综上所述,1/4 MS +IBA 0 mg/L +NAA 0.4 mg/L 为诱导生根的最佳培养基。
从表7 极差分析中可以看出,基本培养基对试管苗生根系数的影响最大,其次是IBA,NAA 最小。从表8 中各个因素对试管苗生根系数影响的方差分析也中可以看出,IBA 和基本培养基对桃试管苗生根系数的影响达到了极显著的水平,而NAA 对其影响未达到显著水平。通过F 检验可知对桃试管苗生根系数影响各因素的主次顺序分别为基本培养基>IBA >NAA。从表9 中可以看出,处理7 与其余各处理间的差异达到了显著水平。综上所述,1/2 MS +IBA 0.5 mg/L+NAA 0 mg/L,为诱导生根数的最佳培养基。
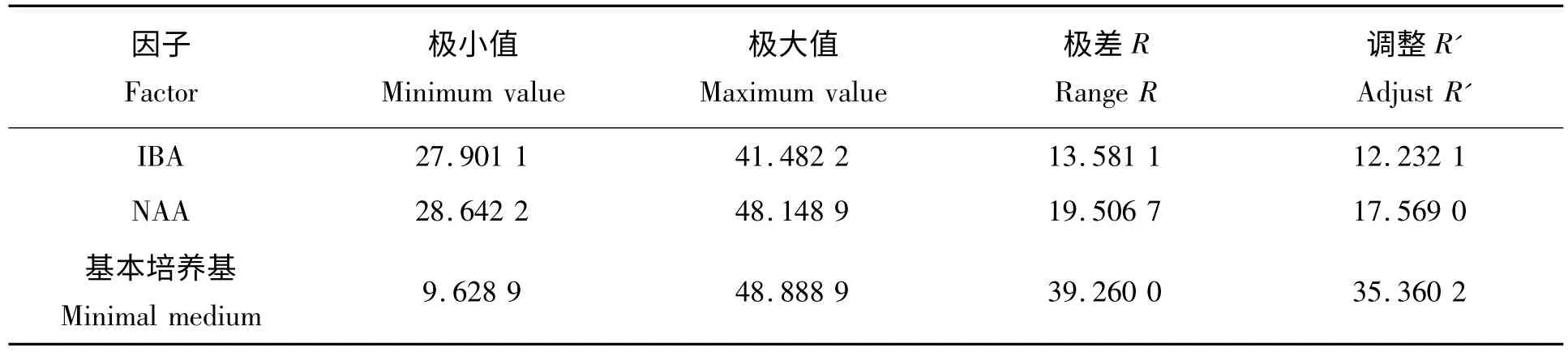
表4 不同因素对白桃试管苗生根率的极差分析Tab.4 The range analysts of the effects of different factors on the rooting rate of the white peach
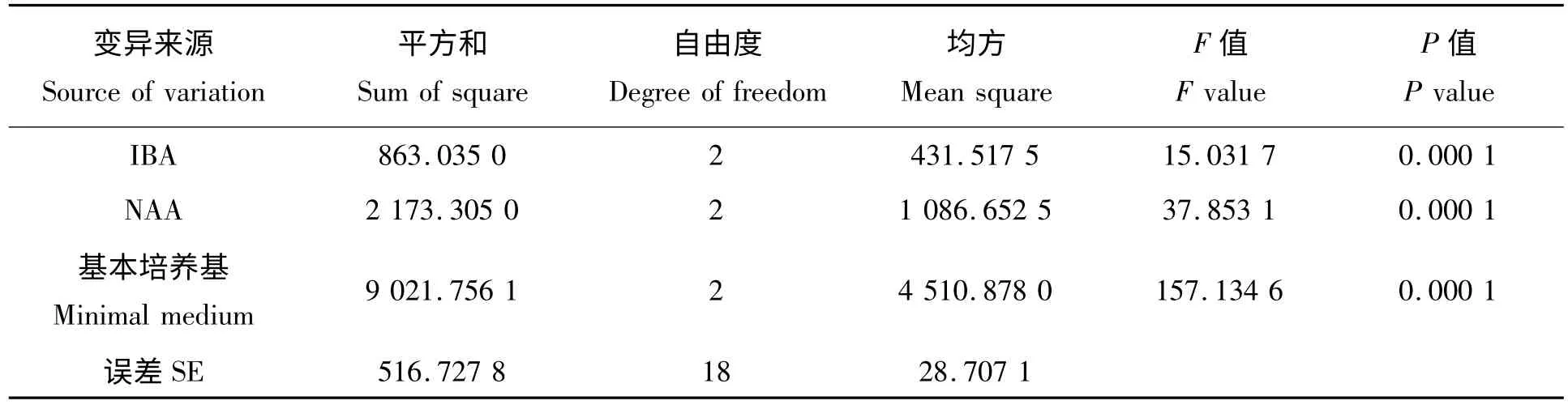
表5 不同因素对白桃试管苗生根率的方差分析Tab.5 The variance analysis of the effects of different factors on the rooting rate of the white peach

表6 各处理间对白桃试管苗生根率的显著性检验Tab.6 Significance level test of the effects of different treatments on the rooting rate of the white peach

表7 不同因素对白桃试管苗生根系数的极差分析Tab.7 The range analysts of the effects of different factors on the rooting number of the white peach

表8 不同因素对白桃试管苗生根系数的方差分析Tab.8 The variance analysis of the effects of different factors on the rooting number of the white peach

表9 各处理间对白桃试管苗生根系数的显著性检验Tab.9 Significance level test of the effects of different treatments on the rooting number of the white peach
3 讨 论
3.1 细胞分裂素是诱导白桃的增殖的主要因素
Fouad MM 等研究表明,含高质量浓度的6-BA 且不含 IBA 的培养基有利于腋芽分生组织生长[21]。在本试验也表明,当6-BA 质量浓度为1.0 mg/L,IBA 为 0 mg/L 时,白桃试管苗的增殖效果最好。且 6-BA 对白桃增殖的影响达到了显著的水平。当6-BA为0 mg/L 时,基本没有新芽的产生。本试验表明 MS + 6-BA1.0 mg/L+IBA 0 mg/L 为白桃最佳增殖培养基,但如果长期的继代容易发生玻璃化及畸形苗,而适当减少6-BA 的质量浓度可以在一定程度上减少玻璃化及畸形苗现象的产生。

图版I 白桃成熟胚培养与植株再生Fig.I Mature embryo culture and plant regenerate of white peach
3.2 培养基中的离子浓度及生长素浓度对白桃的生根有很大的影响
一般而言,试管苗生根均需要在低盐培养基中进行,这是由于盐浓度变化导致培养基渗透压变化,从而影响试管苗对营养吸收和向培养基中释放物质。而且盐浓度的变化也使植株体内氮浓度下降到一个适合生根的有利水平[22]。生长素也是影响生根的重要因子,但是诱导生根时生长素的浓度不宜过高。本试验也表明,基本培养基及IBA 对桃生根率及生根系数的影响均达到了极显著的水平。NAA 对桃生根率的影响也达到极显著的水平,但对生根系数的影响不显著。有研究表明添加IBA 后,无根苗生根整齐均匀,且随着IBA 的质量浓度增加,生根率和生根数呈增加趋势[23],但从本试验中看出,当IBA 的质量浓度适当降低时,反而有利于生根率的提高但是不利于生根数的提高。可能是由于不同基因型因素的影响。本实验表明,1/4 MS +IBA 0 mg/L+NAA 0.4 mg/L 为诱导白桃生根的最佳培养基,1/2 MS +IBA 0.5 mg/L+NAA 0 mg/L 为诱导白桃生根数的最佳培养基。
3.3 玻璃化是阻碍白桃试管苗增殖的一大因素
在白桃试管苗增殖的过程中发现,当增殖到第3 代时,白桃试管苗玻璃化程度会迅速提高。且随继代次数的增加,白桃试管苗长势会不断减弱且玻璃化程度也随之增加。而玻璃化的试管苗分化能力低下,难以增殖成苗也难以生根成苗,因此降低桃试管苗增殖过程中的玻璃化率将是今后研究的重点。
[1]陈正华.木本植物组织培养及其应用[M].北京:高等教育出版社,2005:204-207.
[2]中国农业百科全书编务委员会.中国农业百科全书:果树卷[M].北京:中国农业出版社,1993:249.
[3]Smigoeki A C,Hammerschlag F A.Regeneration of plants from peach embryo cells infected with a shooty mutant strain of Agrobacterium[J].J Am Soc,Hortic Sci,2001,116:1092-1097.
[4]吴延军,张上隆,徐昌杰,等.根癌农杆菌介导的桃幼胚转化实验参数研究[J].果树学报,2004,21(5):477-479.
[5]吴延军,张上隆,谢鸣,等.桃 ACO 基因反义转化桃幼胚子叶的研究[J].遗传,2006,28(1):65-70.
[6]中国科学院北京植物研究所五室形态组,北京市农业科学院研究所林业室果树组.早熟桃的培育[J].植物学杂志,1974,1(4):23-25.
[7]姚强,王德春,吴钰良.桃、油桃和蟠桃幼胚愈伤组织诱导和植株再生[J].上海农业学报,1990,6(3):23-29.
[8]Chen Zhiling,Zhang Chenghe,Lu Zhengren,et al.Excised root culture of peach and apricot[J].Advances in Horticulture,2002(2):150-153.
[9]庄恩及,姚强,吴钰良,等.早熟和特早熟桃胚珠培养研究[J].园艺学报,1991,18(4):303-308.
[10]Hammerschlag F A,Bauchan G,Scorza R.Regeneration of peach plants from callus derived from immature embryos[J].Theoretical and Applied Genetics,1985(70):248-251.
[11]刘用生,路广明,胡霓云.离体培养条件下打破桃幼胚休眠初探[J].河南职业技术师范学院学报,1993,21(3):68-69.
[12]孟新法,周维燕.桃胚乳离体培养再生植株的研究[J].北京农业大学学报,1981,7(4):95-98.
[13]刘用生.胚珠培养技术在园艺植物上的应用[J].河南职技师院学报,1990,18(2):32-42.
[14]王玉柱,孙浩元,杨丽.核果类果树胚培养研究进展和育种成效[J].果树学报,2004,24(4):59-63.
[15]阎国华,周宇.桃幼胚下胚轴高频植株离体再生[J].果树学报,2002,19(4):231-234.
[16]Scorza R M,Cordts S M.Long-term somatic embryoproduction and regeneration from embo-drived peach callus[J].Acta-Horticulturae,1990,280:183-284.
[17]陈宗礼,冯晓东,云涛,等.晚蜜桃离体培养初探[J].延安大学学报,2002,21(4):61-64.
[18]尚敏克,姜国斌,尹伟伦,等.晚熟桃的离体组织培养[J].辽宁林业科技,2002,3:5-7.
[19]田增胜,韩明玉,张满让,等.影响早熟油桃茎尖培养增殖效率的因素[J].果树学报,2005,22(3):279-282.
[20]赵胜利.桃梨离体再生体系建立及试管苗种质保存研究[D].福州:福建农林大学,2008.
[21]Fouad M M,Gomaa A H,Zaher H A,et al.Factors influencing rooting of peach shoots cultured in vitro[J].Acta Horticulturae,2005(409):197-202.
[22]Predieri S,Brizzi G,Gatti E.Effect of nitrogen supply on rooting of peach (Pyrus communis L.)microcuttings[J].Advances in Horticultural Science,2009,13(2):68-70.
[23]石晓东,高润梅,刘汉云.川中白岛桃离体培养[J].经济林研究,2007,25(4):53-55.
