石楠叶片红色素特性
2013-02-19郭金耀杨晓玲
郭金耀, 杨晓玲
(淮海工学院 海洋学院,江苏 连云港 222005)
由于天然色素较合成色素安全性高、色泽自然,所以对天然色素的开发性研究课题吸引了众多科技工作者。目前,在植物花色素的提取分离、稳定性、抗氧化性和抑菌性等诸多方面已取得了较大的研究进展,并呈现出了良好的发展前景[1-3]。石楠(Photinia serrulata)系蔷薇科石楠属常绿灌木或小乔木,叶片光绿,初春嫩叶紫红,春末白花点点,秋日红果累累,极富观赏价值,是著名的庭院绿化树种,且叶根可入药。Hou Jie等[4]研究了石楠叶精油的化学成分、细胞毒性和抗氧化活性;吴丽丽等[5]研究了稀土Eu3+对不同光强下红叶石楠色素含量及PAL活性的影响;崔晓静等[6]研究了不同遮光处理对红叶石楠叶色表现的影响。目前,对红叶石楠叶片中花色苷特性研究较少[7]。为了促进对石楠叶片红色素的开发利用,笔者对石楠叶片红色素的稳定性、抗氧化性和抑菌性进行了探索,现将结果报道如下。
1 材料与方法
1.1 实验材料
石楠(Photinia serrulata)叶片,2012 年春于淮海工学院校园采集(观赏石楠的紫红嫩叶)。
金黄色葡萄球菌(Staphyloccus aureus)、大肠杆菌 (Escherichia coli) 和 枯 草 芽 孢 杆 菌 (Bacillus subtilis),由淮海工学院海洋学院微生物实验室提供。
1.2 实验方法
1.2.1 色素的提取分离 称取石楠紫红嫩叶片40 g,加少量体积分数1%酸化乙醇研磨成糊状,再加2倍量的体积分数1%酸化乙醇搅拌浸提,然后经单层滤纸过滤至100 mL的容量瓶中。滤渣再反复浸提2次,合并滤液,定容至100 mL,即为色素提取液。
将色素提取液减压干燥,去除酸化乙醇,加入少量蒸馏水溶解,再加入质量分数5%醋酸铅20 mL,抽滤去除滤液,收集沉淀。将沉淀转移至烧杯中,加入质量分数8%酸化水,过滤去除沉淀,收集滤液,即为较为纯净的色素溶液。将此溶液浓缩干燥称重后,用pH 2的水定容在200 mL容量瓶中,即为本实验所用的石楠叶片红色素原液,其质量浓度为0.4 mg/mL。取色素原液适量,用pH 2的水稀释成质量浓度分别为 0,0.08,0.16,0.24,0.32 mg/mL 的色素溶液,用于实验。
1.2.2 色素的吸收光谱测定 取质量浓度为0.24 mg/mL的色素溶液,在360~600 nm的波长范围内,测定色素溶液的吸光度,确定色素的吸收光谱与最大吸收峰。
1.2.3 pH对色素稳定性影响的实验 取质量浓度为0.24 mg/mL的色素溶液9份,每份5 mL装于试管中,分别调 pH 为 1,2,3,4,5,6,7,8,9,室温静置2 h后,在波长450~600 nm的范围内分别测定各pH色素溶液的吸光度,并观察颜色变化。
1.2.4 光照对色素稳定性影响的实验 取质量浓度为0.24 mg/mL的色素溶液于具塞试管中,分别置直射阳光下和黑暗中, 在 0、1、2、3、4、5、6、7、8 h 后分别测定溶液的吸光度,记录颜色变化,以吸光度的相对变化计算色素保存率。

1.2.5 温度对色素稳定性影响的实验 取质量浓度为0.24 mg/mL的色素溶液于试管中,分别在0、20、40、60、80、100 ℃的不同温度下保温 2 h 后,测定溶液的吸光度,以吸光度的相对变化计算色素保存率。

1.2.6 色素的抗氧化性实验 参照吕春茂等[8]的方法测定色素的抗氧化性。分别检测质量浓度为0.08,0.16,0.24,0.32 mg/mL 的 4 种溶液对羟基自由基和超氧阴离子的清除作用,以石楠叶片红色素溶液的清除率大小表示抗氧化性的强弱。
1.2.7 色素的抑菌性实验 在琼脂平板培养基上分别接种金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌菌悬液各0.2 mL,涂布均匀,然后将直径8 mm的灭菌滤纸片平贴在培养基上,每皿放5片,再在每一滤纸片上滴加色素溶液5 μL。色素溶液质量浓度分 0,0.08,0.16,0.24,0.32 mg/mL 共 5 种, 重复 3次。将处理好的培养皿置37℃培养箱中培养24 h后,观察统计抑菌圈大小。
2 结果与分析
2.1 石楠叶片红色素的吸收光谱
石楠叶片红色素提取液呈现红色,在360~600 nm范围内的吸收光谱见图1。
由图1可知,石楠叶片红色素提取液在测定范围内存在2个吸收峰,在橙红光区的最大吸收波长λmax=526 nm。符合花色苷色素的特征。
2.2 pH对石楠叶片红色素稳定性的影响
在不同pH条件下,石楠叶片红色素呈现不同颜色(表1),吸收光谱也各不相同(图2)。

图1 石楠叶片红色素的吸收光谱Fig.1 Absorption spectrum of pigment from Photinia serrulata

表1 石楠叶片色素在不同pH水溶液中的颜色Table 1 Color of pigment from Photinia serrulata under different pH of the aqueous solution

图2 pH对石楠红色素稳定性的影响Fig.2 pH’s in fluence on Photinia serrulata pigment stability
由表1和图2可见,石楠叶片红色素在pH小于4的酸性条件下较稳定,溶液呈现红色;随着pH的增大,石楠叶片红色素原有的吸收峰逐渐向长波方向移动;当pH大于5时,石楠叶片红色素原有的吸收峰完全消失,色素失去原有色泽,变为褐色。说明石楠叶片红色素在pH大于5时已不稳定,宜在pH小于4的酸性条件下使用。
2.3 温度对石楠叶片红色素稳定性的影响
在不同温度下保温2 h后,石楠叶片红色素的保存率如图3所示。
由图3可知,在温度小于60℃时,随着温度升高,石楠叶片红色素的保存率均在99%以上,颜色仍为红色,说明石楠叶片红色素在60℃以下热稳定性很好。当温度升为80℃时,石楠叶片红色素的保存率降为86%,温度到100℃时,石楠叶片红色素的保存率降至80%。说明石楠叶片红色素在60℃以上温度下稳定性下降,宜在60℃以下使用。

图3 温度对石楠红色素稳定性的影响Fig.3 Temperature in fluence on stability of pigment from Photinia serrulata
2.4 光照对石楠叶片红色素稳定性的影响
光照对石楠叶片红色素稳定性的影响如图4所示。
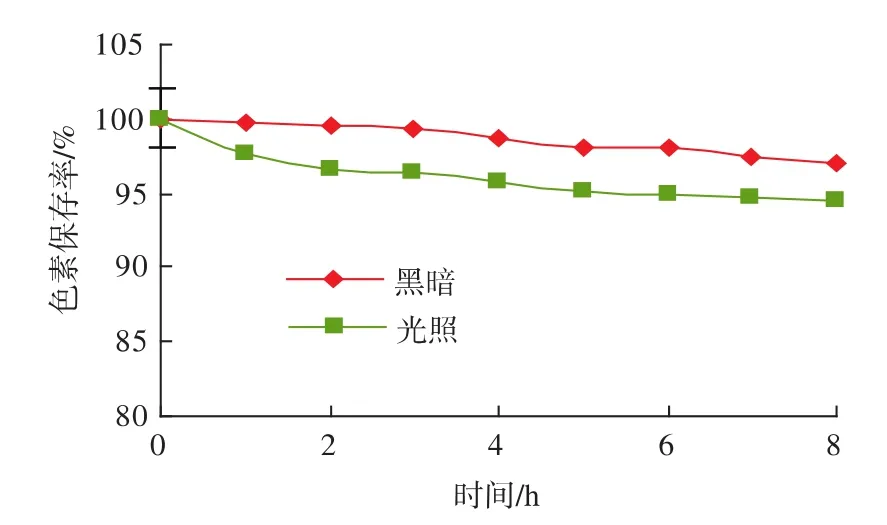
图4 光照对石楠红色素稳定性的影响Fig.4 Light in fluenced on the stability of pigment from Photinia serrulata
由图4可见,石楠叶片红色素在太阳光直射及黑暗条件下,色素保存率均随着时间的延长而逐渐下降。但到8 h时,黑暗中石楠叶片红色素的保存率仍为97.1%,日光下石楠叶片红色素的保存率仍为94.5%,色素溶液颜色仍均为红色。说明石楠叶片红色素具有一定的耐光性。
2.5 石楠叶片红色素的抗氧化性
石楠叶片红色素对羟基自由基和超氧阴离子的清除作用如图5所示。
由图5可见,石楠叶片红色素对羟基自由基和超氧阴离子都具有较强的清除作用,且随着石楠叶片红色素溶液质量浓度的提高,清除率不断上升。在石楠叶片红色素质量浓度为0.32 mg/mL时,色素对羟基自由基和超氧阴离子的清除率分别为89.66%和74.71%。石楠叶片红色素清除羟基自由基和超氧阴离子的半数效应浓度 (EC50)分别为0.08 mg/mL和0.20 mg/mL。说明石楠叶片红色素可增强细胞的抗氧化性,具有一定的保健功效。

图5 石楠红色素对活性氧的消除作用Fig.5 Scavenging effectofpigmentfrom Photinia serrulata to active oxygen
2.6 石楠叶片红色素的抑菌性
观察石楠叶片红色素在不同质量浓度下的抑菌效果,结果如图6所示。
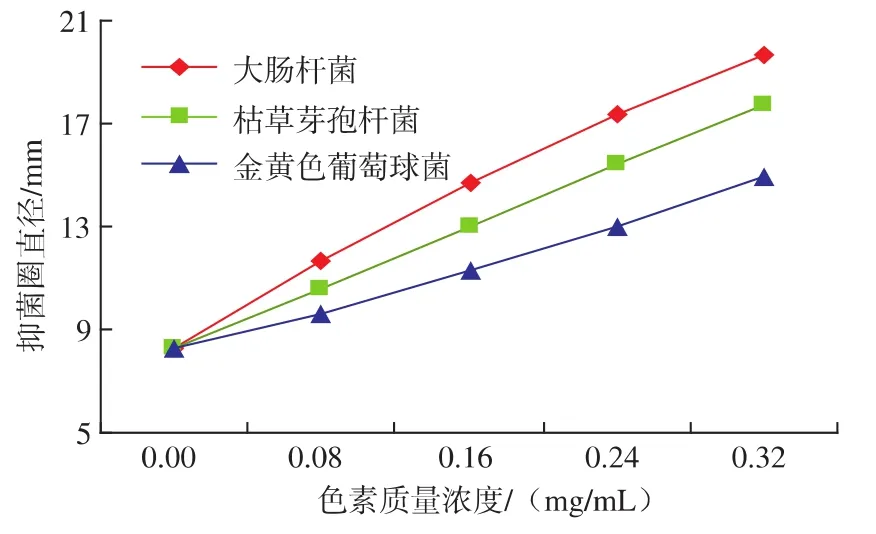
图6 石楠叶片红色素的抑菌性Fig.6 Bacteriostasis of pigment from Photinia serrulata
由图6可见,不同质量浓度的石楠叶片红色素对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌均有抑制作用,且随着石楠叶片红色素溶液质量浓度的提高,抑菌圈直径不断增大。石楠叶片红色素对3种菌的抑制作用不同,抑菌性从大到小依次是大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌。石楠叶片红色素对不同的细菌表现出不同的抑菌效果可能与细菌的代谢途径不同有关。石楠叶片红色素的抑菌性表明它具有一定的防腐性能。
3 结语
植物花色苷是自然界中最庞大的一类水溶性色素,它使植物呈现由红、紫红到蓝等不同颜色。石楠叶片红色素溶于水,在不同pH条件下呈现不同颜色,pH 2的水溶液呈现红色,其吸收光谱具有花色苷色素的特征,说明石楠叶片红色素系花色苷类,属黄酮类化合物[9]。一般认为,花色苷在低温下稳定性较好,随着温度的上升稳定性下降[10]。石楠叶片红色素耐pH小于4的酸性,耐60℃以下温度,并具有一定的耐光性,优于观赏紫稻花色苷等色素[11]。
花色苷未配对电子易与活性氧发生反应,能有效清除多种活性氧自由基[12]。花色苷不仅对植物自身有保护作用,并且具有促进人类健康和防治疾病的作用。目前,已有众多对食用植物花色苷特性的研究报道[13-14],为保健功能性食品的开发提供了一定的理论基础。本课题研究表明,石楠叶片红色素能有效清除系统中的羟基自由基和超氧阴离子,且清除效果与色素质量浓度正相关。在石楠叶片红色素质量浓度为0.32 mg/mL时,对羟基自由基和超氧阴离子的清除率可分别达到89.66%和74.71%。这与孟宪军等以蓝莓为材料的研究结果一致[15]。
植物花色苷有多种生物活性。研究表明,石楠叶片红色素对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌的生长均有明显抑制效果,且色素质量浓度越大,抑菌性越强。说明石楠叶片红色素还具有一定的防腐性能。植物花色苷在功能食品、保健品和医药领域存在较大应用潜力。
[1]许友姣,刘洋,陆利霞,等.新天然色素的研究进展[J].食品研究与开发,2009,30(1):165-169.XU You-jiao,LIU Yang,LU Li-xia,et al.Development of new natural pigments[J].Food Research and Development,2009,30(1):165-169.(in Chinese)
[2]霍锋,郑瑞杰,温海霞,等.植物源天然食用色素的开发利用研究[J].农业科技与装备,2008(5):44-46.HUO Feng,ZHANG Rui-jie,WEN Hai-xia,et al.The exploitation and utlization of plant-derived natural edible pigments[J].Agricultural Science&Technology and Equipment,2008(5):44-46.(in Chinese)
[3]杨晓玲,郭彦东.紫甘蓝色素的稳定性及抑菌性[J].食品科学,2010,31(23):32-35.YANG Xiao-ling,GUO Yan-dong.Stability and antibacterial activity of purple cabbage pigment[J].Food Science,2010,31(23):32-35.(in Chinese)
[4]Hou Jie,Sun Tao,Hu Jun,et al.Chemical composition,cytotoxic and antioxidant activity of the leaf essential oil of Photinia serrulata[J].Food Chemistry,2007,103:355-358.
[5]吴丽丽,高永生,黄伟峰,等.稀土Eu3+对不同光强下红叶石楠色素含量及PAL活性的影响[J].中国稀土学报,2011,29(2):217-223.WU Li-li,GAO Yong-sheng,HUANG Wei-feng,et al.Effects of Eu3+on anthocyanin content and PAL activity in potted Photinia fraseri under different light intensity[J].Journal of the Chinese Rare Earth Society,2011,29 (2):217-223. (in Chinese)
[6]崔晓静,肖建忠,关楠,等.不同遮光处理对红叶石楠叶色表现的影响[J].西北农林科技大学学报:自然科学版,2008,36(10):153-157.CUI Xiao-jing,XIAO Jian-zhong,GUAN Nan,et al.Effect of different shading treatments on the leaf color expression of Photinia frasery Dress[J].Journal of Northwest A&F University:Nat Sci Ed,2008,36(10):153-157.(in Chinese)
[7]刘会超,贾文庆,尤扬,等.红叶石楠叶片中花色苷提取及稳定性研究[J].广东农业科学,2010(2):119-121.LIU Hui-chao,JIA Wen-qing,YOU Yang,et al.Study on extraction and stability of anthocyanin from Photinia serrulata[J].Guangdong Agricultural Sciences,2010(2):119-121.(in Chinese)
[8]吕春茂,王新现,包静,等.越橘果实花色苷的体外抗氧化性[J].食品科学,2010,31(23):27-31.LU Chun-mao,WANG Xin-xian,BAO Jing,et al.Antioxidant evaluation of anthocyanins from bilberry fruits[J].Food Science,2010,31(23):27-31.(in Chinese)
[9]高锦明.植物化学[M].北京:科学出版社,2003.
[10]庞志申.花色苷研究概况[J].北京农业科学,2000,18(5):37-42.PANG Zhi-shen.Anthocyanins are reviewed[J].Beijing Agricultural Sciences,2000,18(5):37-42.(in Chinese)
[11]黄友明,卢其能,张双艳.观赏紫稻花色苷含量和稳定性的研究[J].北方园艺,2009(2):108-110.HUANG You-ming,LU Qi-neng,ZHANG Shuang-yan.The investigation of anthocyanin contents and its stability in purple rice[J].Northern Horticulture,2009(2):108-110.(in Chinese)
[12]Satue-Gracia M T,Heinonen M,Frankel E N.Anthocyanins as antioxidants on human low density lipoprotein and lecithin liposome systems[J].Agric Food Chem,1997,45(9):3362-3367.
[13]郑永霞.花色素苷药理功效的研究进展[J].山西医药杂志,2008,37(3):255-257.ZHENG Yong-xia.Glycosides of flower pigments research progress of pharmacological efficacy[J].Shanxi Medical Journal,2008,37(3):255-257.(in Chinese)
[14]王瑞兰,欧阳蒲月,籍秀梅,等.食用植物中花色苷研究[J].湘潭师范学院学报:自然科学版,2009,31(4):34-37.WANG Rui-lan,OUYANG Pu-yue,JI Xiu-mei,et al.Research anthocyanins from edible plants[J].Journal of Xiang tan Normal University:Natural Science Edition,2009,31(4):34-37.(in Chinese)
[15]孟宪军,孙希云,朱金艳,等.蓝莓多糖的优化提取及抗氧化性研究[J].食品与生物技术学报,2010,29(1):56-60.MENG Xian-jun,SUN Xi-yun,ZHU Jin-yan,et al.Extraction and antioxidant capability of blueberry polysaccharides[J].Journal of Food Science and Biotechnology,2010,29(1):56-60.(in Chinese)
