纤维素分解菌的筛选及其不同组合对秸秆降解的效果
2013-02-19张立霞李艳玲张乃锋刁其玉
■张立霞 李艳玲 屠 焰 张乃锋 刘 策 刁其玉
(中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京100081)
植物纤维素是一种很重要的可再生资源,但是大量的纤维素并没有被合理利用,而是被焚烧或者被随意丢弃。因此,国内外做了很多关于降解纤维素的微生物的研究,目前主要集中在康宁木霉、里氏木霉、黑曲霉等方面,用于固态发酵和堆肥。纤维素是植物材料的主要成分,在一定条件下可以被水解成单糖,单糖可以被动物直接利用,或者是通过微生物发酵生产各种有用的产品,如饲料、食品、药品。植物纤维素中产量最大的是农作物秸秆,秸秆除了焚烧,大部分用于堆肥返田,利用效率及经济效益都不高。如果能找到高效降解农作物秸秆的微生物或者微生物组合,进行发酵降解其中的纤维素和木质素,提高秸秆的营养价值,并进行进一步的加工,将农作物秸秆大量转化为营养价值较高的动物饲料,将大大提高农作物秸秆的利用率。
秸秆利用率不高的主要原因是较高的木质素、纤维素含量,其不仅阻碍了动物体对秸秆的利用,同时也是生产生物酒精、糖等的障碍[1]。但是,经过微生物处理后纤维素的降解率仍然不高,主要是因为木质素形成的骨架结构阻碍了微生物对纤维素的降解。因此,本试验旨在寻找能高效降解木质素和纤维素的微生物组合,用于提高秸秆的营养价值。
1 材料与方法
1.1 材料
1.1.1 菌种
黄孢原毛平革菌(Phaerochaete chrysosporium 5.776),购于中科院微生物菌种保藏中心,编号PC;黑曲霉(Aspergillus niger)SY1-2分离自四川盐湖的土壤中;青霉菌(Penicillium sp.)SP-1、瓶霉(Phialophora spp.)G5分离于云南锡矿的酸性废水中;毛壳霉(Chaetomium)SZ-8分离于沙土中;绿色木霉(Trichoderma viride)Y-1分离于瑞莱德微生物催熟剂中;以上来源于中国农业科学院饲料研究所生物化学与分子实验室,所有菌种保藏于PDA培养基中,置于4℃冰箱中。
1.1.2 材料
玉米秸秆,来源于北京通州,自然晾干,粉碎过40目筛,放于自封袋保存。
1.1.3 培养基
PDA:39 g粉末(DifcoTMPotato Dextrose Agar,BD公司)溶于1 L水中,121℃灭菌15 min。试验菌株孢子长满斜面后用无菌水制成孢子悬液,利用血球计数板计数,达到108个/ml。
PDB:24 g粉末(DifcoTMPotato Dextrose Agar,BD公司)溶于1 L水中,121℃灭菌15 min。
刚果红筛选纤维素琼脂培养基:CMC-Na 1.88 g、明胶 2 g、刚果红 0.2 g、KH2PO40.5 g、Mg⁃SO4·7H2O 0.25 g、琼脂 15 g,自然pH值,用蒸馏水定容至1 L。121 MPa、20 min灭菌备用。使用前加100 μl氨苄青霉素。
固体发酵培养基:称取20 g秸秆,加入5 g的麸皮,按质量与体积比1∶1(w/v)的Mendel营养液[2],充分搅拌,120℃湿热灭菌20 min后,置于恒温培养箱中30℃,发酵10 d,每天取样测定酶活。10 d后,取出样品,烘干测定NDF(中性洗涤纤维)、ADF(酸性洗涤纤维)、ADL(酸性洗涤木质素)。
1.2 菌种筛选
1.2.1 纤维素分解菌的筛选[3]
采用菌饼接种法[4]将长满均匀孢子,d=4 mm的菌饼接种到刚果红纤维素培养基中,30℃培养箱中培养,出现透明水解圈的菌株为纤维素降解菌,测定菌落直径(d,cm)和水解圈直径(D,cm),采用D0=D/d表示水解能力。纤维素刚果红平板透明圈直径与菌落直径(d)的比值(D/d)可以用于初步判断纤维素降解菌酶活力的大小,其大小直接反映了纤维素酶浓度的相对高低[5]。
1.2.2 纤维素分解菌酶活的测定
将初筛得到的菌株在PDA上培养,用接种环将新鲜菌丝接种于PDB中,30℃、200 r/min振荡培养7 d,每天取样测定纤维素酶酶活。
1.2.3 纤维素分解菌与黄孢原毛平革菌组合降解秸秆的效果
将组合菌株按孢子数以等比例接种在秸秆固体发酵培养基中,30℃培养,每天取样测定纤维素酶活、木质素降解酶活,发酵10 d后,将发酵样品取出,65 ℃烘干2 d,测定秸秆NDF、ADF、ADL及纤维素、半纤维素的含量。
1.3 酶活测定
粗酶液的制备:发酵样取出后按1∶10的比例加入去离子水,于150 r/min摇床上振荡1 h,滤纸过滤,滤液作为粗酶液。
①滤纸酶活测定(Ghose,1987)
在pH值5.0、50℃条件下,在50 mmol/l的磷酸氢二纳-柠檬酸缓冲液中测定。
校正:1.5 ml 50 mmol/l磷酸氢二钠-柠檬酸缓冲液,加入3.0 ml DNS,煮5 min,540 nm测定OD值,用于校正分光光度计的0值。
酶液对照:1.0 ml 50 mmol/l磷酸氢二钠-柠檬酸缓冲液,加入0.5 ml酶液和3.0 ml DNS,煮5 min,540 nm测定OD值,和0值相比得到酶液对照。
标准液的制备:葡萄糖在100℃烘2 h至恒重,配成10 mg/ml储存液,并作表1的稀释梯度。
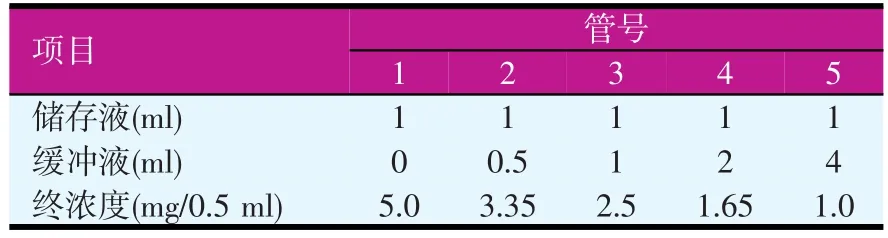
表1 不同浓度的葡萄糖标准溶液
标准曲线的制作:0.5 ml不同浓度葡萄糖标样,加入1.0 ml 50 mmol/l磷酸氢二钠-柠檬酸缓冲液和3.0 ml DNS,煮5 min后加入20 ml蒸馏水,540 nm测定OD值,测定得到的值要减去酶液对照的值。
酶活定义为:每分钟转化底物生成1 μmol产物所需要的酶量。最终得到在反应体系中释放2 mg葡萄糖的酶活力为0.37 U/ml。
酶活测定条件:在上述同样条件下,加入1 cm×6 cm滤纸作为底物,加入1.0 ml pH值5.0、50 mmol/l磷酸氢二钠-柠檬酸缓冲液和0.5 ml酶液,50℃反应60 min,测定酶活。
②羧甲基纤维素酶活(CMCase)的测定
2%低黏度CMC-Na,同上方法制备浓度为2 mg/ml的储存液,进行梯度稀释见表2。
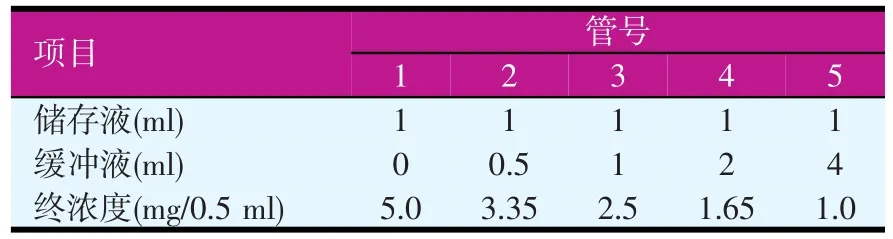
表2 不同浓度的CMC-Na溶液
校正空白:0.5 ml底物,在50 ℃放置30 min,加入3 ml DNS和0.5 ml缓冲液,煮5 min,加入20 ml蒸馏水,在540 nm测OD值,用于分光光度计调0。
酶液对照:0.5 ml底物,在50 ℃放置30 min,加入3 ml DNS 和0.5 ml酶液,煮5 min,加入20 ml蒸馏水,在540 nm下测OD值,和校正空白相比得出酶液对照。
标准曲线:0.5 ml底物,在50 ℃放置30 min,加入3 ml DNS和0.5 ml不同浓度标样,煮5 min,加入20 ml蒸馏水,在540 nm下测OD值,减去酶液对照。
酶活定义为:每分钟转化底物生成1 μmol产物所需要的酶量。
将0.5 ml的酶液预热至50℃,后加入0.5 ml底物进行反应,按标准反应测定酶活。
③以pNPG为底物测定糖苷酶酶活
250 μl底物,加入250 μl适当稀释的酶液,在一定温度下反应10 min,加入1.5 ml 1 M Na2CO3溶液,在405 nm处测定OD值(Baldrian等,2006)。
酶活单位定义为:在最适温度和条件卜,每分钟释放1 μmol pNPG所需耍的酶量(U/ml)。
④木聚糖酶酶活测定
木聚糖酶酶活测定采用DNS法(Miller,1959),反应体系包括100 μl酶液和900 μl桦木木聚糖,在50 mM、pH值5.0磷酸氢二钠-柠檬酸缓冲液中,50℃反应10 min,加入1.5 ml DNS,煮5 min终止反应,在540 nm处测定OD值。
⑤Lac漆酶酶活的测定
参见吴坤(2002)的方法[6]。
⑥Mnp酶活的测定
参见王佳玲(1998)的方法。
⑦木质素过氧化物酶(Lip)活力的测定
参见燕红等(2011)的方法[7]。
2 结果
2.1 纤维素降解菌的筛选(见图1、表3)
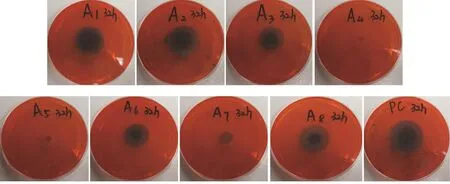
图1 纤维素降解菌产生的透明圈
刚果红培养基作为筛选培养基,可以很快识别出纤维降解能力的高低,方便了筛选。从图1和表3中可看到,试验所用菌株A4、A5在32 h没有产生透明圈,A7在32 h时产生的透明圈较小。测量不同菌株的D/d的比值发现,A1、A2的D/d的比值分别为1.65和1.68,且在试验的8 h时已经产生了明显的透明圈,同时A2的菌丝在培养基上的生长速度较快。A6和A8都属于木霉属,D/d的比值一样,但是A8的生长速度比A6快。所以在本试验中选择A2、A3、A8和PC作为初步筛选的纤维素降解菌株。
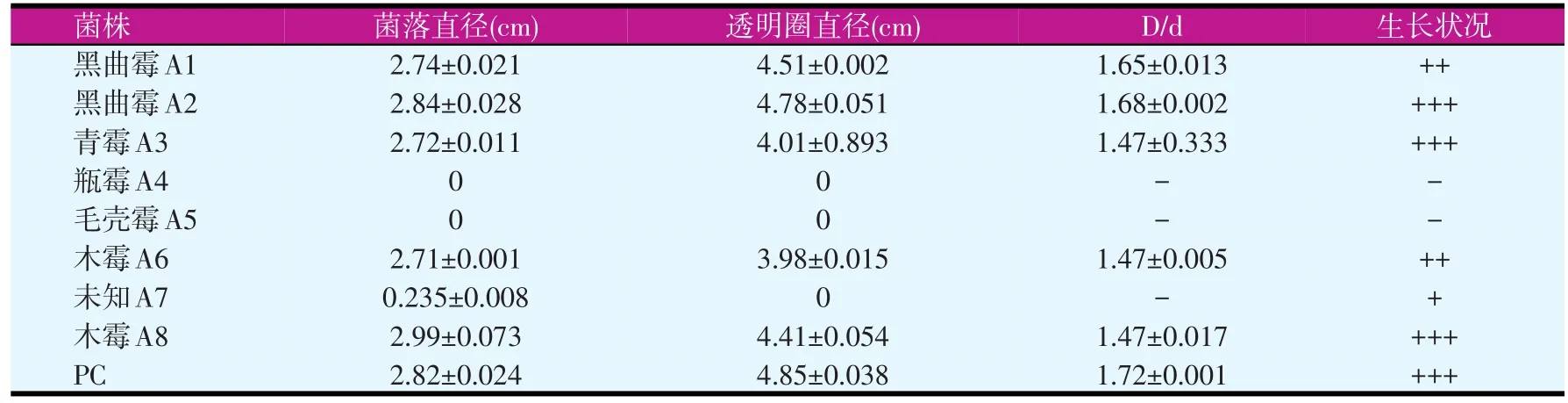
表3 各菌株的D/d比值和生长情况
纤维素降解菌可以产生纤维素酶,而纤维素酶是一种多组分的酶系,是能够降解β-1,4-糖苷键的水解酶的组合,天然纤维素正是在这种复合水解酶的协同作用下被降解。现今,纤维素酶水解的机制仍无统一的共识,但目前较为普遍的是协同理论,即纤维素降解酶普遍认为是所有参与降解纤维素的各种酶的总称,主要包括外切葡聚糖酶(CBH)、内切葡聚糖酶(EG)和β-葡聚糖酶(BG)。外切酶将纤维素分子分解为短链分子,再由内切酶进行切割,形成纤维二糖,最终由β-葡聚糖酶降解成葡萄糖。在秸秆中半纤维素降解酶主要是木聚糖酶,与纤维素酶具有很好的协同性[8]。故测定相应菌株的4种酶活即可以反映降解纤维素能力的大小。为进一步验证上述试验中所得出的A2、A3、A8和PC作为初筛纤维素降解菌,在本试验中,分别测定了FPA、CMCase、β-葡糖苷酶用来作为鉴定菌种纤维素分解能力的大小,同时测定了木聚糖酶的活性作为比较半纤维素分解能力的指标(见图2~图5)。
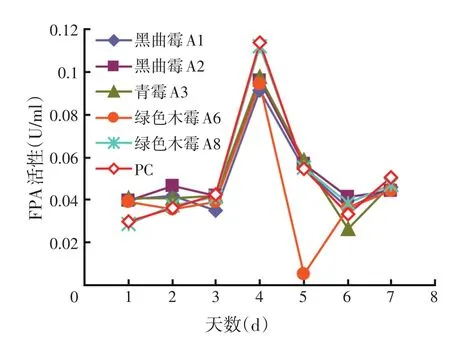
图2 不同真菌在PDB中的FPA活性
对刚果红试验筛选到的菌株进行产酶能力的比较,发现FPA、β-葡糖苷酶的产酶高峰均在第4 d出现,而CMCase、木聚糖酶的产酶高峰在第2 d。FPA代表总纤维素酶活力,从图2可以看出,PC和木霉A8 FPA酶活性明显高于其他真菌,分别为0.114、0.112 U/ml,A6的CMCase的活力最高,A2的木聚糖酶活力最高,A3的β-葡糖苷酶活性最高,为0.801 U/ml。A2的β-葡糖苷酶的活性比A1的低,A2其他3种酶都比A1的高(但是在第5 d,CMCase A1>A2,可能与测定酶活过程中试验操作及底物浓度的控制有关)。A8的β-葡糖苷酶活性比A6低,但是A8的FPA活力高于A6,与前面刚果红试验中得出的结论相符。
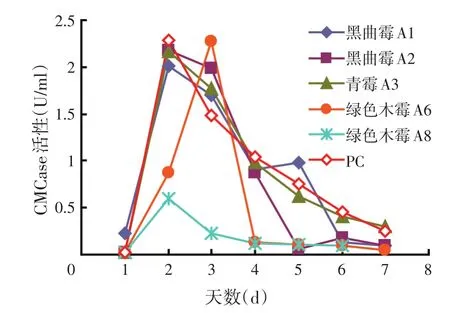
图3 不同真菌在PDB中的CMCase的活性
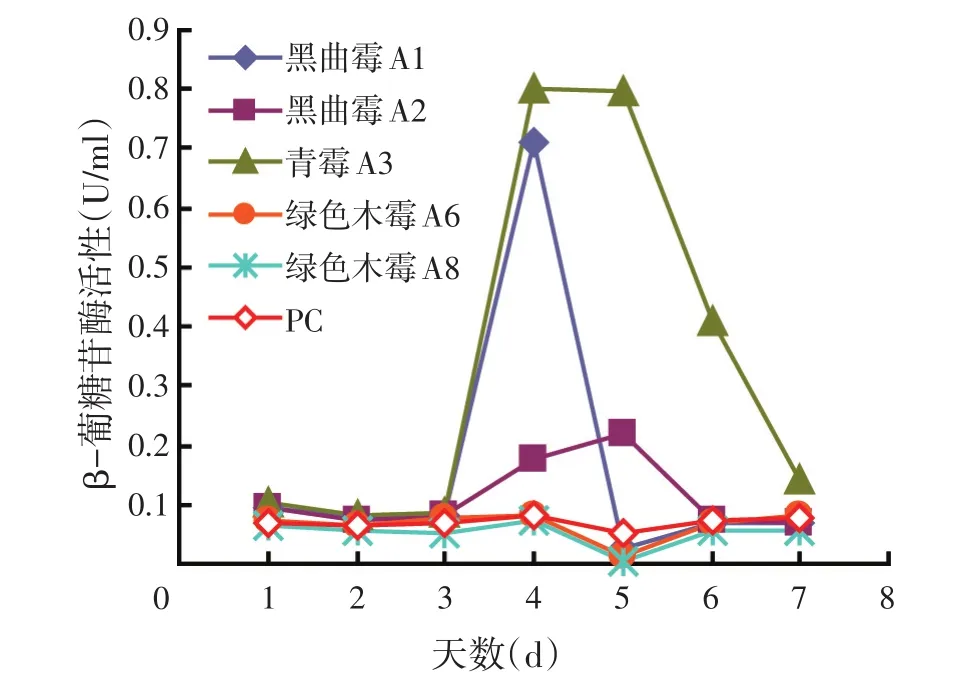
图4 不同真菌在PDB中β-葡糖苷酶的活性
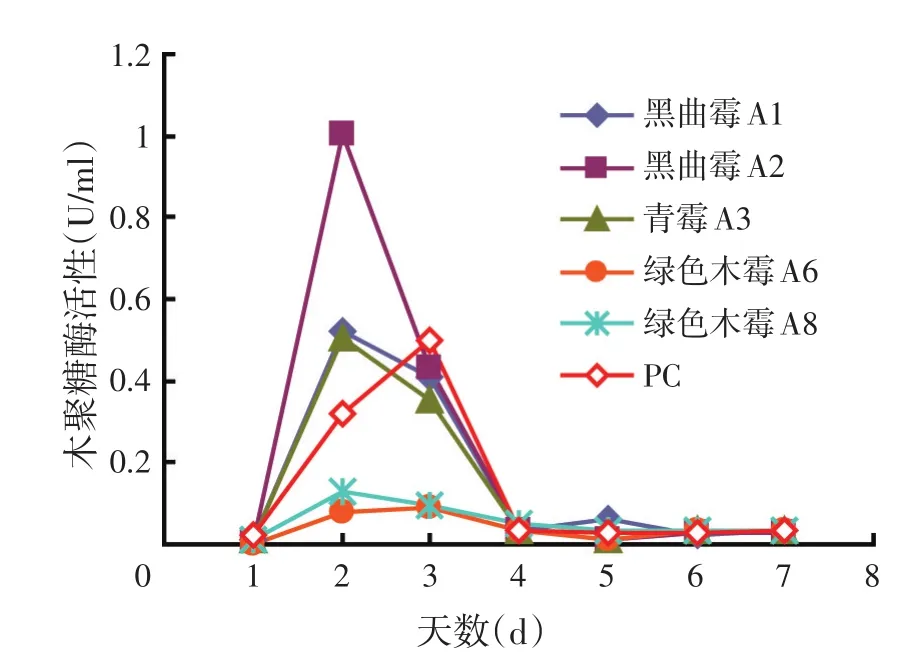
图5 不同真菌在PDB中的木聚糖酶活性
2.2 纤维素分解菌与黄孢原毛平革菌组合降解玉米秸秆(见表4)
在将菌株进行组合前,进行了菌株间拮抗试验,并没有出现拮抗现象。将筛选得到的试验菌株与黄孢原毛平革菌进行组合,固态发酵秸秆10 d,测定酶活,结果见表4。
从表4可以看出,PC+黑曲霉的FPA最高,为0.18 U/ml,PC+木霉的木聚糖酶最高,为0.47 U/ml;PC+黑曲霉+青霉+木霉的Mnp最高,达到了449.58 U/ml;PC+黑曲霉的Lip最高,为25.94 U/ml。不同菌株进行组合,测定了纤维素降解和木质素降解的酶活,表现出协同降解纤维素和木质素的效果。
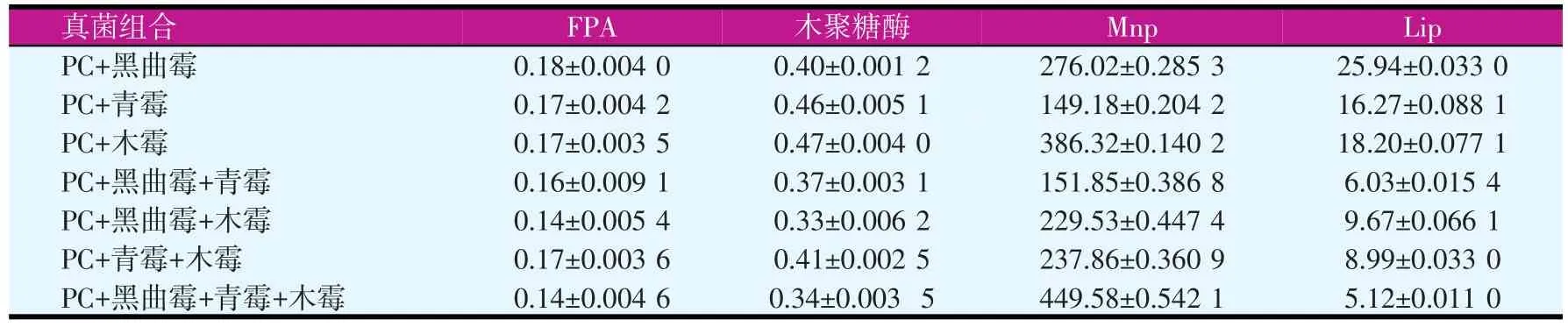
表4 不同真菌组合固态降解玉米秸秆的酶活(U/ml)
2.3 黄孢原毛平革菌与纤维素降解菌复合降解秸秆的效果研究(见表5)
表5是不同菌株和复合菌株进行玉米秸秆固态发酵10 d后,NDF、ADF、ADL、纤维素、半纤维素的含量。从表5中可以得出,经过不同微生物处理的秸秆5种指标的含量比未经处理的秸秆含量低。NDF含量较低的为黑曲霉、PC+木霉和PC+黑曲霉+青霉+木霉;黑曲霉、PC、PC+木霉、PC+黑曲霉+青霉和PC+黑曲霉+青霉+木霉的ADF含量比较低;ADL含量比较低的为黑曲霉、木霉、PC+黑曲霉和PC+黑曲霉+青霉+木霉;半纤维素含量最低的为PC+黑曲霉+青霉+木霉。
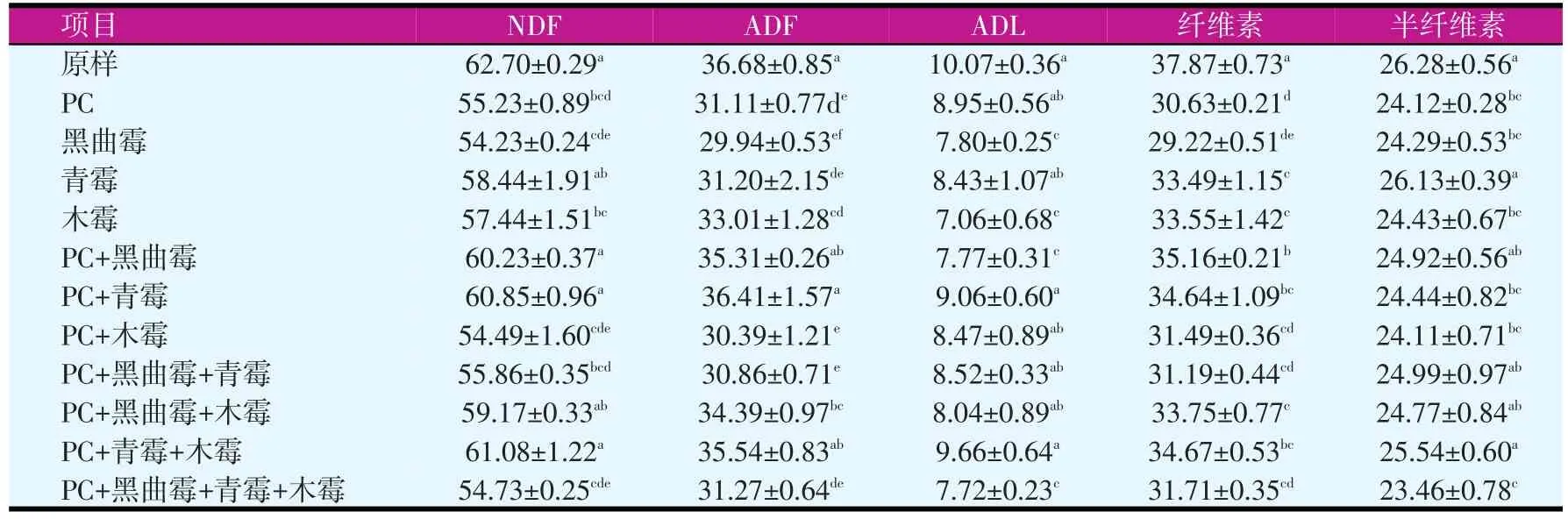
表5 不同真菌组合固态发酵玉米秸秆10 d后木质纤维素的含量(DM,%)
不同菌株产生的纤维素酶的组分不同,与其他菌株进行组合后,不同酶组分相互协同,共同降解纤维素、半纤维素和木质素,增加秸秆的营养价值。根据本试验结果,筛选能够较好降解纤维素和木质素的组合为PC+黑曲霉+青霉+木霉。
3 讨论
植物木质纤维素是地球上最丰富且廉价的可再生资源,占地球上光合作物的60%以上,并且全球每年通过光合作用产生的植物约10 000亿吨,因此,丰富的木质纤维素是有待于利用的非常重要的资源。而植物秸秆木质纤维素的降解一直是国内外普遍关注的问题,且在利用物理方法和化学方法来处理秸秆方面取得了很多成就,但是理化处理一般可以去掉50%的木质素并使纤维素成为非结晶态,但应用于工业化生产存在成本高、易造成再次污染的缺陷[9]。近年来,我国在微生物降解秸秆方面的研究非常活跃,侧重于纤维素分解菌的筛选[10]、纤维素酶活性的研究,也有一些关于真菌纤维素降解机理的报道[11]。利用微生物或者其产生的酶来降解秸秆不仅降解率高,而且安全环保,可再生。
3.1 纤维素分解菌的筛选
所有菌株酶活成分比较复杂,所以之前有进行统一标准的筛选。在筛选好氧单菌时常用的方法是刚果红染色法。Teather等[12]认为刚果红染料与水解后的多糖可形成浓郁色泽的复合物,可方便检测透明圈。Hendrick等[13]将其发展为鉴别培养基。叶姜喻等[3]将其发展成一个方便快捷的培养基,即纤维素刚果红培养基。以刚果红为指示剂,透明圈明显,效果显著,减少了工作量,提高了工作效率。其原理是刚果红能与培养基中的纤维素形成红色复合物,当纤维素被微生物分泌的纤维素酶分解后,刚果红-纤维素的复合物便无法形成,培养基中会出现以纤维素分解菌为中心的透明圈。透明圈出现的越早,越清晰,说明酶类产生的越早,纤维素酶降解越彻底,酶类也越齐全[14]。因此,刚果红纤维素培养基常被用来快速识别微生物降解纤维素的能力。本试验采用的菌饼接种法,在8 h时就已经出现了明显的透明圈,培养32 h后进行菌落直径和透明圈直径的测量,得到产纤维素酶活力较高的4株菌A2、A3、A8和PC。PC除具有典型的降解木质素的能力外,还具有降解纤维素的能力。将筛选得到的6株真菌在PDB中培养,测定纤维素酶的活性。CMC酶活反映的是纤维素酶组分中内切酶的活性,FPA酶活反映的是纤维素酶全组分的活力[15]。本试验中,以β-葡糖苷酶活性进行比较,青霉A3>黑曲霉A1>其他菌株;以CMCase活性进行比较,木霉A6>PC>其他菌株;以FPA活性进行比较,PC>木霉A8>其他菌株。以木聚糖酶活性进行比较,黑曲霉A2>黑曲霉A1>其他。根据透明圈的大小、菌丝体生长状况和所测定酶活的大小,最终确定了黑曲霉A2、青霉A3、绿色木霉A8、PC作为筛选的最终菌株。
本试验筛选到的4种真菌都是具有纤维素分解能力的菌株。青霉属(Penicillium)是真菌中的一些不仅能分泌组成齐全、酶活较高的木质纤维素降解酶系,而且具有易培养和生长快的优势。刘国栋研究显示,经过比较基因组学分析,斜卧青霉含有种类、数量更为丰富的木质纤维素降解酶编码基因,尤其是参与半纤维素降解的蛋白和含纤维素结合域蛋白的编码基因。同时,斜卧青霉基因组织上存在植物细胞壁降解酶编码基因密集分布的区域,部分木质纤维素降解酶编码基因可能来自金华中的水平转移、扩张事件[16]。刘清锋等在稻田腐烂秸秆中分离到一株青霉,培养基含3%稻草粉、0.25%尿素和无机盐营养液,最佳产酶条件为:自然pH值,30℃、130 r/min发酵4 d。该菌株的CMC酶活和滤纸酶活最高分别达到45.01 IU/ml和6.89 IU/ml[17]。对黑曲霉的研究较多且全面,黑曲霉纤维素酶各组分均为糖蛋白,但含糖量和组成各不相同,含糖量分别为:β-葡糖苷酶11.3%,内切β-葡聚糖酶11.8%,β-葡聚糖纤维二糖水解酶CBH-Ⅰ17.2%、CBH-Ⅱ5.8%[18]。纤维素酶各组分全面。绿色木霉也是一种常用的发酵秸秆的菌种。林元山等通过单因子及正交试验,对绿色木霉AS3.5455固体发酵稻草秸秆确定最佳产酶条件为:稻草粉8 g、麸皮4 g,Mendels营养液20 ml、起始pH值5.0,28℃固体发酵3.5 d。在此优化条件下,纤维素酶活力可达0.34 IU/ml[19]。巫小丹等采用PDA-愈创木酚法筛选到1株绿色木霉(Trichoder⁃ma viride),在其研究的最佳产酶发酵条件下,CMCase、FPA和β-葡糖苷酶酶活力分别达(2.73±0.08)、(0.95±0.09)、(1.75±0.12)IU/ml[20]。经过对比,本试验筛选到的青霉、黑曲霉、绿色木霉的酶活性比上述研究的酶活性要低,可能是因为发酵体系的成分、体系中所含的诱导物及发酵条件导致。
3.2 不同真菌组合固态发酵降解玉米秸秆的效果
与木质素降解相关的降解酶主要是Lip、Mnp、Laccase。产木质素降解酶的菌种主要是一些真菌类,其中,白腐菌是目前所发现的一类唯一能够彻底降解木质素的微生物,它可以分泌木质素过氧化物酶(Lip)、锰过氧化物酶(Mnp)、漆酶(Lac)等胞外酶降解木质素。黄孢原毛平革菌是白腐菌的典型代表。其分泌的木质素降解酶主要为Lip、Mnp,不产Lac。与此同时,在不同的研究中发现,青霉、黑曲霉、绿色木霉也能分泌木质素降解酶。尹璐对简青霉降解稻草秸秆的研究发现,简青霉对稻草秸秆降解的大致过程是先对表面蜡质和纤维素、半纤维素进行降解,对木质素进行侧链氧化和甲基化;然后木质素中的苯环被解链,并得到进一步降解[21]。郁红艳等研究发现,其降解主要发生在Lip与木聚糖酶酶活高产的初级代谢阶段,与白腐真菌次级代谢开始降解木质素的作用机制不同,25 d培养可使稻草木质素绝对量损失0.23 g,降解率达14.94%[22]。刁兴梅等从农林废物堆肥中分离得到1株黑曲霉,具有木质素降解能力,兼具低分子量木质素酚型、非酚型类物质的降解能力。在试验条件下,培养30 d使木质素降解率达16.87%,红外光谱分析结果表明,稻草木质素结构被破坏,木质素各官能团的降解作用不同[23]。因此,将黄孢原毛平革菌和青霉真菌等进行组合,可以将初级代谢阶段和次级代谢阶段开始的降解活动进行复合,充分利用各种酶活,增加其降解秸秆的效果。
本试验中,由计算可知,黄孢原毛平革菌纯培养降解玉米秸秆,木质素降解率为29.10%,低于芦淞等的研究结果[24]。苏瑞等研究发现,黄孢原毛平革菌降解稻草,木质素、纤维素和半纤维素的降解量分别提高了3.285%、0.304%和2.123%[25]。王丽婷等对大豆秸秆中木质纤维素进行降解,FT⁃IR检测后发现,与木质素相关的谱峰(1 099 cm-1、1 057~1 038 cm-1)相对强度减小,与苯环相关的谱峰(1 643~1 608 cm-1、1 510~1 508 cm-1)相对强度增加,表明部分大分子木质素裂解成小分子木质素或木质素单体,对比其他谱峰相对强度的变化发现,木质素中苯环等环状化合物含量减少[26]。
黑曲霉降解稻草时,降解率最高可达6.20%[27],明显低于本试验的纤维素降解率9.32%。王仪明等利用绿色木霉固态发酵产纤维素酶发酵小麦秸秆后,中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、纤维素含量和半纤维素含量比发酵前分别下降5.22%、6.88%、4.73%和4.16%,木质素含量无明显变化[28],其降解率明显低于本试验的结果,主要是因为本试验的试验材料是玉米秸秆,比小麦秸、稻草秸营养价值高,易于降解。
任克宁等利用白腐菌5.776和黑曲霉3.3148分解玉米秸秆,白腐菌液体菌种和黑曲霉孢子悬浮液的接种比例为5∶1,白腐菌接种2 d后再接入黑曲霉孢子悬浮液,发酵10 d,所得产物中性洗涤纤维的含量为52.07%[29]。比本试验的白腐菌和黑曲霉组合的中性洗涤纤维含量60.23%要低,可能是所用的玉米秸秆本身的木质纤维素的含量及硅酸盐的含量不同,导致该真菌组合对玉米秸秆的降解率不高。陈耀宁报道,黄孢原毛平革菌和歧皱青霉混合培养发酵稻草秸后,发酵体系内的微生物产酶更加稳定,峰值维持时间较长,发酵结束时Lip还处于较高水平(52 IU/ml),约是黄孢纯培养时的两倍,结束时Mnp也比其他纯培养的高。同时,半纤维素、纤维素和木质素降解率均比纯培养时高,分别为53.1%、52.7%和54.9%[30],均高于本试验的半纤维素、纤维素和木质素降解率。
本试验将黄孢原毛平革菌分别与上述筛选的纤维素分解菌进行组合,测定其在固态发酵条件下的酶活及其降解秸秆的效果。对表5进行分析,PC+黑曲霉+青霉+木霉的木质素含量低于PC、黑曲霉、青霉的纯培养发酵,与木霉发酵降解秸秆的木质素含量相差不多;同时表明不同的纤维素降解菌和木质素降解菌简单的组合在一起,往往达不到满意的效果,有的组合降解秸秆的效果并不明显。经过比较,PC+黑曲霉+青霉+木霉是比较理想的组合,Mnp的酶活达到449.58 U/ml,Lip的酶活为5.12 U/ml,纤维素、半纤维素、木质素降解率为29.60%、12.02%、29.10%。
4 结论
本试验得到了一种能较好降解纤维素和木质素的菌株的组合PC+黑曲霉+青霉+木霉,纤维素、半纤维素、木质素的降解率分别为29.60%、12.02%、29.10%。
