颅内血管外皮瘤的MRI表现及临床治疗
2013-02-15李薇陈晓雷张威江于向荣王清
李薇,陈晓雷,张威江,于向荣,王清
血管外皮细胞瘤(hemangiopericytoma,HPC)主要发生于肌肉、骨骼及皮肤,发生于颅内的HPC 极为罕见,术前容易误诊。本文通过回顾性分析9例经手术病理证实的颅内HPC 病例的MRI表现、治疗及预后,旨在提高对该病的认识。
材料与方法
1.临床资料
回顾性分析9例经手术病理证实的HPC 病例的MRI资料,其中男4例,女5例,年龄21~63岁,平均44岁。病程1~13个月,平均2个月。9例患者均有不同程度头痛,伴恶心、呕吐5例,视物不清1例,癫痫1例,意识障碍1例,走路不稳1例。
2.检查方法
采用GE Signa EXCITE 1.5T HD TwinSpeed MR 扫描仪,标准头线圈,行轴位快速反转恢复序列T1FLAIR(TR 1740ms,TE 21ms,TI 720ms),快速自旋回波FSE T2WI(TR 3900ms,TE 115ms),液体衰减反转恢复序列T2FLAIR(TR 8600 ms,TE 121ms,TI 2100ms)。增强扫描采用钆喷替酸葡甲胺(Gd-DTPA),以0.1mmol/kg的剂量经肘静脉团注后行T1WI快速扫描,注射流率1.5~2.0ml/s,注射后20~30s行动脉期扫描,60~70s后开始行静脉期扫描,100~120s 后行延迟扫描。扫描视野24cm×24cm,层厚5mm,层间距1mm,其中有4 例患者在MRI检查后3天内行DSA 检查。仔细观察影像结果并与手术病理对照分析。
3.手术及病理
9例患者均于MRI检查后1周内行肿瘤切除术。由于HPC常由颈内动脉和(或)椎-基底系统与颈外动脉系统双重供血,因此术中首先切除肿瘤基底,切断肿瘤的颈外动脉血管供应,然后边电凝肿瘤包膜边显露颈内动脉来源的血供并离断。肿瘤分离困难时,先行肿瘤包膜内大部分切除,再沿肿瘤边界进行分离,术中尽可能切除附着部位的硬脑膜、大脑镰及受累颅骨等。对无法完全切除而残留的肿瘤或受侵蚀的硬脑膜予以双极电凝烧灼。切除组织均行HE染色和免疫组织化学染色病理检查。
结 果
9例肿瘤均为单发病灶,其中2例位于大脑镰旁,4例位于大脑凸面,1例位于中颅窝底,1例位于桥小脑角,1例位于后颅窝小脑天幕。肿瘤均呈分叶状,平均直径约5.8cm,最大直径约11cm。T1WI呈等信号2例,呈低等混杂信号5例,呈低信号2例;T2WI呈等信号3例,呈高等混杂信号6例;MR 动态增强显示动脉期显著强化7例,中等程度强化2例;所有病例门脉期均持续强化,与血管强化程度相仿,延迟扫描病灶均呈高信号。其中5例肿瘤可见囊变、坏死,7例内部可见纡曲血管信号影,4例瘤周可见水肿,3例可见脑膜尾征,2例病灶与脑组织界限模糊不清(图1a~c)。术前有6例误诊为脑膜瘤。其中4例DSA 检查显示肿瘤均有丰富的血供,动脉期可见团状、粗细不均、排列紊乱的病理血管,静脉期肿瘤染色显著;选择性颈外动脉栓塞后肿瘤血管部分闭塞(图1d)。
9例术中均见肿瘤呈分叶团块状,有包膜,呈灰红色或红色,质地坚韧,局部与脑膜有粘连,表面可见匍匐增生血管,瘤内富含血管和血管窦。切除肿瘤时出血量多,其中有4例术中出血量达2500ml以上,2 例因与血管紧密相连,未能将肿瘤全切。术后1~3个月内患者均接受放射治疗,剂量为50Gy,其中5例症状好转,1 例症状有所加重,2例无明显变化,1例因术后体温不升于术后第3 天死亡。5例症状好转患者术后得到随访,随访时间3~36 个月,平均18个月。1例肿瘤局部复发,1例发生颅外转移。
讨 论
1.颅内HPC的临床及影像学特点
颅内HPC 好发中年人,病程短,进展快,就诊时肿瘤多已巨大,本组9例就诊时病灶平均直径约5.8cm,最大径约11cm。由于肿瘤起源于脑膜间质毛细血管壁Zimmerman周细胞,为紧贴毛细血管网状纤维膜排列的梭形细胞,因此MRI显示病灶多发生于颅底部、矢状窦或大脑镰旁及小脑幕等硬脑膜或静脉窦附近[1-3],且多数与硬膜广基底相连,增强扫描可见脑膜尾征,提示脑膜反应性增厚,纤维细胞及毛细血管增生,或肿瘤通过脑膜蔓延所致[4],与脑膜瘤MRI表现相似,容易混淆。本组仅2例病灶与硬膜以窄基底连接,可能是由于肿瘤生长时间短而体积较大所致。HPC多呈分叶状或不规则形,主要由于病灶血供丰富、生长较快,以及其边缘各部位的肿瘤细胞分化程度不同,生长快慢不一所致,可反映其具有侵袭生长特点[5]。由于肿瘤生长过快、瘤内血供无法满足肿瘤生长需要,MRI显示病灶内部信号多不均匀,常可见囊变、坏死,但通常无钙化。HPC 内纡曲的血管流空主要与肿瘤内丰富的血供有关[3,6],本组中纡曲流空信号者占77.8%(7/9),具有一定的特征性。增强扫描时由于HPC常由颈内动脉和(或)椎-基底系统与颈外动脉系统双重供血,肿瘤强化程度高,强化持续时间长,类似于动脉瘤的强化征象。同时由于HPC 侵袭性强,可压迫、侵蚀静脉窦及直接累及周围脑组织[5],导致本组4例瘤周水肿,2例瘤脑界面模糊不清。
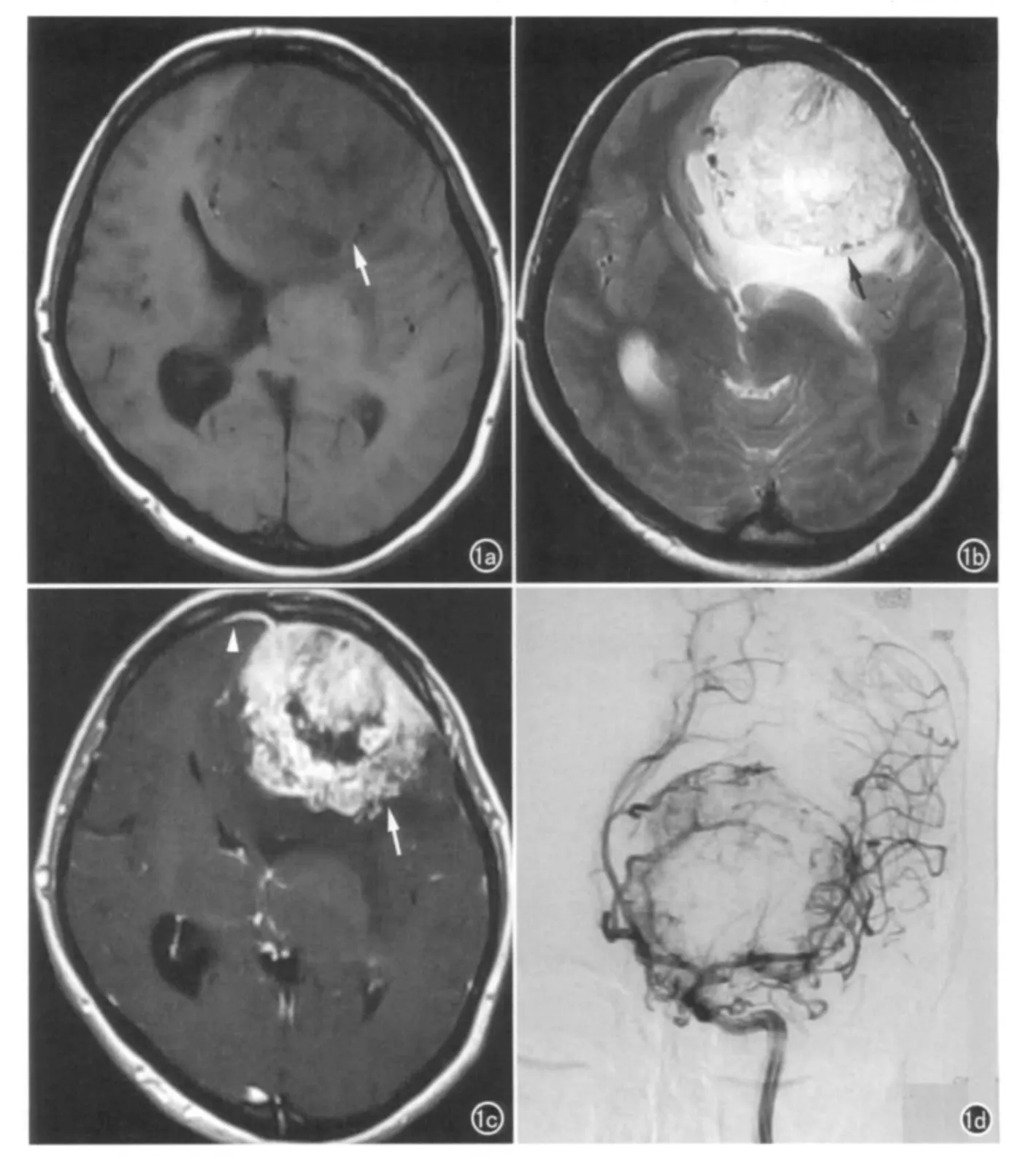
图1 颅内血管外皮细胞瘤。a)T1WI示肿瘤位于左侧额部硬膜(箭),呈等低混杂信号,形态不规则,局部呈分叶;b)T2WI示肿瘤呈等高混杂信号(箭),其内见线条样及点状血管流空信号,瘤周可见中度水肿信号环绕;c)增强扫描示肿瘤呈明显强化(箭),其内可见坏死、囊变,邻近可见脑膜尾征(箭头);d)左侧颈内动脉造影示团状、粗细不均、排列紊乱的供血动脉。
2.颅内HPC的鉴别诊断
颅脑HPC与脑膜瘤好发部位相同,MRI表现相似,极易混淆,但HPC 全切率低,复发率高,且容易发生转移,两者预后差别较大,术前鉴别诊断很有必要。脑膜瘤由于生长缓慢,形态上多呈类圆形、椭圆形,T1WI上瘤周可见低信号环,该信号环为肿瘤包膜,是由肿瘤周围的小血管,薄层脑脊液、神经胶质及萎缩的皮层构成,具有一定的特征性,同时瘤内较少见血管流空信号[2],可见囊变、出血、钙化征象,以钙化最为常见。增强扫描时由于脑膜瘤血供主要来之供应肿瘤中心的脑膜动脉,强化程度低于HPC。但当脑膜瘤恶变时,两者鉴别困难,需要行病理组织学检查确诊[6]。颅内HPC还应与以下肿瘤鉴别:①胶质瘤:生长于皮层的胶质瘤则需仔细观察其边缘,如发现脑内占位征象,则可除外血管外皮细胞瘤;②转移瘤:与单发转移瘤有时鉴别困难,但如有瘤周恶性指状水肿表现或身体其他部位有原发肿瘤证据则不难鉴别;③桥脑小脑角区神经鞘瘤:神经鞘瘤增强扫描一般不如血管外皮细胞瘤增强显著,同时常有听神经增粗,内听道扩大的表现;④颅底脊索瘤,脊索瘤主要累及斜坡,典型特征为T1WI上斜坡髓质高信号消失,代之为不均匀信号的软组织肿块,同时CT特征性表现是颅底骨的破坏合并有钙化的软组织肿。
3.颅内HPC的治疗及预后
对于颅内HPC,手术全切除或扩大切除仍是目前最佳的治疗方法[7-9],Kim 等[8]报道切除程度对5年无复发率有显著影响,全切者为73%,非全切者为21%。但HPC 血供丰富,手术全切除的关键在于控制和减少出血,原则上术前行DSA 栓塞可减少失血量,但本组4例HPC 患者行术前栓塞时效果良好,术中却仍有2例有大出血,可能由于HPC 有软脑膜血管参与供血,以及栓塞血管再通、代偿等原因,导致栓塞效果不如脑膜瘤。由于肿瘤表面及周边硬膜密布增生的丛状血管,手术应先离断肿瘤基底与硬膜连接,然后沿包膜分离肿瘤,切断周边供血血管,力争整块切除肿瘤。
HPC瘤细胞增殖活跃,侵袭性强,预后多不良,具有高复发率和转移率,同时术中瘤细胞脱落种植,置入受累骨瓣或受累硬膜切除不彻底均加速复发,术后放疗可以明显减少复发率。Kim 等[8]报道单纯肿瘤全切者的5年无复发率为70.3%,肿瘤全切+辅助放疗(剂量>50Gy)无复发率为100%,明显延缓原位复发。本组5例患者术后放射治疗,2例复发(40%),复发率较文献为高,考虑与样本量少及早期放疗剂量较低(剂量为50Gy)有关。本组5例随访患者中,1 例局部复发,表现为手术区域可见异常软组织信号,对于复发者建议尽可能行二次手术,术后行二次局部放疗;1例发生颅外转移,预后不良,提示手术后辅助放疗虽可改善预后,但并不能抑制颅外转移[10]。
综上所述,颅内HPC的MRI表现有一定的特征,主要包括病灶巨大,呈分叶状,易囊变、坏死,流空血管常见,增强显著,侵袭性强,有助于提高其诊断准确性。最佳治疗方法是术中全切除,术后放射治疗有助于改善预后。
[1]Sibtain NA,Butt S,Connor SE.Imaging features of central nervous system haemangiopericytomas[J].Eur Radiol,2007,17(7):1685-1693.
[2]薛鹏,弓莉,杨纪周.颅内血管外皮细胞瘤CT和MRI影像分析及治疗选择[J].放射学实践,2005,20(7):572-574.
[3]夏东,陈燕萍,唐姗姗.中枢神经系统血管周细胞瘤的MRI诊断[J].放射学实践,2010,25(12):1327-1330.
[4]Sheporaitis LA,Osborn AG,Smirniotopoulos JG,et al.Intracranial meningioma[J].Am J Neuroradiol,1992,13(1):29-37.
[5]钱林青,王中领,郭亮,等.颅内血管外皮细胞瘤MRI特征[J].临床放射学杂志,2011,30(4):473-476.
[6]Akiyama M,Sakai H,Onoue H,et al.Imaging intracranial haemangiopericytomas:study of seven cases[J].Neuroradiology,2004,46(3):194-197.
[7]苏少波,张建宁,杨学军,等.颅内血管外皮细胞瘤诊断和治疗[J].中华神经外科杂志,2007,23(9):653-656.
[8]Kim JH,Jung HW,Kim YS,et al.Meningeal hemangiopericytomas:long-term outcome and biological behavior[J].Surg Neurol,2003,59(1):47-54.
[9]Ecker RD,Marsh WR,Pollock BE,et al.Hemangiopericytoma in the central nervous system:treatment,pathological features,and long-term follow up in 38patients[J].J Neurosurg,2003,98(6):1182-1187.
[10]Sheehan J,Kondziolka D,Flickinger J,et al.Radiosurgery for treatment of recurrent intracranial hemangiopericytomas[J].Neurosurgery,2002,51(4):905-911.
