制革污泥中产脂肪酶真菌的筛选及产酶条件优化
2013-01-30马宏瑞
马宏瑞, 罗 茜, 朱 超
(陕西科技大学 资源与环境学院, 陕西 西安 710021)
0 引言
脂肪酶(EC3.1.3.3)是一种重要的工业酶类.在油脂化工和有机合成中,脂肪酶具有条件温和、耗能低、原料要求低、成品质量高等优点,尤其是1,3位专一脂肪酶,可用于特殊脂肪酸、单甘酯的合成及立体选择性化学合成和拆分,具有巨大的应用潜力[1,2].在脂肪酶的广泛来源中产自微生物的脂肪酶最具研究价值.近二十年来,被深入研究和应用于工业生产的微生物脂肪酶种类不断增加,并借助于遗传工程提高了脂肪酶的产量.目前其在食品生产加工、乳制品、药物、洗涤剂、纺织、生物柴油和化妆品行业领域中都有应用[3,4].洗涤剂行业是脂肪酶的主要应用领域[5],脂肪酶的添加增加了洗涤剂去除顽固油渍的能力,同时具有环境友好性[6].
但脂肪酶也存在稳定性差、底物的不溶于水、酶的来源面较窄、提纯困难以及极端环境应用受限,特别是工业用酶在某些生产工艺中面临易受产物和抑制剂的抑制,且半衰期短以及工艺要求的温度和pH不在酶反应的最适条件范围内等问题[7,8].到目前为止各国仍在努力寻找和研究不同来源的具有潜在应用价值的微生物脂肪酶,以满足各方面的不同要求[9].从某些极端或特殊生产环境中分离具备一定抗性的产脂肪酶微生物是扩大脂肪酶来源的重要方法之一.制革污泥生产环境中的主要成分为: 蛋白质、油脂混合物、铬、钠等的氯化物、硫化物、硫酸盐以及少量的重金属盐等,还含有Al、Mn、Pb、Ti、Fe等微量元素,铬、钙、钠、硫化物、硫酸盐及氯化物的含量较高[10],同时,还具有各类有抗性的微生物.目前还未见从含铬制革污泥这种特殊环境中分离产脂肪酶菌株的相关报道.
本研究的目的在于从制革厂污泥中分离潜在的具有高产酶能力的菌株并进行初步的产酶条件优化,为今后的进一步应用起到指导作用.
1 材料和仪器
1.1 材料
1.1.1 分离样品
本实验所用产脂肪酶微生物分离样品来自于海宁某牛皮制革厂的综合污泥,污泥烘干至105 ℃时含水率为14.4%,样品性质见表1.
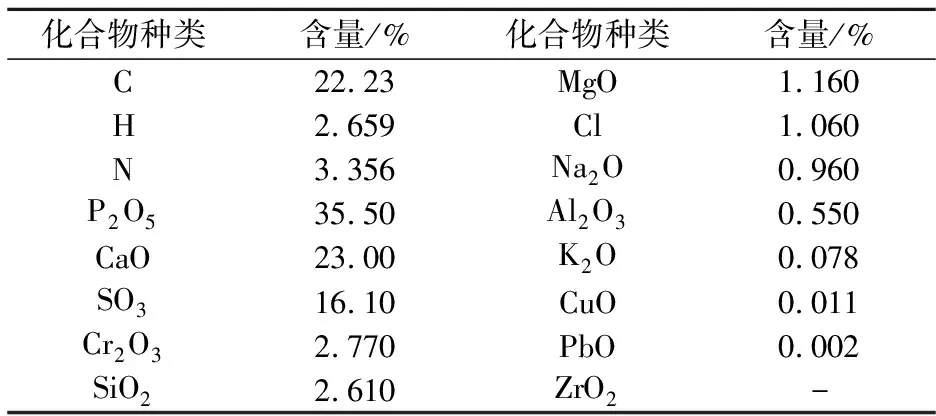
表1 污泥所含主要元素检测结果
1.1.2 培养基
溴甲酚紫平板筛选培养基(g/l):橄榄油乳化液100,(NH4)2SO41,K2HPO41,KCl 0.5,NaCl 1,MgSO4·7H2O 0.5,FeSO40.1,1.6%溴甲酚紫 1,琼脂15,用NaOH调节到pH 6.5~7.0;罗丹明B培养基(g/l):橄榄油乳化液100,(NH4)2SO41,K2HPO41,KCl 0.5,NaCl 1,MgSO4·7H2O 0.5,FeSO40.1,0.2%罗丹明溶液 1,琼脂15,用NaOH调节到pH 6.5~7.0;富集培养基(g/l):胰蛋白胨10,酵母提取物 5,NaCl 10,琼脂 15,用NaOH调节到pH 7.0;种子液培养基(g/l):胰蛋白胨 10,酵母提取物 5,NaCl 10,用NaOH调节到pH 7.0;发酵培养基(g/l):蔗糖 60,豆饼粉20,KH2PO43,MgSO4·7H2O 2,KCl 0.5,(NH4)2SO45,橄榄油30 mL/L,用NaOH调节到pH 7.0~7.2.
1.2 主要仪器
420-BS电热恒温培养箱(上海博泰);HC-3018R高速冷冻离心机(安徽中科中佳);PHC-3C雷磁pH仪(上海精科);RH-QG型全温光照振荡器(金坛市金南仪器);HS-1300-V型超净工作台(苏州安泰空气技术有限公司);T-gradient型PCR仪(美国ABI);Gel-Doc2000凝胶成像仪(英国SYNGENE).
2 实验方法
2.1 菌株初筛
取5 g分离样品加入40 mL无菌水,震荡,静置,取上清液梯度稀释至10-5,取10-4稀释水样0.5 mL分别涂布于6个罗丹明 B培养基和溴甲酚紫培养基,各设三个平行;取10-5稀释水样0.5 mL分别涂布于6个罗丹明B培养基和溴甲酚紫培养基,各设三个平行,共制作12个平板.培养皿分别放入15 ℃、30 ℃和40 ℃的培养箱中培养,将未进行淹水培养的平板按照同样的方式进行培养,培养时间为3 d.
2.2 平板复筛
从初筛平板生长菌落中挑选出16株变色圈较大且具有代表性的微生物,进行平板划线,置于30℃恒温培养箱中培养1 d.
2.3 平板复壮
挑取划线培养的单菌落接种于30 mL的种子培养基中,于28 ℃,150 r/min条件下震荡培养24 h.
2.4 发酵培养
将种子培养液按5%(V/V)的接种量接种于30 mL的发酵培养基中,于28 ℃,150 r/min震荡培养72 h.
2.5 酶活测定
取30 mL发酵培养液,在4 000 r/min下离心10 min后,取上清液进行酶活的测定.测定方法为改进后的碱滴定法:取50 mL烧杯2只,分别加入PVA橄榄油5 mL和0.05 mol/L、pH=10.30 甘氨酸-NaOH缓冲液4 mL,在25 ℃水浴中预热10 min后,加酶液1 mL,并立即计时,反应10 min后立即加入15 mL工业乙醇终止反应.用0.05 mol/L NaOH标准溶液进行滴定,pH值10.50为终点,对照样品的乙醇应在酶液之前加入.在反应条件下,每分钟水解产生1μg分子脂肪酸的酶量定义为一个脂肪酶国际单位.酶活计算公式如下:

(1)
式中V为测定样品耗碱毫升数;V0为对照样品耗碱毫升数;t为反应间(min);50为1 mL 0.05 mol/L NaOH的微克分子数;n为释倍数.
2.6 二次发酵培养和酶活测定
选酶活较高的株菌直接使用其发酵液作为接种物进行二次发酵培养,方法同2.4,接种量为2.5(V/V),并测定酶活,酶活最高者作为候选菌株,并进行后续试验.
2.7 菌株形态学鉴定及生理生化特征
观察菌株TeratosphaeriaceaeCr12在平板培养基上的菌落形态和革兰氏染色结果.生理生化测定参照文献进行[8,11].
2.8 菌株分子生物学鉴定
参考Kim等[12]和Rainey等[13]的方法少量提取总DNA.引物为真菌通用18Sr RNA ITS1(5′-GTAGTCATATGCTTGTCTC-3′)和Fungi (5′-CATTCCCCGTTACCCGTTG-3′).PCR扩增体系:DNA(70 ng/μL)模板2μL;dNTPMixture (2.5 mM) 2.5μL; 27 F (20μM) 1.5μL; 1492R(20μM)1.5μL;10×Ex Taq Buffer(Mg2+ plus )5μL;Ex Taq酶(5 U/μL)0.2μL;补足ddH2O到50μL.PCR扩增程序:94 ℃预变性3 min;94 ℃变性1 min, 55 ℃退火1 min, 72 ℃延伸3 min, 30个循环;72 ℃延伸5 min.Ex Taq DNA Polymerase等扩增所用试剂均购自TaKaRa公司,PCR Purification Kit购自Promega,引物由上海生工合成.PCR产物经试剂盒纯化(Axygen),连接到pMD18-T载体上,并转化至DH5α感受态细胞中后外送测序.序列提交NCBI数据库,使用Clustal X软件比对后,用Mega 5.1构建系统发育进化树.
2.9 产酶条件优化
分为以下条件的优化,所有处理设置三个平行,之后进行酶活的测定.
2.9.1 接种量的优化
总发酵体积为100 mL,按体积比分别接种1.5%、2.5%、3.5%、4.5%和5.5%,接种液为种子培养基培养24 h后培养物.培养时间为72 h,培养温度28 ℃,初始pH为6,转速150 r/min.
2.9.2 发酵周期的优化
在2.9.1的基础上设置不同的发酵时间,分别为24 h、48 h、72 h、96 h、120 h.
2.9.3 发酵温度的优化
在2.9.1的基础上设置不同的发酵温度,分别为10 ℃、15 ℃、20 ℃、30 ℃、35 ℃、40 ℃.
2.9.4 初始pH的优化
在2.9.1的基础上设置不同的发酵初始pH值,分别为5、5.5、6、6.5、7、7.5、8和9.
2.9.5 种龄的优化
在2.9.1的基础上选取不同种龄接种物进行接种,分别为6 h、12 h、18 h、24 h、30 h.
2.9.6 保存时间对酶活的影响
将最优条件下所产酶提取在4 ℃下保存不同的时间,分别为0 h、1 h、2 h、3 h、4 h、5 h、6 h,之后分别测酶活.
3 结果与讨论
3.1 脂肪酶产生菌筛选结果
对平板筛选出的16株菌进行划线培养,得到单菌落,使用单菌落在种子培养基中进行接种液培养,后进行发酵培养,并测定其酶活,通过酶活测定以及平板筛选时菌株在罗丹明B培养基上长出的透明圈的大小两个指标共同判断菌株的产脂肪酶能力的大小,结果见表2.经复筛后,确定命名为TeratosphaeriaceaeCr12(表中T. Cr12)作为后续试验菌株.

表2 平板筛选酶活测定结果
3.2 菌种形态学特征
菌株TeratosphaeriaceaeCr12的平板培养形态如图1.

图1 脂肪酶产生菌Cr12的菌落形态
该菌为革兰氏阳性菌.菌株30℃ 72 h在琼脂糖培养基上形成直径约为50 mm,圆形、扁平、边缘较整齐、表面光滑湿润、半透明、呈淡橘红色,长时间放置后表面变成微细粉末状或颗粒状.
3.3 部分生理生化性质测定结果
表3为筛选菌株Cr12的部分生理生化特性,由表可知该菌株为专性需氧菌,不具备蛋白水解酶,耐高温生长.从鸟氨酸脱羧酶和精氨酸双水解.
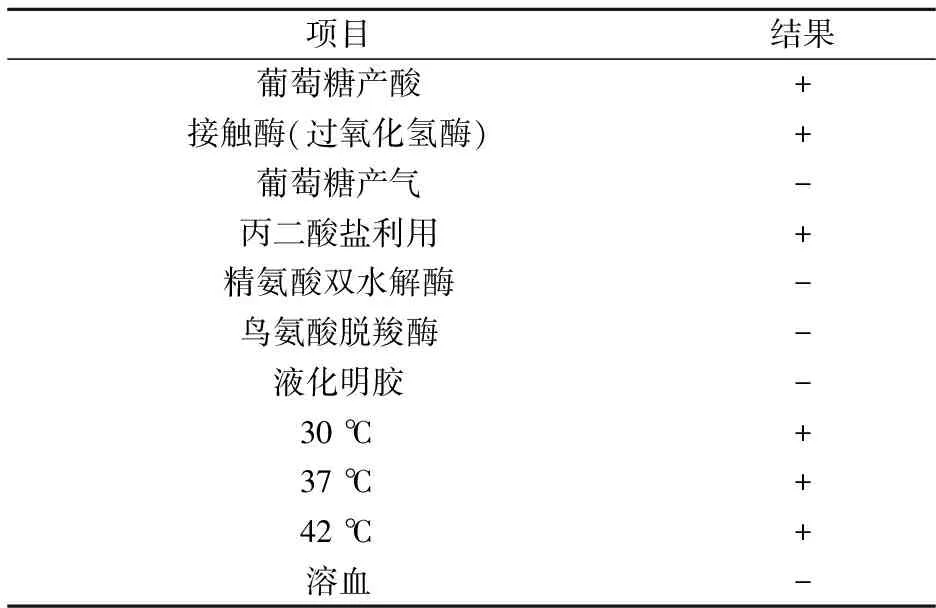
表3 产脂肪酶菌株Cr12部分生理生化特性
酶试验结果为阴性可知Cr12蛋白质利用能力有限.Cr12可在沙堡弱培养基和马铃薯葡萄糖琼脂上生长,菌落淡橘红色或橘黄色,可确定为真菌.后续分子生物学鉴定因此基于18S rRNA进行.
3.4 菌株Cr12的分子生物学鉴定
18S rRNA序列是真核生物分子鉴定的重要指标,是真菌分子系统进化研究的标准.通过测定菌株Cr12的16S rRNA部分序列(登录号为KF646801)并在GeneBank中进行序列的Blast比对,选出部分参比序列进行系统进化树的构建,经鉴定命名分离株为TeratosphaeriaceaeCr12.
由图2可见Cr12在系统进化树上与Teratosphaeriaceaesp.的亲缘关系最近,推测其为同源种.作为outgroup的贝氏硫细菌(Begglatoaalba)某株在进化树上独成一枝,和其他真菌参比序列明显分离,证实了真菌簇的聚类是合理的.
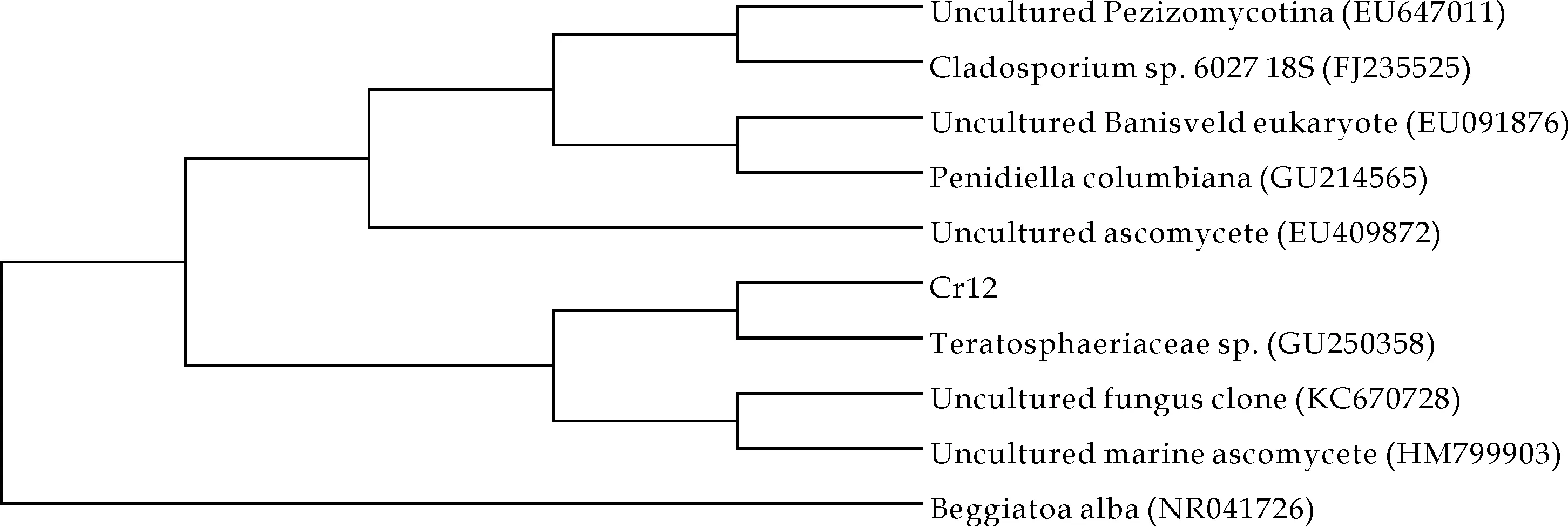
图2 基于18S rRNA的部分以NJ法构建的系统进化树
3.5 发酵条件对菌株Cr12的脂肪酶活力影响
图3为接种量对菌株Cr12的脂肪酶活力的影响.
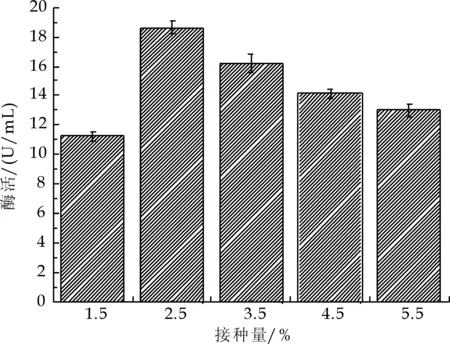
图3 接种量对碱性脂肪酶酶活的影响
由图3可知,当接种量为2.5%时,脂肪酶活力达18.62 U/mL最高.当接种量超过2.5%,酶活开始下降,可能是高接种量带来的种群规模增长过快导致的密度制约.
图4为发酵周期对菌株Cr12的脂肪酶活力的影响.

图4 发酵周期对碱性脂肪酶酶活的影响
发酵周期为72 h时,脂肪酶活力最大,达19.25 U/mL,周期过长会导致酶活的下降,可能是菌株发酵后期其他代谢产物的抑制作用.
图5为发酵温度对菌株Cr12的脂肪酶活力的影响.

图5 发酵温度对碱性脂肪酶酶活的影响
由图5可知,随着培养温度的升高,脂肪酶的活力增大.到 30 ℃时,脂肪酶活力最大,超过30 ℃,酶活下降.因此,适宜的产酶温度为 30 ℃,这基本符合真菌的最适生长温度,但菌株Cr12在35 ℃甚至是40 ℃也有产酶活力,说明该分离株对制革污水的高温表现出适应性.
图6为起始 pH值对菌株Cr12的脂肪酶活力的影响.

图6 初始pH值对碱性脂肪酶酶活的影响
结果表明,培养基起始pH值为6.5左右时,脂肪酶活力最大,为19.78 U/mL.说明脂肪酶产生菌Cr12在中性偏酸条件下有利于脂肪酶的合成和分泌,这也基本符合真菌生存的环境pH值.
图7为种龄对菌株Cr12 的脂肪酶活力的影响.
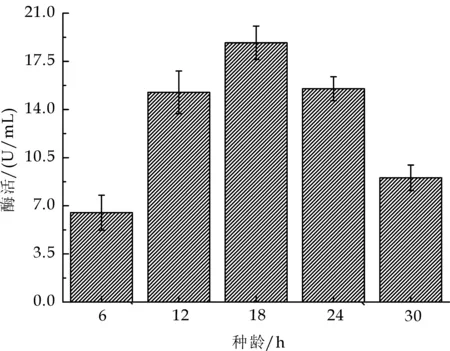
图7 种龄对碱性脂肪酶酶活的影响
结果显示,接种种龄在18 h,脂肪酶活力达 18.85 U/mL.一般接种种龄以对数生长期的后期较为适宜,太年轻的种子接种后往往会出现发酵前期菌体生长缓慢,延长发酵周期 ;过老的种子虽然菌量较多,但接种后菌体会过早自溶,导致生产能力下降.而且一般真菌生长速度较细菌缓慢,所以在种龄适当老于细菌发酵种子效果会好些.
图8为不同保存时间下的酶活,提取酶液后即刻测定酶活最高.
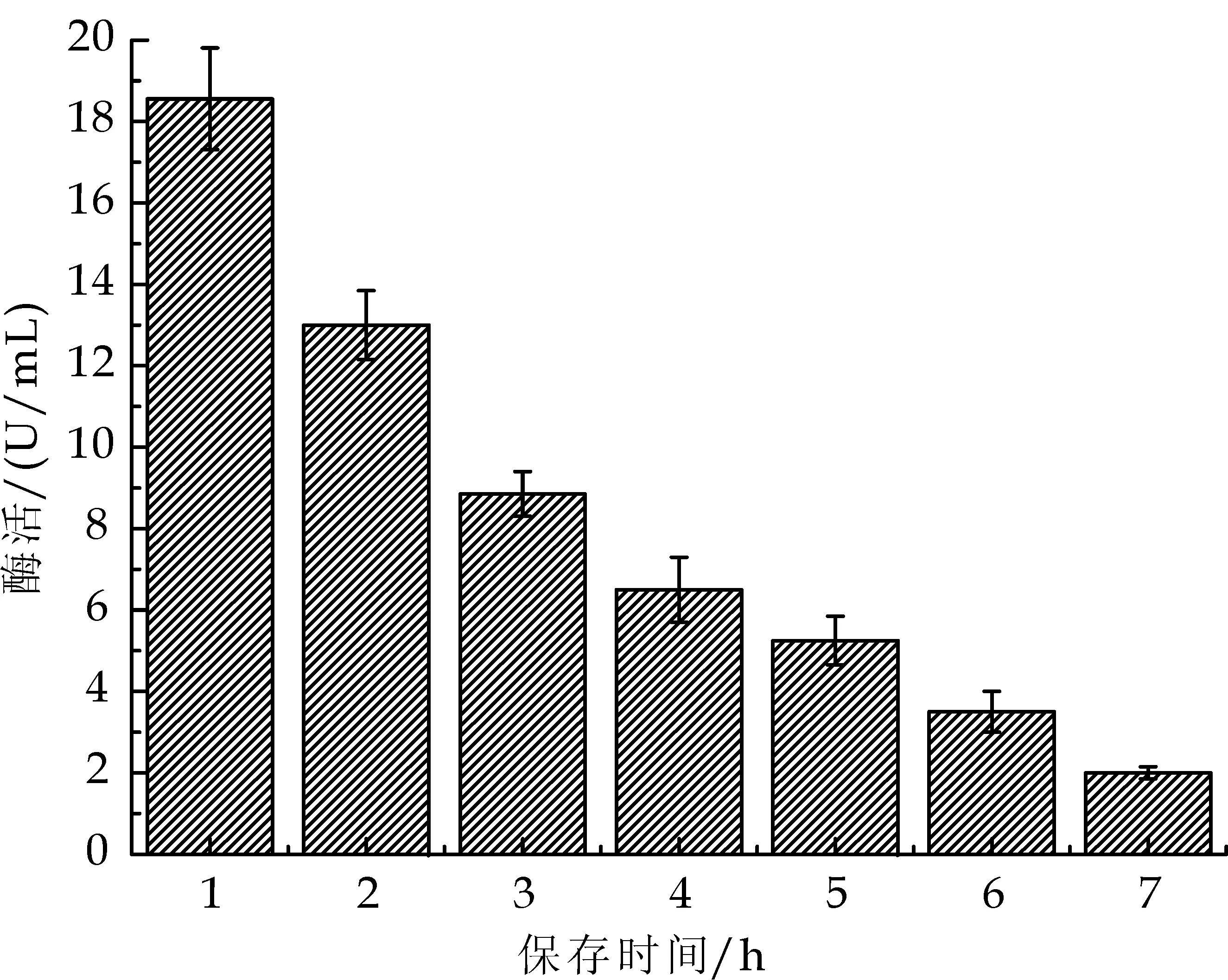
图8 保存时间对脂肪酶酶活的影响
结果显示,当保存时间到从0~3 h时酶活急剧下降至初始酶活的将近50%,保存时间从3~6 h酶活逐渐下降至初始酶活的11%左右.说明菌株Cr12所产生脂肪酶半衰期大概为3 h.
综上可知,本研究所分离菌株Cr12为子囊菌门煤炱目下Teratosphaeriaceae的一种,能够在含铬2.77%的制革污泥中存活,并在高温环境下保持产酶活性,说明极端环境下存在产脂肪酶真菌,这与子囊菌门成员本身代谢速率快[14]、世代时间较短[15]、缺少有性繁殖[16,17]带来的高进化速率和变异性高度相关.
4 结论
本研究利用平板筛选法从含铬制革污泥中筛选出 6株产脂肪酶细菌,进一步测其摇瓶发酵脂肪酶活力,选出一株脂肪酶活力最高的菌株Cr12,通过细菌形态、生理生化特性和分子生物学方法确定其为子囊菌门煤炱目下Teratosphaeriaceae的种属.另外对Cr12产脂肪酶进行了摇瓶发酵优化,得到Cr12最佳发酵条件为初始pH为6.5,培养温度为30 ℃,接种量(V/V)为 2.5% ,发酵周期72 h,脂肪酶活力达到18.62~19.78 U/mL,虽然酶活较之已有研究有些低,但属于特殊工业环境下的产脂肪酶微生物资源的开发,丰富了产脂肪酶微生物家族成员,对于产耐铬脂肪酶编码基因的研究提供了基础.
[1] Grant W D,Heaphy S.Metagenomics and recovery of enzyme genes from alkaline saline environments[J].Environmental Technology,2010,31:1 135-1 143.
[2] Guncheva M,Zhiryakova D,Radchenkova N,et al.Properties of immobilized lipase from bacillus stearothermophilus MC7[J].World Journal of Microbiol Biotechnology,2009,25(4):727-731.
[3] Dharmaraj S.Marine streptomyces as a novel source of bioactive substances[J].World Journal of Microbiol Biotechnology,2010,26(12):2 123-2 139.
[4] Lee H K,Lee J K,Kim M J,et al.Immobilization of lipase on single walled carbon nanotubes in ionic liquid[J].Bulletin of the Korean Chemical Society,2010,31:650-652.
[5] Mitidieri S,Martinelli A H S,Schrank A,et al.Enzymatic detergent formulation containing amylase from Aspergillus niger:a comparative study with commercial detergent formulations[J].Bioresource Technology,2006,97:1 217-1 224.
[6] Jeon J H,Kim J T,Kim Y J,et al.Cloning and characterization of a new cold-active lipase from a deep-sea sediment metagenome[J].Applied Microbiology and Biotechnology,2009,81:865-874.
[7] 谈重芳,王雁萍,陈林海,等.微生物脂肪酶在工业中的应用及研究进展[J].食品工业科技,2006,27(7):193-195.
[8] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-390.
[9] Du W,Li W,Sun T,et al.Perspectives for biotechnological production of biodiesel and impacts[J].Applied Microbiology and Biotechnology,2008,79(3):331-337.
[10] 谭擎天,刘文涛,李国英.制革污泥处理技术的现状及研究进展[J].皮革与化工,2010,27(4):20-25.
[11] 沈 萍,范秀容,李广武,等.微生物学实验[M].北京:高等教育出版社,1999:116-123.
[12] Kim S B,Yoon J H,Kim H,et al.A phylogenetic analysis of the genus Saccharomonospora conducted with 16S rRNA gene sequences[J].International Journal of Systematic Bacteriology,1995,45:351-356.
[13] Rainey F A,Ward-Rainey N,Kroppenstedt R M,et al.The genus Nocardiopsis represents a phylogenetically coherent taxon and a distinct actinomycete lineage:proposal of Nocardiopsiaceae fam.nov[J].International Journal of Systematic Bacteriology,1996,46:28-96.
[14] Rand D M.Thermal habit,metabolic-rate and the evolution of mitochondrial DNA[J].Trends in Ecology & Evolution,1994,9:125-131.
[15] Kohne D E.Evolution of higher-organism DNA[J].Quarterly Reviews Of Biophysics,1970,3:327-375.
[16] Moran N A.Accelerated evolution and Muller′s rachet in endosymbiotic bacteria[J].Proc Natl Acad Sci USA,1996,93:2 873-2 878.
[17] Lynch M,Blanchard J L.Deleterious mutation accumulation in organelle genomes[J].Genetica,1998,103:29-39.
