结核性胸膜炎患者外周血及胸腔积液中CD4+和CD8+ T细胞的活化分析
2013-01-14朱杰华罗军敏叶军秦欢江娟邵云浩
朱杰华,罗军敏,叶军,秦欢,江娟,邵云浩
1. 贵州省遵义医学院免疫学教研室,贵州省免疫学研究生教育创新基地,遵义 563003; 2. 贵阳医学院第二附属医院检验科,凯里 550003; 3. 贵州省遵义医学院医学检验系,遵义 563003; 4. 贵州省遵义医学院医学美容系,遵义 563003
结核性胸膜炎是结核病的一种常见类型,也是目前临床上的常见病。结核分枝杆菌是胞内寄生菌,这就决定了机体抗结核特异性免疫以细胞免疫为主,主要为CD4+和CD8+T细胞免疫[1,2]。CD4+T细胞为辅助性T细胞,通过分泌多种细胞因子调节免疫细胞的增殖、分化和辅助体液免疫应答。CD8+T细胞即细胞毒性T细胞(cytotoxic T lymphocyte,CTL),通过分泌颗粒酶和穿孔素等机制杀伤靶细胞而发挥细胞毒效应。国内外关于CD4+和CD8+T细胞数量在肺结核病中变化的研究比较多,但在结核性胸膜炎中的变化及其活化程度方面的报道较少。本研究拟以结核性胸膜炎为研究对象,探讨患者体内CD4+和CD8+T细胞的变化,并分析细胞的活化水平。
1 材料与方法
1.1 临床资料
选取遵义医学院第一附属医院呼吸二科结核病区临床诊断为结核性胸膜炎初治住院患者30例,其中男性23例、女性7例,年龄(42.85±18.36)岁。所有病例的甲、乙型肝炎病毒感染指标均为阴性,无其他急性感染性疾病。结核性胸膜炎患者诊断标准:按全国结核病分类与诊断标准[3],临床具有结核中毒症状、胸腔积液体征,X线和超声波检查证实有胸腔积液,经胸腔穿刺抽液、胸腔积液检查结果为渗出液,排除其他原因引起的胸膜炎,临床抗结核治疗有效。健康对照组:随机选择15名健康成人,均为接受体检人员,男10例、女5例,年龄(39.1±7.58)岁,肝、肾功能正常,甲、乙型肝炎病毒感染指标均为阴性。
1.2 实验材料
人淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司;RPMI1640培养基、红细胞裂解液等均购自碧云天生物技术研究所;PerCP-Cy5.5-抗人CD3、PE-抗人颗粒酶B、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-抗人CD8、FITC-抗人CD4、PE-抗人白细胞抗原DR(human leukocyte antigen-DR,HLA-DR)等单克隆抗体、固定/破膜缓冲液均购自美国eBioscience公司;低温低速离心机购自苏州安科医疗系统有限公司;生物安全操作台购自Therman公司;流式细胞仪型号FASCalibur,购自美国BD公司。
1.3 实验方法
1.3.1标本处理收集患者入院抗结核化疗前胸腔积液100~200 ml和次日清晨外周静脉血5 ml。胸腔积液以肝素抗凝,外周血以乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝,1 000 r/min离心5 min,上清液-80 ℃保存。沉淀物以等体积的RPMI1640液稀释后,转移至装有2 ml的人淋巴细胞分离液管,密度梯度2 000 r/min离心15 min,吸取淋巴细胞层。用RPMI1640液洗3次后,再以RPMI1640液重悬,并调整细胞浓度为2×106/ml。
1.3.2标本染色取浓度为2×106/ml的细胞悬液,200 μl/管,1管用于CD3、CD4、HLA-DR细胞检测,1管用于CD3、CD8、HLA-DR细胞检测,1管用于CD3、CD8、颗粒酶B细胞检测。按操作说明, 每种抗体加入5 μl,先染表面标记抗体,然后固定、破膜,再染胞内抗体,最后重悬、固定上机。同时做同型对照以排除非特异性抗体的干扰和做单染以调电压。
1.4 检测及结果统计学分析
用流式细胞仪进行检测,分析用其配套的Cellquest软件。所得结果和数据采用GraphPad Prism 5.0软件进行统计分析,数据用mean±SD表示,组间比较采用两独立样本的秩和检验,相关性采用非参数Spearman分析,P<0.05为有统计学意义。
2 结果
2.1 CD3+、CD4+、CD8+ T细胞比例在结核性胸膜炎患者外周血和胸腔积液中的变化及相关性分析
结核性胸膜炎患者外周血中CD3+、CD4+、CD8+T细胞比例较健康对照组显著降低(P<0.05)。患者胸腔积液中CD3+和CD4+T细胞比例较外周血显著升高(P<0.05);CD8+T细胞比例较外周血下降,但无显著差异。患者外周血中CD4+/CD8+T细胞比值<1.5,而胸腔积液中CD4+/CD8+T细胞比值>2。患者外周血CD3+T细胞比例与CD4+T细胞比例无显著相关性,而胸腔积液中两者呈正相关(r=0.602,P<0.05)。结果见表1、图1。
表1各组CD3+、CD4+、CD8+T细胞的比例
Tab.1TheproportionsofCD3+,CD4+andCD8+Tcellsinperipheralbloodandpleuraleffusion

GroupCD3+ T cells (%)CD4+ T cells (%)CD8+ T cells (%)CD4+ T/CD8+ TControl PB53.77±17.4238.89±10.0224.48±6.651.59Patient PB21.47±5.50∗22.55±4.90∗19.70±3.88∗1.14Patient PE78.89±6.37▲57.32±7.18▲17.01±6.003.37
PB, peripheral blood; PE, pleural effusion.*P<0.05 compared with control PB;▲P<0.05 compared with patient PB.

PB, peripheral blood; PE, pleural effusion.
图1CD3+和CD4+T细胞的流式细胞分析图
Fig.1FlowcytometricanalysisofCD3+andCD4+Tcells
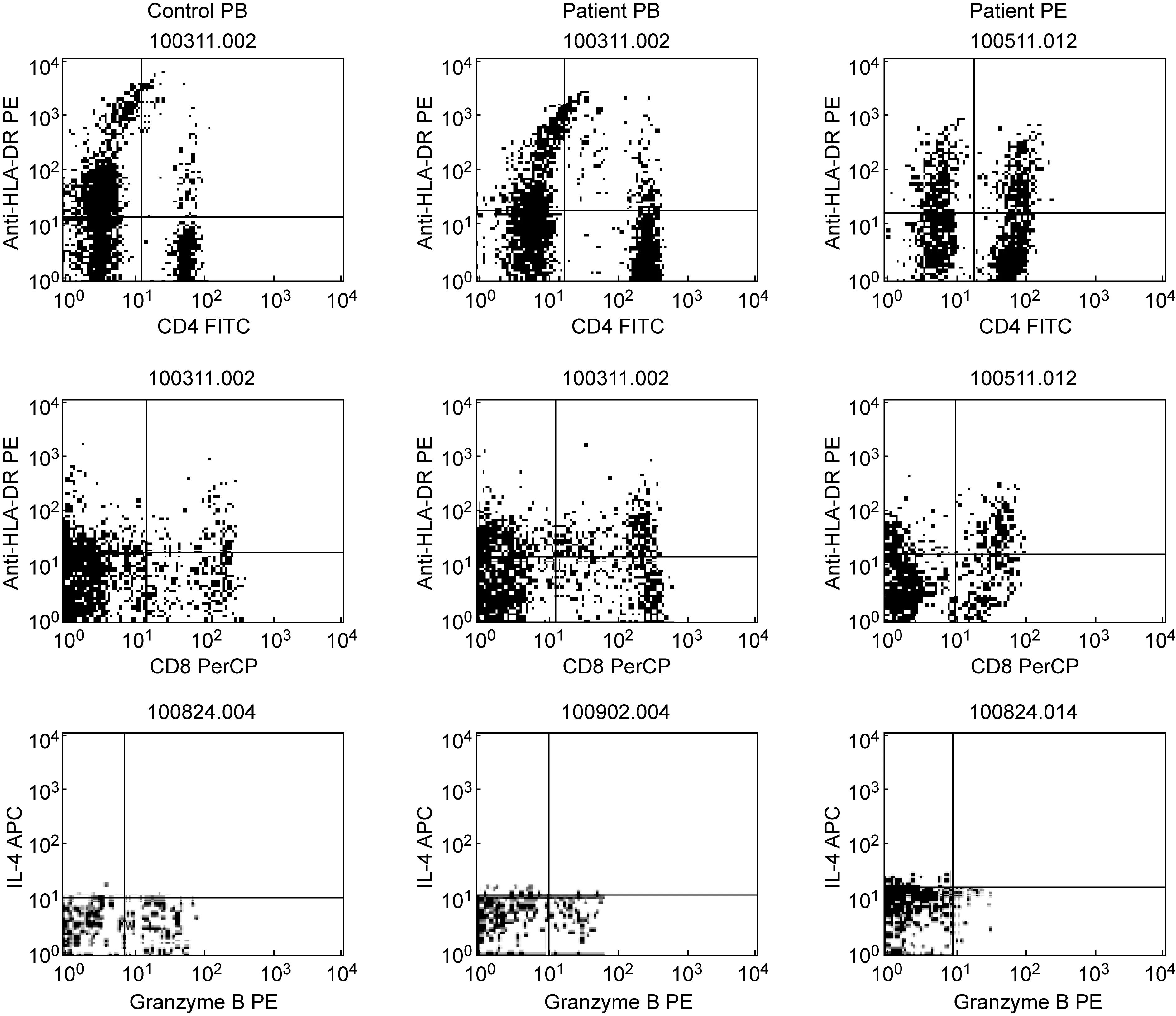
2.2 HLA-DR活化标记和颗粒酶B表达水平在结核性胸膜炎患者外周血和胸腔积液中的变化及CD8+ T细胞与CD8+颗粒酶B+ T细胞的相关性分析
结核性胸膜炎患者外周血中CD4+HLA-DR+和CD8+HLA-DR+T细胞水平显著高于健康对照组。患者胸腔积液中CD4+HLA-DR+和CD8+HLA-DR+T细胞水平显著低于外周血(P<0.05)。患者外周血中CD8+颗粒酶B+T细胞比例显著低于健康对照组。患者胸腔积液中CD8+颗粒酶B+T细胞比例显著低于外周血(P<0.05),外周血中CD8+T细胞比例与颗粒酶B分泌水平呈正相关(r=0.502,P<0.05),但胸腔积液中两者无相关性。结果见图2、3,表2。
PB, peripheral blood; PE, pleural effusion.
图2CD4+和CD8+T细胞HLA-DR活化标记及CD8+T细胞中颗粒酶B水平的流式细胞分析图
Fig.2FlowcytometricanalysisofHLA-DRlevelonCD4+TcellsandCD8+Tcells,andgranzymeBlevelinCD8+Tcells

A: Patients’ peripheral blood (r=0.502,P<0.05). B: Patients’ pleural effusion (r=0.239,P>0.05).
图3结核性胸膜炎患者外周血和胸腔积液中CD8+T细胞比例与颗粒酶B分泌量的相关性分析
Fig.3ThecorrelationofCD8+TcellsandgranzymeBinpatientswithtuberculouspleurisy
表2外周血和胸腔积液中CD4+HLA-DR+、CD8+HLA-DR+和CD8+颗粒酶B+T细胞的水平
Tab.2ThelevelofCD4+HLA-DR+,CD8+HLA-DR+andCD8+granzymeB+Tcellsinperipheralbloodandpleuraleffusion
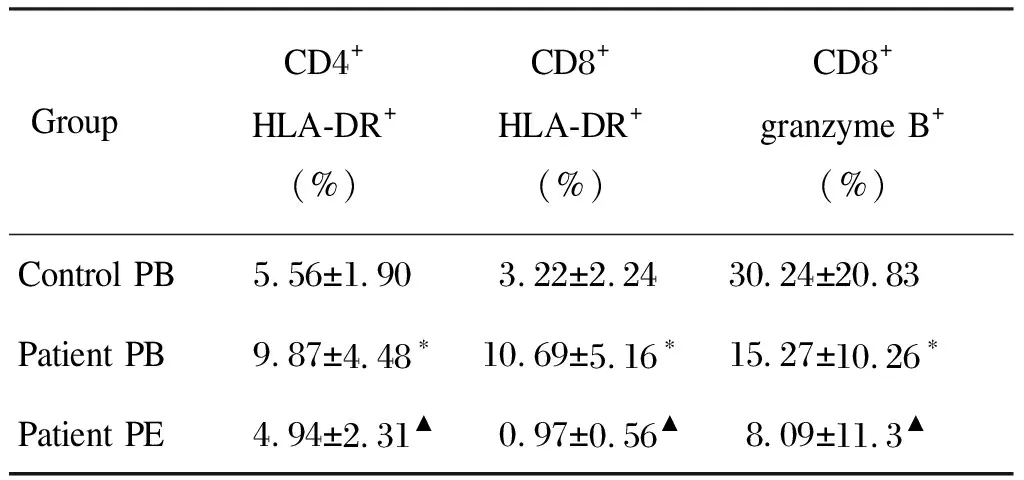
GroupCD4+ HLA-DR+ (%)CD8+ HLA-DR+ (%) CD8+ granzyme B+ (%)Control PB5.56±1.903.22±2.2430.24±20.83Patient PB9.87±4.48∗10.69±5.16∗15.27±10.26∗Patient PE4.94±2.31▲0.97±0.56▲8.09±11.3▲
PB, peripheral blood; PE, pleural effusion.*P<0.05 compared with control PB;▲P<0.05 compared with patient PB.
3 讨论
结核性胸膜炎实际上是一种肺外结核病,与肺结核的关系密切,故目前对其的防治与肺结核有许多共同点,但也有其特殊性。引起结核性胸膜炎必须具备2个条件,即结核分枝杆菌及其代谢产物进入胸膜腔和机体对其具有高度敏感性,两者缺一不可[4]。机体的高度敏感性主要指机体的免疫反应性,抗结核感染特异性免疫主要是T细胞介导的免疫反应。机体维持正常的免疫功能有赖于各种免疫细胞之间相互协作或相互制约,以产生适度的免疫应答,既能清除异物抗原,又不至于损伤机体组织。因此,T细胞亚群数量或比例增加或减少、功能增强或减弱都会直接影响结核分枝杆菌在体内存在的形式,对疾病的发生、发展有重要作用。
CD3+T细胞代表机体的总T细胞,CD4+和CD8+T细胞是结核病患者产生保护性免疫反应的主要效应细胞。CD4+T细胞可通过分泌多种细胞因子促进B细胞、T细胞和其他免疫细胞的增殖与分化,协调免疫细胞间相互作用。根据分泌因子的不同,又可分为多个亚群,在调节免疫应答中扮演着重要角色,在抗感染免疫中发挥重要的免疫防御功能。大量研究证实,在感染性疾病如慢性乙型肝炎、支气管炎、结核病及一些恶性肿瘤患者中,CD4+T细胞数量或比例均低于健康者。Green等[5]还证实,CD4+T细胞下降程度与结核病的严重程度呈正相关。而CD8+T细胞在免疫应答中主要发挥细胞毒作用,可诱导感染后失去免疫活性的靶细胞凋亡,促使结核分枝杆菌暴露及病灶清除[6]。Bold等[7]研究显示,结核病患者体内CD8+T细胞的功能依赖于CD4+T的功能,且两群细胞的比例较健康者明显降低,下降程度也与病情的严重程度呈正相关。因此,CD8+T细胞在抗结核感染免疫应答中的作用不可忽视。另外,有研究表明免疫缺陷是结核性胸膜炎的重要发病因素, 但其发生原因和机制不十分清楚[8]。本研究采用流式细胞仪检测结核性胸膜炎患者外周血和胸腔积液中CD3+、CD4+和CD8+T细胞的比例变化,发现患者外周血中3种细胞的比例较健康对照组显著降低,而患者胸腔积液中CD3+和CD4+T细胞的比例明显高于外周血,胸腔积液和外周血中CD8+T细胞的比例变化不明显,CD4+/CD8+T细胞比值也明显异常,提示结核性胸膜炎患者存在免疫功能紊乱。
T细胞数量的变化一般伴随着功能的改变,辅助T细胞和CTL功能减弱或抑制性T细胞过度活化导致肺结核患者免疫功能低下,引起病情恶化[9,10]。为进一步了解结核性胸膜炎患者整体和局部的免疫细胞功能状况,本研究检测了患者机体CD4+和CD8+T细胞活化信号指标HLA-DR的表达水平,发现患者外周血中CD4+HLA-DR+、CD8+HLA-DR+表达水平显著高于健康对照组;患者胸腔积液中CD4+HLA-DR+、CD8+HLA-DR+表达水平显著低于外周血。HLA-DR属主要组织相容性复合物(major histocompatibility complex,MHC)Ⅱ类分子,表达于活化的免疫细胞表面,参与外源性抗原物质的呈递。本研究结果显示,患者外周血中CD4+和CD8+T细胞比例较健康对照组显著下降,但HLA表达水平显著升高;患者胸腔积液中CD4+T细胞比例较健康对照组显著升高,但HLA表达水平较外周血显著降低,提示患者外周血与胸腔局部的免疫细胞活化水平存在紊乱,这可能是导致免疫功能缺陷的原因之一。最近的一项动物实验还证明,结核分枝杆菌感染后,针对其抗原的特异性T细胞活化发生延迟[11]。同时与抗非结核病原体的免疫应答相比,抗结核分枝杆菌感染的适应性免疫应答也延迟[12]。也有一些研究表明,结核分枝杆菌具有通过抑制细胞活化、凋亡,从而延迟或减弱CD4+和CD8+T细胞的应答能力。
颗粒酶是由CTL和自然杀伤细胞(natural killer cell,NK细胞)释放的胞质颗粒。这些颗粒含有颗粒酶原及其他蛋白酶原,包括穿孔蛋白。由于CTL细胞与靶细胞结合(经靶细胞表面的CTL受体与MHC分子的抗原结合),颗粒内容物释放,颗粒酶和穿孔蛋白进入靶细胞,通过在细胞膜聚合而形成靶细胞膜小孔,使细胞膜穿孔。穿孔蛋白使颗粒酶的膜穿孔,引起颗粒酶释放,从而诱发细胞死亡。CTL可产生多种颗粒酶,但颗粒酶B诱发细胞凋亡的活性最强。故本研究检测CTL内颗粒酶B的表达水平,以进一步评估患者CD8+T细胞功能变化。结果显示,患者外周血中CD8+颗粒酶B+T细胞比例显著低于对照组,患者胸腔积液中CD8+颗粒酶B+T细胞比例显著低于外周血,且患者外周血中CD8+T细胞比例与胞内颗粒酶B水平显著相关。综上结果表明,结核性胸膜炎患者外周血与胸腔积液中的免疫应答存在差异,提示患者可能存在免疫失衡。
[1] Chen YC, Chang HC, Chen CJ, Liu SF, Chin CH, Wu CC, Chao TY, Lie CH, Wang CC, Lin MC. Blood absolute T cell counts may predict 2-month treatment response in patients with pulmonary tuberculosis [J]. Dis Markers, 2010, 28(6): 343-352.
[2] 王爽, 杨恩卓, 王洪海, 沈洪波. 新型抗结核蛋白亚单位疫苗Ag85A-γ干扰素的免疫效果评价[J]. 微生物与感染,2012, 7(3): 164-169.
[3] Davoudi S, Rasoolinegad M, Younesian M, Hajiabdolbaghi M, Soudbakhsh A, Jafari S, EmadiKouchak H, Mehrpouya M, Lotfi H. CD4+cell counts in patients with different clinical manifestations of tuberculosis [J]. Braz J Infect Dis, 2008; 12(6):483-486.
[4] 李春香. 结核性胸膜炎[M].见:曾正国.现代实用结核病学.北京:科学技术文献出版社,2003, 342-348.
[5] Green AM, Difazio R, Flynn JL. IFN-γ from CD4 T cells is essential for host survival and enhances CD8+T cell function during mycobacterium tuberculosis infection [J]. J Immunol, 2013, 190(1): 270-277.
[7] Bold TD, Ernst JD. CD4+T cell-dependent IFN-γ production by CD8+effector T cells in Mycobacterium tuberculosis infection [J]. J Immunol, 2012, 189(5): 2530-2536.
[8] Jo EK, Park JK, Dockrell HM. Dynamics of cytokine generation in patients with active pulmonary tuberculosis [J]. Curr Opin Infect Dis, 2003, 16(3): 205-210.
[9] Ordway D, Henao-Tamayo M, Harton M, Palanisamy G, Troudt J, Shanley C, Basaraba RJ, Orme IM. The hypervirulent Mycobacterium tuberculosis strain HN878 induces a potent TH1 response followed by rapid down-regulation [J]. J Immunol, 2007, 179 (1): 522-531.
[10] Guyot-Revol V, Innes JA, Hackforth S, Hinks T, Lalvani A. Regulatory T cells are expanded in blood and disease sites in patients with tuberculosis [J]. Am J Respir Crit Care Med, 2006, 173(7): 803-810.
[11] Shafiani S, Tucker-Heard G, Kariyone A, Takatsu K, Urdahl KB. Pathogen-specific regulatory T cells delay the arrival of effector T cells in the lung during early tuberculosis[J]. J Exp Med, 2010, 207(7): 1409-1420.
[12] Miller JD, van der Most RG, Akondy RS, Glidewell JT, Albott S, Masopust D, Murali-Krishna K, Mahar PL, Edupuganti S, Lalor S, Germon S, Del Rio C, Mulligan MJ, Staprans SI, Altman JD, Feinberg MB, Ahmed R. Human effector and memory CD8+T cell responses to smallpox and yellow fever vaccine [J]. Immunity, 2008, 28(5): 710-722.
