放射免疫治疗中单克隆抗体药物研究现状
2013-01-10潘俊男程作用
潘俊男, 程作用
(1.成都云克药业有限责任公司,四川 成都 610041;2.成都放射性药物工程技术研究中心,四川 成都 610041)
放射免疫治疗(radioimmuntherapy,RIT)是将放射性核素与肿瘤特异或相关的单克隆抗体(McAb)相连接,形成抗肿瘤免疫耦联物治疗肿瘤的一种方法。目前对恶性肿瘤的治疗仍以传统的放射性疗法和化学疗法为主,但放疗和化疗并不能彻底治愈恶性肿瘤以及延长患者的有效生存时间和降低其死亡率,而基于单抗的靶向治疗以及利用核素标记单抗的RIT却显示出巨大的潜力和应用前景。早在1991年,Magerstadt[1]就指出,作为肿瘤导向治疗药物,单抗耦联核素是单抗免疫耦联物中最有希望的一种。2003年,Press[2]再一次指出,当前低度非霍奇金淋巴瘤(non-Hodgkin’s lymphona,NHL)治疗最有希望的药物之一是核素标记的抗体[2]。
靶向治疗用单抗主要有两种作用方式。1)直接作用:通过抗体依赖性细胞毒(ADCC)和补体依赖性细胞毒(CDC)的细胞溶解效应杀伤肿瘤细胞。2)间接作用:单抗作为靶向载体,将化疗药物、毒素、核素等细胞毒药物与单抗耦联。RIT的作用机理主要是间接作用。利用针对肿瘤相关特异性抗体作为核素载体,标记核素后注入体内与肿瘤细胞相应抗原特异性结合,使肿瘤组织内浓聚大量的核素,通过射线的电离辐射作用破坏或干扰肿瘤细胞的结构及功能,起到抑制、杀伤或杀死肿瘤细胞的作用。
1 用于RIT的核素
用于RIT核素应具备的条件包括:1)适中的半衰期、能量和组织射程;2)标记方法简单易行;3)标记后不影响McAb的免疫活性,且单位McAb 携带核素的量足够大;4)价格便宜[3]。满足这些条件的核素有多种,例如131I、188Re、90Y、177Lu、213Bi、211At、225Ac、125I和111In等,按发射射线种类不同可分为:1)发射β射线的核素;2)发射α射线的核素;3)发射俄歇电子(EC)的核素(表1)[4]。
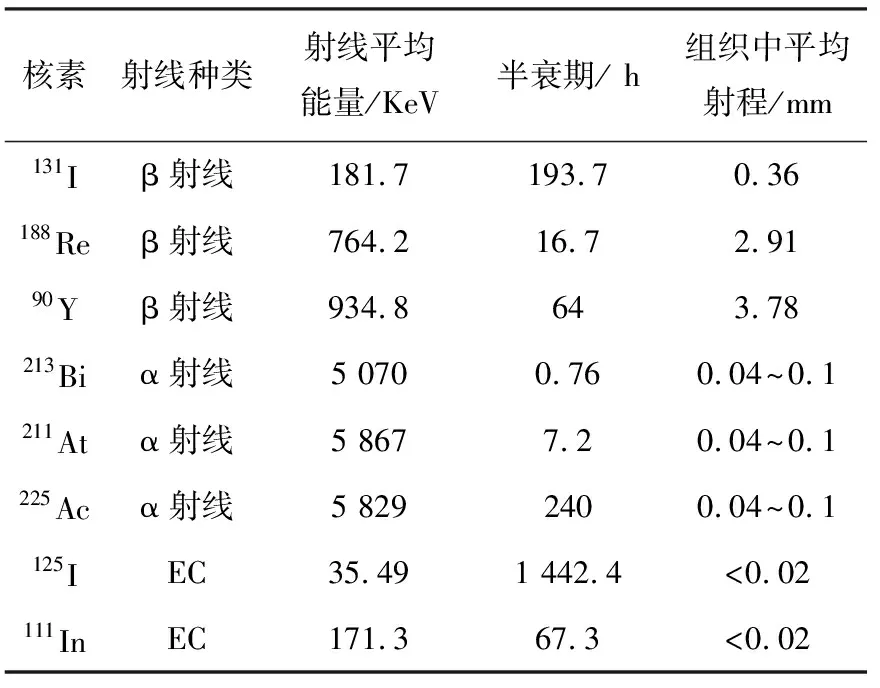
表1 用于RIT的核素性质
2 用于RIT的单抗
目前用于RIT的单抗都是用来治疗肿瘤疾病的,根据靶点不同可以分为:抗CD20单抗、抗CD22单抗、抗CD33单抗、抗表皮生长因子受体2 (human epidermal growth factor receptor-2,HER2)单抗等,其中前三种主要用来治疗血液循环系统恶性肿瘤,抗HER2单抗主要用于治疗乳腺癌。
2.1 抗CD20单抗
CD20表达于除浆细胞外发育分化各阶段的B细胞表面,通过调节跨膜钙离子流动直接对B细胞的增殖和分化起调节作用[5]。Roche公司研发的以CD20为靶点的利妥昔单抗(Rituximab)是FDA批准的第一个治疗淋巴癌的人鼠嵌合单抗,自1997年在美国获准上市以来一直位列全球畅销药前列,其2010年的全球销售额更是达62亿美元。近十年来,抗CD20的单抗药物开发方兴未艾。GLaxoSmithKline与Genmab联合开发的抗CD20单抗ofatumumab于2009年上市,临床试验数据显示,对于复发性/难治性B细胞型慢性淋巴细胞性白血病患者,其临床有效率达63%[6]。2010年8月,LFB Biotechnologies开发的重组抗CD20单抗(LFB-R603)被FDA授予罕用药资格,用于治疗慢性淋巴细胞性白血病[5]。另外,由Genentech、GlycArt 和Roche联合开发的人源化抗CD20单抗RG7159(GA101)已进入III期临床试验,并有望用于治疗与B细胞相关的癌症,如非霍奇金淋巴瘤和慢性淋巴细胞性白血病等[5]。
2.2 抗CD22单抗
抗原CD22 是一种跨膜唾液酸糖蛋白,仅表达于分化成熟期B细胞表面,对B细胞的生长、存活和功能起重要作用。CD22在99%的NHL细胞中均有表达,而B细胞在自身免疫性疾病的发病机制中也发挥重要作用[7]。Epratuzumab ( IMMU-103,AMG-412,IMMUhLL2,LymphoC ideTM )是人源化抗CD22单抗,可通过与CD22结合而抑制B细胞产生抗自身蛋白抗体。它最初由Immunomedics公司开发用于治疗SLE(进入III期临床试验) 以及Waldenstrem巨球蛋白血症、Sjegren综合征和CD22阳性小儿急性淋巴细胞白血病(进入I/II期临床试验),其用于NHL的II期临床研究也已获得阳性结果[7]。
2.3 抗CD33单抗
抗原CD33高度表达于90%急性骨髓系白血病(AML)患者的髓系白血病细胞表面,可能是AML特异性治疗的理想靶点[8]。吉妥珠单抗(mylotarg,gemtuzumab)为人源化的CD33单抗与卡奇霉素的免疫连接物。2000年5月吉妥珠单抗被FDA批准作为治疗年龄大于60岁、首次复发的AML患者。但临床应用中未发现吉妥珠单抗在疗效上有改善,而且使用吉妥珠单抗患者的死亡数要高于只接受化疗的患者[9]。使用吉妥珠单抗的患者患肝小静脉闭塞病的几率要高于FDA批准该药时的数据,这是一种严重的肝脏疾病,有致命危险[10],因此本产品已经于2010年退市。
2.4 抗HER2单抗
HER2为相对分子质量185 000的跨膜受体样蛋白,具有酪氨酸激酶活性[11]。目前已有针对该基因过度表达的单抗药物—赫赛汀(Herceptin)。赫赛汀是重组DNA人源化的单抗,其作用靶点是HER2基因调控的细胞表面P185糖蛋白,可与HER2受体细胞外近膜区结合,阻止细胞内酪氨酸激酶的活化。Viloria等[12]对过度表达HER2乳癌动物模型的研究表明,赫赛汀可通过调节促血管生成和抗血管生成因子诱导血管结构正常化和复原来抑制血管生成。2011年美国临床肿瘤学会年会(ASCO)上,Chang等[13]报告了关于拉帕替尼联合赫赛汀(不联合化疗)治疗HER2 过度表达乳腺癌的Ⅱ期临床试验结果,在无化疗药物情况下,也可显著改善患者病情。全组64例HER2 阳性乳腺癌患者总有效率为75%,完全缓解率和部分缓解率分别为31%和44% 。2012年ASCO会议上,美国杜克癌症研究所的Kimberly L博士报告的抗体-药物共轭新药T-DM1III期随机试验结果表明,T-DM1用于进展期HER2阳性乳腺癌比标准治疗更有效,毒性也更小[14]。其中T-DM1是赫赛汀和化疗药物DM1的抗体耦联药。2010年10月Roche制药宣布,赫赛汀继成功用于HER2阳性乳腺癌治疗后,继续在胃癌治疗领域实现重大突破。2012年8月,赫赛汀联合化疗正式被中国食品药品监督管理局(SFDA)批准用于HER2阳性转移性胃癌的一线治疗[15]。这意味着我国胃癌治疗进入了分子靶向时代。
3 RIT药物
目前RIT药物主要用于血液循环系统恶性肿瘤治疗,其次应用于乳腺癌、肺癌、肝癌、脑癌、甲状腺癌及卵巢癌等其他实体恶性肿瘤的治疗。
3.1 血液循环系统恶性肿瘤RIT药物
恶性肿瘤细胞对放射线具有较高的敏感性,而血液循环系统恶性肿瘤靶癌细胞又主要位于血液、骨髓及淋巴结内,核素标记抗体容易到达这些位置,故疗效好。Zevalin(90Y-ibritumomab)和Bexxer(131I-tositumomab)是分别由Spectrum Pharms和GSK公司开发的放射免疫耦联物,分别于2002年和2003年上市。相比于利妥昔单抗(美罗华),Zevalin和Bexxer在治疗低级别、形态改变的和侵袭性的NHL有更好的疗效并用于化疗或美罗华治疗后复发和难治性低级别滤泡或转化的B细胞NHL[16]。难治性患者或者抵抗化疗和利妥昔单抗的患者,在Zevalin和Bexxer治疗后获得长期缓解。Zevalin的主要不良反应为可逆性的骨髓抑制。由于131I半衰期较长,Bexxar 的骨髓抑制更加明显,同时因为131I还发射γ射线,接受Bexxar治疗的患者必须隔离。此外,由Bayer Schering Pharma公司进行的Zevalin治疗弥漫性大B细胞淋巴瘤已经进入III期临床实验(表2)[17]。Sharkey 等[18]研究了DOTA螯合的111In和90Y-epratuzumab在NHL患者体内的生物分布和肿瘤靶向性、药物代谢动力学、剂量和抗抗体反应,结果表明,治疗效果与血液中的放射性剂量和外显影所见的肿瘤靶向性和尺寸无关。Linde等[19]研究了应用90Y-DOTA-epratuzmab进行逐步RIT,发现该疗法一方面可以减少病人服用的药物剂量、血液毒性,另一方面可以增加核素使用量,结果提示,90Y-DOTA-epratuzmab是一个非常有希望的NHL治疗药物。因CD33表达于80% ~ 90%血液细胞,而在造血干细胞和非造血细胞中不表达,所以是白血病治疗的理想靶点。131I、90Y 和213Bi标记抗CD33单抗( HuM195)耦联物均处于I、II期临床试验阶段。90Y-HuM 195的I期临床试验结果表明,其可用于自体干细胞移植及非清髓性异基因干细胞移植预处理。Actinium Pharmaceuticals开发的225Ac-HuM195和213Bi-HuM195分别于2009年进入临床I期和II期研究[17],由于213Bi产生α射线射程很短,杀灭的肿瘤细胞数量有限,213Bi-HuM195对难治复发的AML疗效不明显,更适合于低负荷AML 治疗及残留病灶的清除。Jurcie等[20]用213Bi-HuM195治疗18例难治复发的AML及CML患者,虽然67.7%的患者获得部分缓解(PR),但存在一定的安全性问题,已终止研究。目前在研的核素标记单抗药物中,60%的适应症是血液循环系统恶性肿瘤,均已进入II期临床试验(表2)[17],可以预见未来核素标记单抗药物将在血液循环系统恶性肿瘤的治疗中发挥重要作用。
3.2 乳腺癌RIT药物
赫赛汀是RIT 良好的核素载体。采用Iodogen 法对Herceptin进行131I 标记的标记率高,所制备的131I-Herceptin 的放化纯度能达到RIT 的要求(放化纯度可达95%),比活度适中,既保证了足够的放射性活度,又避免了过高的活度对单抗的辐射损伤。Herceptin经131I标记后,其细胞结合能力仍然很高,与HER2高表达的肿瘤细胞特异性结合能力强。杨志学[21]对荷人乳癌裸鼠模型的研究证实,131I-Herceptin对HER2高表达的乳癌组织具有很高的靶向性,能明显抑制荷人乳癌裸鼠模型肿瘤的生长。188Re和90Y对Herceptin的标记较131I 复杂,可采用直接与间接两种方法。间接连接又有多种耦联剂可供选择,其中最常用的为DTPA,尚无统一的最佳标记方式。在一些研究中[22-23]90Y-Herceptin和188Re-Herceptin的放化纯度及标记后单抗的免疫活性也均达到了RIT的要求,90Y-Herceptin和188Re-Herceptin均可显著抑制HER2过表达肿瘤的生长。体外或动物实验已证实[24],一些发射α射线的核素,如225Ac、211At、213Bi 等标记的Herceptin具有抑制HER2 过表达乳癌生长作用。然而,由于其组织穿透力弱,细胞对单抗-核素耦联物的内化及细胞核的大小对其RIT效果影响较大。标记时耦联剂的选择仍存在问题,而且发射α射线核素的来源不如发射β射线的方便,具有复杂的子核素等问题,使α核素的应用受到限制。
单抗-核素耦联物在靶细胞是否内化直接影响核素保留时间,进而影响疗效。2007年,Danny等[25]用111In标记核定位序列(NLS)修饰的Herceptin单抗,其中NLS为蛋白质的一个结构域,通常为短氨基酸序列,能与单抗相互作用,使单抗转运进细胞核,从而实现单抗的细胞内化。Danny等的研究结果表明,111In-NLS-Herceptin的标记解离常数比111In-Herceptin的降低了3倍,证明其具有更好的标记稳定性。进一步的细胞实验表明,111In-NLS-Herceptin的内化率是111In-Herceptin的8倍,其对肿瘤细胞的杀伤力提高了2~5倍。由此可见111In-NLS-Herceptin具有强的杀伤力和靶向性,为未来开发核素标记单抗提供了一种新思路。
3.3 其他实体恶性肿瘤的RIT药物
唯美生(131I-chTNT)经SFDA批准用于放化疗失败的晚期肺癌治疗。TNT抗体仅锁定实体瘤的变性坏死组织,唯美生与肿瘤细胞核抗原结合,131I杀伤坏死区边缘的肿瘤活细胞,造成新的坏死,接着唯美生扩展到新的坏死区,周而复始地使肿瘤坏死区不断扩大,由内向外摧毁肿瘤,达到治疗目的。临床治疗表明,唯美生的治疗总有效率为35%,相比其他药物治疗的有效率10%有了大幅度提高[26]。
由华神生物和第四军医大学联合研制的利卡汀(131I-美妥昔单抗注射液)用于靶向治疗肝癌。美妥昔单抗HAb18可与分布在肝癌细胞膜蛋白中的HAb18G抗原结合,将其荷载的核素131I载带到肿瘤部位,从而产生抗肿瘤作用。采用选择性插管给药或在靶血管中埋泵给药也获得了较满意的结果,64.5%的患者有部分缓解,患者的生存质量和生存期都得到了明显改善[27]。
脑胶质瘤的手术后容易复发,且恶性程度高。Zalutsky等[28]报道了用211At标记嵌合的81C6单抗,18名恶性脑肿瘤患者腔内注射剂量不等(74 MBq~370 MBq)的211At-chMab,平均96.7%ID/g停留在局部,血中的药物剂量占注射剂量小于0.26%,未见毒性反应,18例病人平均生存期56.5周,优于传统的治疗方法(25~30周)。Paganelli等[29]报道了采用90Y-DOTA-生物素三步预定位法治疗19例确诊且腱生蛋白染色阳性的Ⅲ~Ⅳ级恶性神经胶质瘤的病例,使用的90Y剂量达1.48 GBq/m2~2.96 GBq/m2时未见急性毒副作用,肿瘤平均剂量为(1 520±870) cGy,肝、肾、脑和骨髓吸收剂量分别为(150±100) cGy。
采用131I 高效碘标记法标记自制的抗胃癌鼠单抗(MG7),标记率约90%,在胃镜下局部多点注射给药,靶与非靶放射性摄取比平均2.4~11.2,标记抗体在瘤内滞留8 d~17 d,而用同法注射游离131I 的靶与非靶放射性摄取比为1.3,仅在瘤内滞留2 d~5 d[30]。可见单抗可以明显增加标记核素在靶器官的摄取比和滞留时间。
RP215单抗具有抗OC-3-VGH卵巢癌细胞的作用。Gregory等[31]进行了裸鼠实验,发现经过注射未标记的RP215(剂量:10 mg/kg),15 d后裸鼠卵巢肿瘤(OC-3-VGH卵巢癌细胞)的大小与对照组相比减少了50%。而将RP215用131I标记后再进行同样的实验,发现在相同剂量(剂量:10 mg/kg;活度:12.5 μCi/mg)相同时间内,其肿瘤减小为对照组的约70%,可见用放射性核素标记能进一步增强单抗抑制肿瘤的作用。
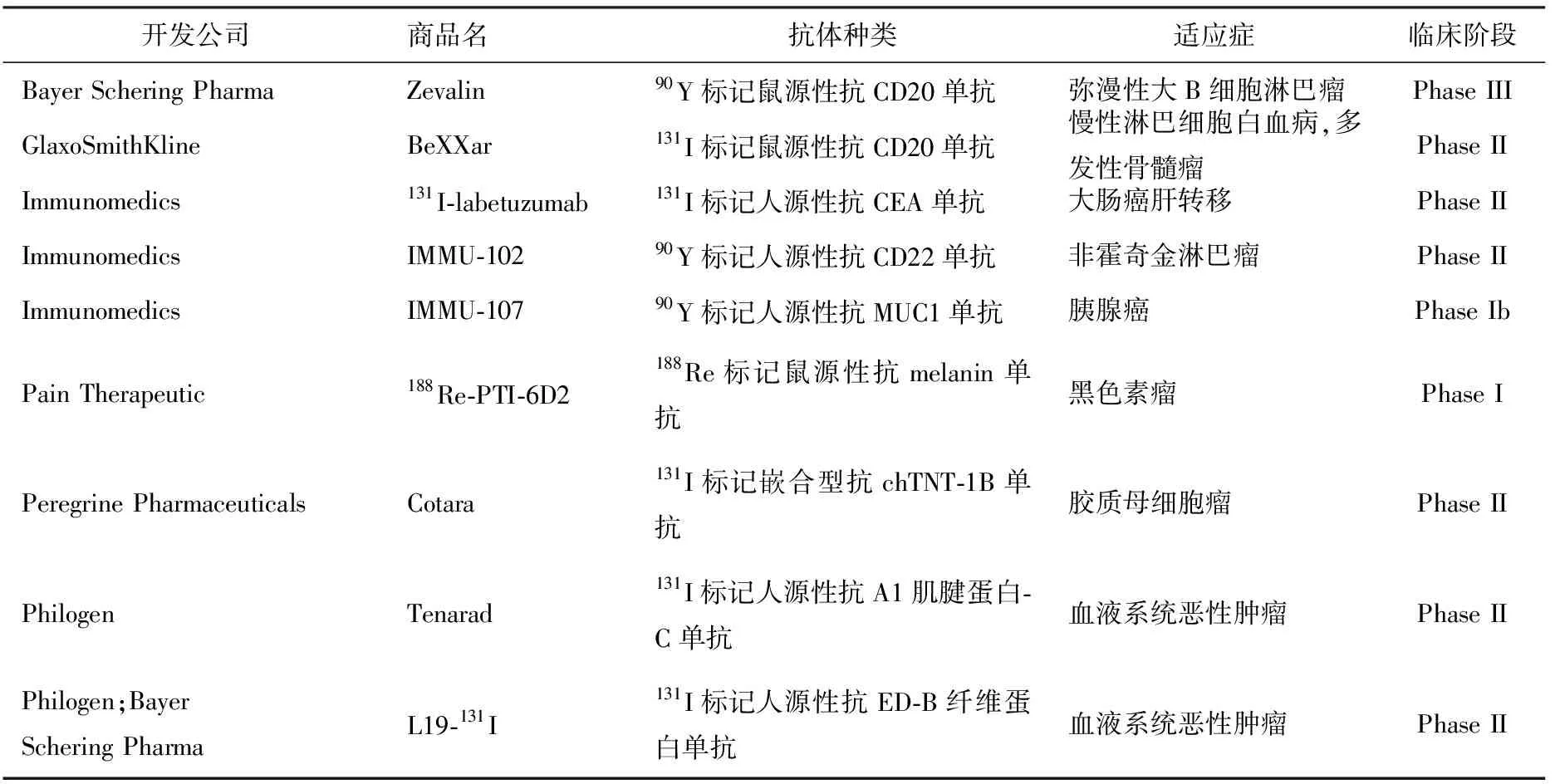
表2 国外在研的主要RIT药物
4 结束语
综上所述,目前RIT在肿瘤治疗方面取得了显著进展,但主要应用于血液循环系统肿瘤的治疗,而对实体瘤的治疗并未广泛应用,主要原因是抗体对实体瘤的靶向性不强,往往肿瘤对抗体的实际摄取率低于0.05%。这使PIT应用于实体瘤治疗时难度较大。科学家已经采取多项技术来达到增加抗体靶向性的目的,如抗体的细胞内化、靶抗原的上调、生物素-亲和素预定位技术及增加肿瘤细胞血流和通透性等技术。另外,鼠源性抗体的应用会产生HAMA反应,因此RIT药物开发的目标之一是制备出符合RIT治疗用的人源性抗体,降低免疫原性,减少或消除HAMA反应。相信通过基因技术等进一步发展必将促进RIT进入更广泛的临床应用。
参考文献:
[1]Magerstadt M. Antibody Conjugates and Malignant Disease[M].CRC Press: Boca Raton, 1991: 42-45.
[2]Press OW. Radioimmunotherapy for non-Hodgkin's lymphomas: A historical perspective[J].Seminars in Oncology, 2003, 30(2): 10-21.
[3]张迎,袁胜利. 曲妥珠单抗在乳癌放射免疫治疗的研究进展[J]. 齐鲁医学杂志, 2011 , 26(4):372-376.
Zhang Ying, Yuan Shengli. Research progress of trastuzumab in breast cancer radioimmunotherapy[J]. Medical Journal of Qilu, 2011, 26(4):372-376(in Chinese).
[4]Andrew BC, Brechbiel MW. Development of rad-ioimmunotherapeutic and diagnostic antibodies:an inside-out view[J]. Nuclear Medicine and Biology, 2007, 34: 757-778.
[5]CD20:单抗药物的“宠儿” [EB/OL][2011-06-17].http://www.51atgc.com/BioSpecial/Mantibody/2011-06-17/9810_2.html.
[6]Hagenbeek A, Plesner T, Johnson P, et al. Hu Max-CD20,a novelfully human anti-CD20 monoclonal antibody: Results of a phase I/II trial in relapsed or refractory follicular non-Hodgkin's lymphoma[J]. Blood, 2005, 106(4): 4 760.
[7]康银花, 范鸣. 抗CD22单克隆抗体Epratuzumab[J]. 药学进展, 2009, 33(3): 138-139.
Kang Yinhua , Fan Ming. Anti-CD22 monoclonal antibody Epratuzumab[J]. Progress in Pharmaceutical Sciences, 2009, 33(3): 138-139(in Chinese).
[8]Legrand O, Perrot JY, BaudardM, et al. The Immunophenotype of 177 Adluts with AcuteMyeloid Leukemia: Proposal of a Prognostic Score[J]. Blood, 2000, 96(3): 870-877.
[9]FDA: Pfizer Voluntarily Withdraws Cancer Treatment Mylotarg from US Market[EB/OL] (2010-06-22).http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm216448.htm.
[10]Mylotarg[EB/OL]. [2008-06-24].http://www.rxlist.com/mylotarg-drug.htm.
[11]Valabrega G, Aglietta M. Trastuzumab: mechanism of action, resistance and future perspectives in HER2-over expressin g breast cancer[J]. Annals of Oncology, 2007, 18(6): 977-984.
[12]Viloria PA, Crombet T. Acquired resistance to the antitum or effect of epidermal growth factor receptor-blocking antibodies in vivo: a role f or altered tumor angiogenesis[J]. Cancer Research, 2001, 61: 5 091-5 101.
[13]Chang JC,Mayer IA,Forero-Torres A, et al. TBCRC 006:a multicenter phase Ⅱ study of neoadjuvant lapatinib andtrastuzumab in patients with HER2-overexpressing breastcancer:2011 ASCO Annual Meeting, McCormick Place in Chicago: 2011[C]. Chincago: American Society of Clinical Oncology, 2011: 505.
[14]张冰.T-DM1治疗进展期HER2阳性乳腺癌优于卡培他滨+拉帕替尼[EB/OL] (2012-06-06). http://www.chinapharm.com.cn/html/kyxx/1338948602156.html.
[15]陈静.中国首个晚期胃癌靶向药物上市[EB/OL] (2012-10-15). http://www.chinapharm.com.cn/html/kyxx/1350267351874.html.
[16]Kainski MS, Zelenetz AD, Press OW, et al. Pivotal study of iodine I131 tositumomab for chemotherapy refractory low-grade or transformed low-grade B-cell non-Hodgk in’s lymphomas [J]. American Society of Clinical Oncology, 2001, 19(19): 3 918-3 928.
[17]Mark C.Via. Monoclonal Antibodies:Pipeline Analysis and Competitive Assessment[M]. Cambridge Healthtech Institute, 2009: 96-98.
[18]Sharkey RM, Brenner A, Burton J, et al. Radioimmunotherapy of non-Hodgkin′s lymphoma with90Y-DOTA humanized anti-CD22 IgG (90Y-Epratuzumab): do tumor targeting and dosimetry predict therapeutic response? [J].Journal of Nuclear Medicine, 2003, 44: 2 000-2 018
[19]Linden O, Hindorf C, Cavallin-Stahl E, et al. Do-se-fractionated radioimmunotherapy in non-Hodgkin′s lymphoma using DOTA-conjugated,90Y-radiolabeled, humanized anti-CD22 monoclonal antibody, epratuzumab[J]. Clin Cancer Research, 2005, 11: 5 215-5 222.
[20]Jurcic JG, Larson SM, SgourosG, et al.Targeted alpha particle immunotherapy for myeloid leukemia[J]. Blood, 2002, 100: 1 233-1 239.
[21]杨志学,蒋国勤.131I-Hercentin在乳腺癌裸鼠模型中的体内分布[J]. 苏州大学学报(医学版), 2011, 31(6): 909-911.
Yang Zhixue, Jiang Guoqin. Biodistribution of131I-Hercentin in Breast Cancer Xenograft[J]. Suzhou University Journal of Medical, 2011, 31(6): 909-911(in Chinese).
[22]Zhang Xiao. Novel therapeutic approaches for ma-mmary cancer[J]. Dissertation Abstracts International, 2007, 68(6): 3 706.
[23]Griffths GL, Goldenberg DM, Knapp FF, et al. Direct radiolabeling of monoclonal antibodies with generator-produced rhenium-188 for radioimmunotherapy: labeling and animal biodistribution studies[J]. Cancer Research, 1991,51(17): 4 594-4 602.
[24]Allen BJ, Rizvi SLY. In vitro and preclinical tarteged alpha therapy for melanoma, breast , prostate and colorectal cancers[J]. Crit Rev Oncol Hematol, 2001, 39(1-2): 139-146.
[25]Danny L, Costantini CC.111In-Labeled Trastuzumab (Herceptin) Modified with Nuclear Localization Sequences (NLS): An Auger Electron-Emitting Radiotherapeutic Agent for HER2/neu-Amplified Breast Cancer[J]. Journal of Nuclear Medicine, 2007, 48:1 357-1 368.
[26]王禹冰. 关于全球首个肺癌放射免疫治疗新药——唯美生Vivatuxin[EB/OL] (2011-10-08). http://www.haodf.com/zhuanjiaguandian/wyb95117_528615866.htm.
[27]郭晓东, 孙婷, 李珊珊. 碘[131I]美妥昔单抗注射液联合TACE治疗原发性肝癌的效果分析[J]. 中国现代医学杂志, 2011, 21(10): 1 206-1 208.
Guo Xiaodong, Sun Ting, Li Shanshan. The effect of iodine[131I] metuximab injection combined with TACE on primary liver cancer[J]. China Journal of Modern Medicine, 2011, 21(10): 1 206-1 208(in Chinese).
[28]Zalutsky MR, Reardon DA, Akabani G et al. Clinical Experience with Particle Emitting211At: Treatment of Recurrent Brain Tumor Patients with211At-Labeled Chimeric Antitenascin Monoclonal Antibody 81C6[J]. Journal of Nuclear Medicine, 2007, 49(1): 30-38.
[29]Paganelli G, Chinol M. Radioimmunotherapy: is avidin-biotinpret argeting the preferred choice among pretargeting methods?[J]. Journal of Nuclear Medicine, 2003, 30: 773.
[30]汪静, 邓敬兰. RIT在肿瘤临床治疗中的应用[J]. 同位素, 2000, 13(4): 239-242.
Wang Jing, Deng Jinglian. Application of RIT in Clinical Therapy of Tumors[J]. Journal of Isotopes, 13(4): 239-242(in Chinese).
[31]Gregory Lee, Rui-Ai Chu, Hong Hoi Ting. Preclinical assessment of anti-cancer drugs by using RP215 monoclonal antibody[J]. Cancer Biology & Therapy, 2009, 8(2): 161-166.
