亚甲蓝光动力疗法联合阿霉素治疗乳腺癌的实验研究*
2013-01-07佟仲生刘晓东史业辉李淑芬郝春芳
佟仲生 刘晓东 史业辉 李淑芬 王 忱 郝春芳
近年来,随着新型光敏剂和激光设备的研制开发迅速发展,光动力疗法(photodynamic therapy,PDT)因其特异性高、选择性强、并发症少以及不良反应小等优点,使其成为继手术、放疗和化疗后的又一项治疗肿瘤的重要方法。亚甲蓝(methylene blue,MB)作为一种古老的药物,目前已广泛应用于解毒、镇痛、染色标记等临床工作中[1-3]。自发现其光动力治疗作用以来,因其经济、无需避光、吸收光谱宽、安全等优势,成为光动力治疗研究的热点之一。PDT联合化疗已经成为世界研究的热点,但是大部分研究主要限于空腔脏器肿瘤,对于乳腺癌等实质脏器的研究尚少,且其抗肿瘤的机制尚未完全清楚[4]。本研究通过体外及体内实验研究,初步探讨亚甲蓝介导的光动力疗法及联合阿霉素对乳腺癌的抗肿瘤作用及其机制,为其治疗乳腺癌的临床应用提供新思路。
1 材料与方法
1.1 材料
632 nm半导体激光光动力治疗仪购自天津市雷意激光技术有限公司。亚甲蓝购自美国Sigma公司,4℃避光保存,PBS配制成10 mM的母液,使用时以RPMI 1640稀释成不同浓度工作液。胎牛血清、胰蛋白酶、RPMI 1640细胞培养基购自美国Hyclone公司。MTT购自美国Sigma公司。Rhodamine 123购自江苏碧云天公司。凋亡流式试剂盒购自美国BD公司。小鼠乳腺癌细胞系4T1由天津医科大学附属肿瘤医院免疫室馈赠。BALB/c小鼠购自军事医学科学院。
1.2 方法
1.2.1 MTT比色法检测细胞生长抑制情况 将对数生长期的4T1细胞随机分为空白对照(control)组、阿霉素(adriamycin,ADM)组、光动力治疗(PDT)组及联合治疗组(PDT+ADM)。每组设3复孔。ADM组:加入使用完全培养基(含90%RPMI 1640及10%胎牛血清)配制的不同浓度梯度(0.25、0.50、1.00、2.00、4.00 μg/mL)的阿霉素;PDT组:加入使用RPMI 1640培养液配制的不同浓度梯度(5、10、15、20、25 μM)的亚甲蓝,孵育3h后给予激光照射;联合治疗组:加入使用完全培养基配制的浓度为0.50 μg/mL的阿霉素孵育24h,再加入使用RPMI 1640培养液配制的不同浓度梯度(5、10、15、20、25 μM)的亚甲蓝,孵育3 h后给予激光照射。PDT组及联合治疗组光照能量密度为2.5 J/cm2,光照结束后更换为完全培养基继续培养16 h。各孔加入5 mg/mL MTT溶液20 μL,孵育4 h,弃上清,加入DMSO 150 μL,置摇床上充分震荡10 min,使结晶充分溶解。选择562nm波长,在酶联免疫检测仪上测定各孔OD值。
1.2.2 流式细胞术检测细胞凋亡及坏死 取对数生长期的4T1细胞,接种于6孔板,孵育过夜。给予不同组别相应处理:ADM组浓度为0.50 μg/mL,PDT组MB浓度为15 μM,联合治疗组ADM及MB浓度分别为0.50 μg/mL及15 μM,具体给药方法及激光照射参照上述MTT实验。激光照射结束后弃去原RPMI 1640培养液,换加完全培养基3 mL,继续孵育细胞24h。24 h后消化收集细胞,1 000 rpm离心5 min,PBS洗涤2次;加入Annexin V-FITC及PI各5 μL,避光孵育15 min,加入缓冲液400 μL,送检。
1.2.3 线粒体膜电位变化检测 取对数生长期的4T1细胞,接种于6孔板,孵育过夜,给予不同组别相应处理(同凋亡及坏死检测实验),激光照射结束后继续避光孵育细胞2 h,PBS冲洗3次,加入终浓度为10 μg/mL的线粒体探针Rhodamine123,避光孵育30 min,孵育结束后,弃去所有孔内的培养基,PBS洗涤3次。消化并离心细胞,PBS清洗细胞2次,于荧光显微镜下观察,或行流式细胞仪检测。
1.2.4 小鼠荷瘤实验 选取清洁级雌性BALB/c小鼠,鼠龄6~8周,体质量17~20 g。取对数生长期乳腺癌4T1细胞,将单细胞悬液接种于小鼠左后肢腹股沟内侧皮下。待小鼠瘤体长至近1 cm3的实体瘤,取皮下移植瘤,在无菌条件下去包膜,剪成0.001 cm3的均匀组织块备用。选取24只雌性BALB/c小鼠,脱毛液将小鼠左侧腹股沟毛脱净,再将肿瘤组织块植入小鼠左后肢腹股沟内侧皮下,待移植瘤直径达到0.6~0.8 cm,进行随机分组。将24只荷瘤小鼠随机分为4组(每组6只):空白对照组;ADM组(ADM 2 mg/kg),1次/周,共3次;PDT组(亚甲蓝50 mg/kg),总照射剂量为240 J/cm2,同时避光24 h,1次/周,共3次;、联合治疗组(ADM 2 mg/kg+亚甲蓝50 mg/kg)。每次化疗药物注射时间相同,化疗药物注射12 h后腹腔注射亚甲蓝,12 h后进行激光照射,总照射剂量为240 J/cm2。在治疗前测量小鼠肿瘤体积,治疗后每2d测量1次,直至治疗后的第21d。瘤体体积的计算公式:V(cm3)=d2(cm2)×D(cm)/2,d和D分别为肿瘤的最短径和最长径[5]。至治疗后的第21d,采用颈椎脱位术处死每组小鼠并取肿瘤组织大体标本。
1.3 统计学方法
2 结果
2.1 PDT及联合治疗对细胞增殖的抑制作用
ADM组抑制乳腺癌细胞4T1生长呈浓度依赖性,浓度为0.50、1.00、2.00及4.00 μg/mL,各组组间比较差异均有统计学意义(P<0.05,图1A)。计算出ADM组半数药物抑制浓度(IC50)为0.67 μg/mL,选取0.5 μg/mL为联合给药及后续研究给药浓度。PDT组亚甲蓝浓度为10、15、20、25 μM,各组与空白对照组比较差异均有统计学意义(P<0.05,图1B)。计算出PDT组IC50为17 μM。选取15 μM为后续实验给药浓度。联合治疗组各组与空白对照组比较差异均具有显著统计学意义(P<0.05)。联合治疗组与PDT组进行组间比较,各浓度组间比较差异均具有统计学意义(P<0.05,图1B)。本研究浓度为0.50 μg/mL ADM组抑瘤率为26%(0.68/2.62),浓度为15 μM PDT组抑瘤率为40%(1.06/2.64),联合治疗组抑瘤率为71%(1.90/2.67),经计算联合治疗Q值约为1.28,显示ADM及PDT具有良好的协同增效作用。
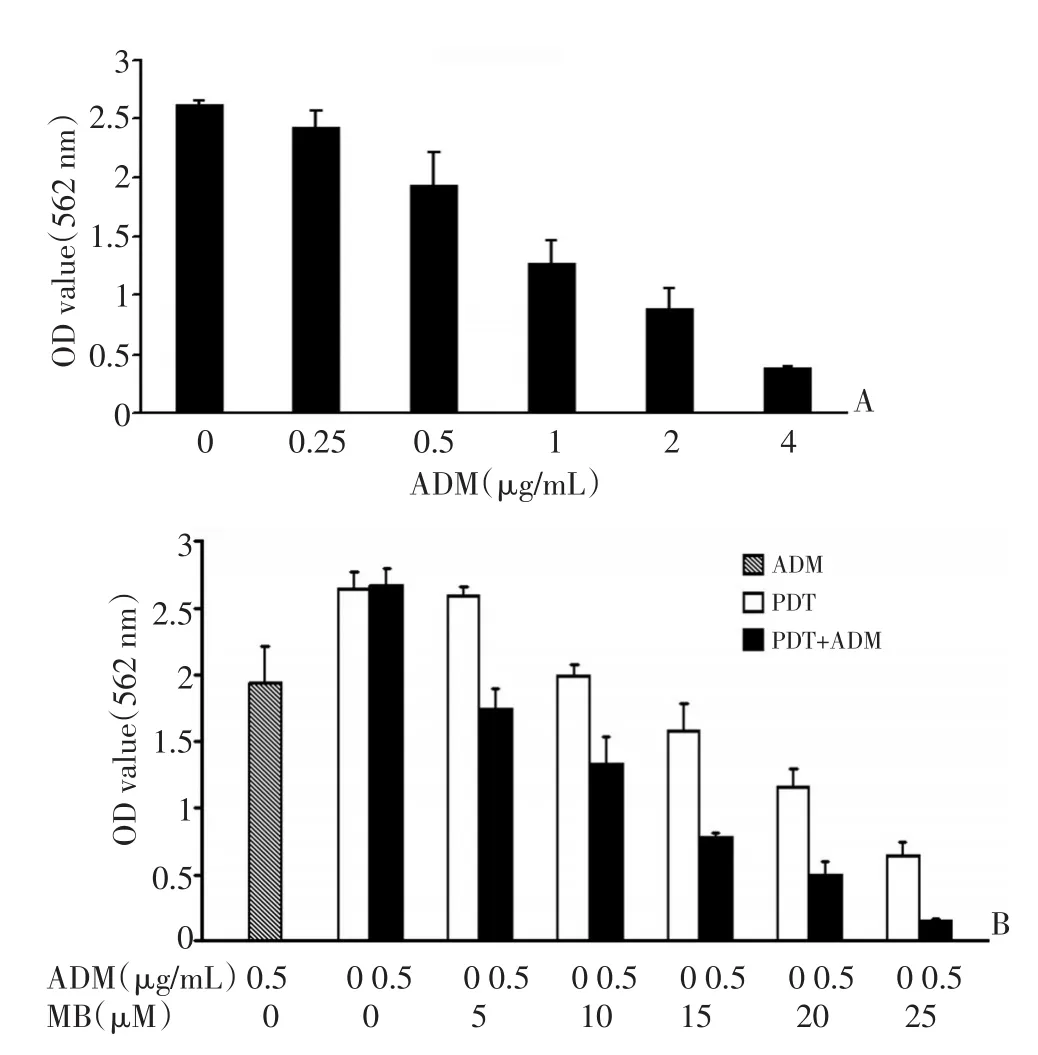
图1 PDT联合ADM对小鼠乳腺癌4T1细胞体外生长抑制作用Figure1 In vitro inhibitory action of PDT and ADM on mammary carcinoma cell growth in 4T1 mouse
2.2 细胞凋亡检测
流式细胞术检测显示,ADM组细胞凋亡及坏死率均较低,PDT组以早期及晚期凋亡为主,联合治疗组细胞死亡率较高,主要以晚期凋亡及坏死为主,早期凋亡细胞较少。与空白对照组比较,ADM组、PDT组及联合治疗组细胞总死亡率比较差异均具有统计学差异(P<0.05)。联合治疗组细胞总死亡率高达(87.1%±1.9)%,与ADM组及PDT组比较均具有显著性差异(P<0.05,图2)。
2.3 线粒体膜电位变化
荧光显微镜观察:空白对照组细胞状态良好,线粒体荧光探针定位于胞浆内,显示为绿色荧光,胞浆着色深;ADM组胞浆荧光强度与空白对照组比较未见明显变化;PDT组部分细胞荧光强度减弱;联合治疗组大部分细胞荧光强度明显减弱(图3)。流式细胞术结果显示:ADM组和空白对照组比较,线粒体膜电位未见明显变化(P>0.05),而PDT组及联合治疗组与空白对照组差异均具有统计学意义(P<0.05),联合治疗组与PDT组组间差异均具有统计学意义(P<0.05,图4)。
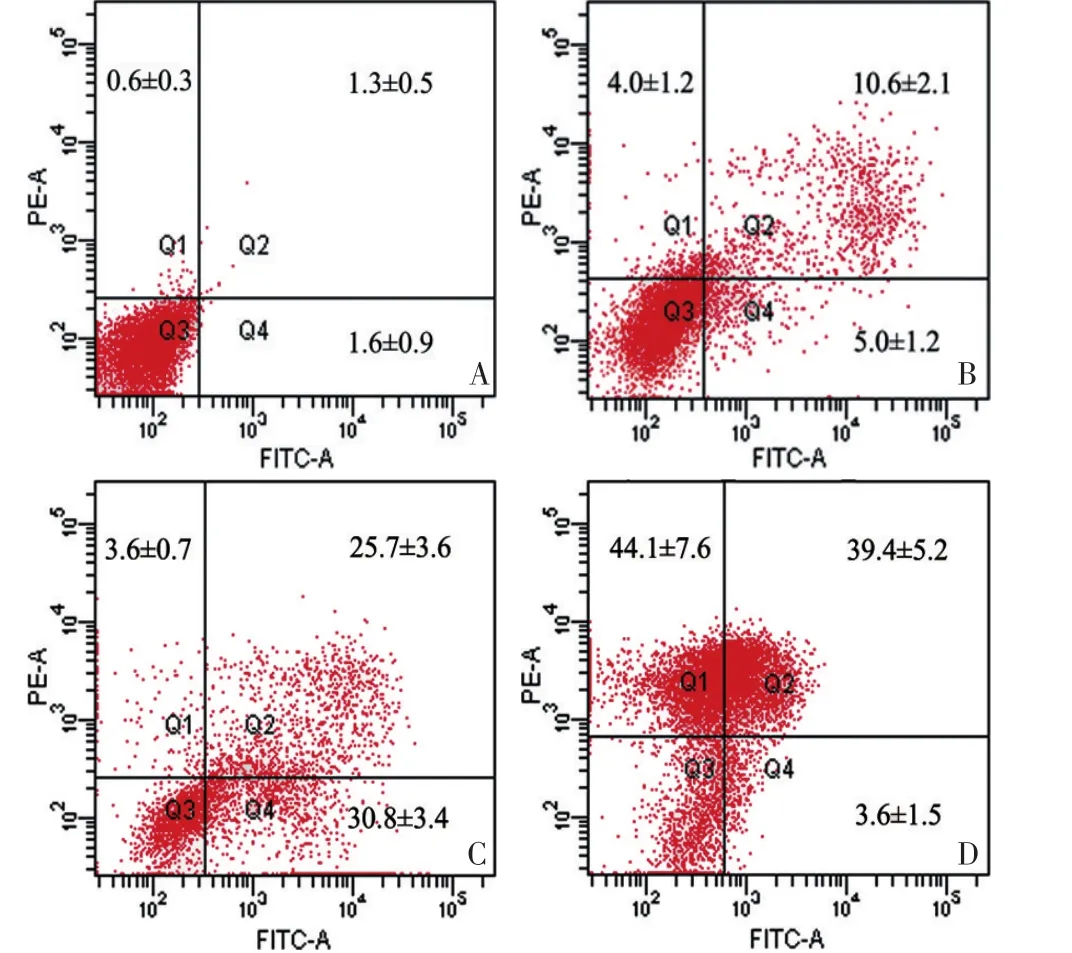
图2 流式细胞术检测各组细胞死亡情况Figure2 Cell death determined by flow cytometry with Annexin V-FITC/PI double staining
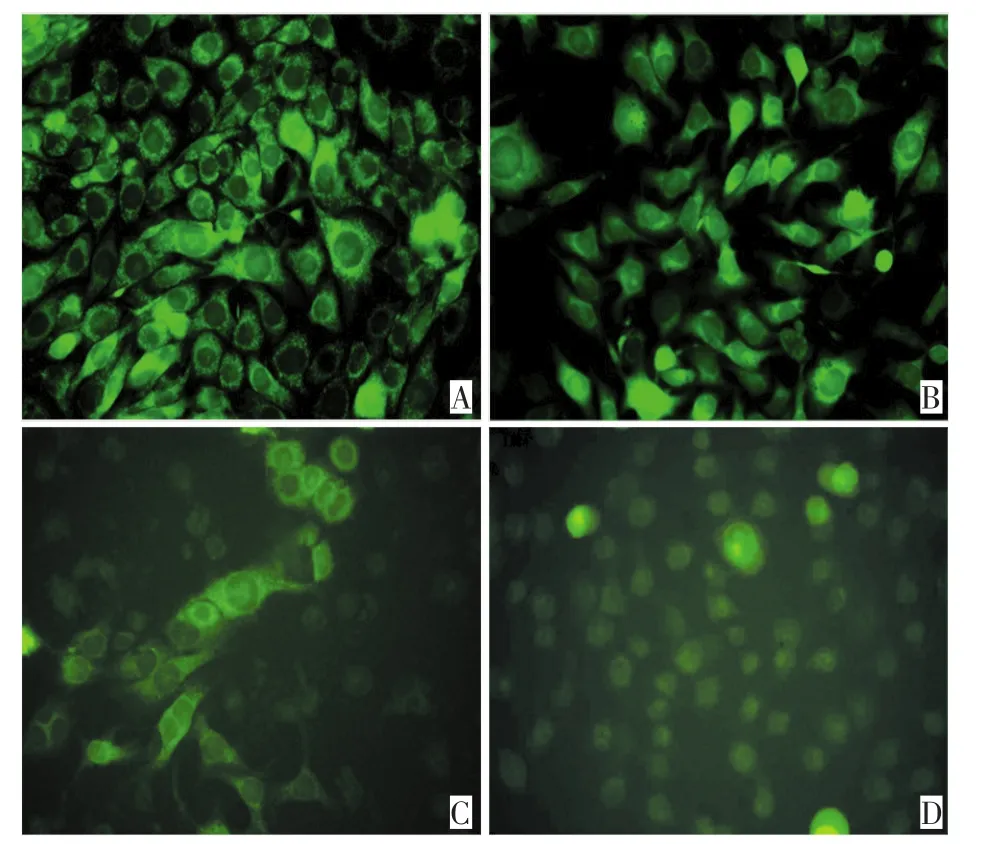
图3 荧光显微镜下观察各组细胞线粒体膜电位变化Figure3 Change in MMP observed under a fluorescent microscope after Rhodamine123 staining
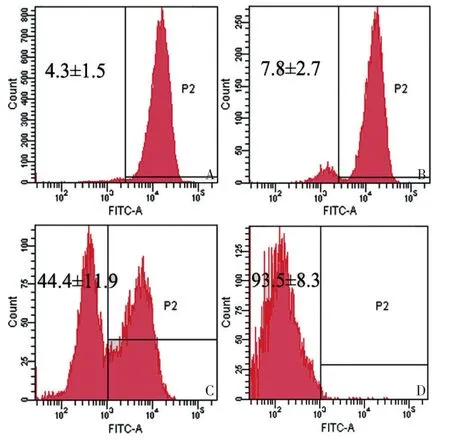
图4 流式细胞术检测各组线粒体膜电位变化Figure4 Change in MMP measured by flow cytometry after Rhodamine123 staining
2.4 荷瘤小鼠肿瘤生长情况
空白对照组及ADM组可见肿瘤增长较快,PDT组及联合治疗组早期可见肿瘤表面红肿,2~3d瘤体表面出现局部坏死,坏死程度加深,坏死组织脱落,结痂,因肿瘤基底部仍继续生长,坏死肿瘤边缘隆起,肿瘤呈火山口状,部分肿瘤逐渐缩小甚至完全消失。PDT组及联合治疗组分别有1只及2只小鼠肿瘤达到完全缓解,且连续观察10周未见肿瘤复发。治疗前,各组小鼠的肿瘤体积无明显差异,治疗第7、9及15d,各治疗组和空白对照组比较差异均具有统计学意义(P<0.05),各治疗组组间比较差异均无统计学意义(P>0.05);第11及13d,仅PDT组及联合治疗组和空白对照组比较差异有统计学意义(P<0.05),而各治疗组间比较差异均无统计学意义(P>0.05);第17及19d,PDT组及联合治疗组与空白对照组及ADM组比较差异均有统计学意义(P<0.05),ADM组与空白对照组比较差异无统计学意义(P>0.05);第21d,PDT组仅与空白对照组比较差异有统计学意义(P<0.05),联合治疗组与空白对照组及ADM组比较差异有统计学意义(P<0.05)。整个治疗过程中,联合治疗组瘤体明显小于PDT组,但差异无统计学意义(P<0.05,图5A)。治疗后第21d处死小鼠,均剥离肿瘤称重(图5B),空白对照组肿瘤体质量(3.21±1.01)g,ADM组肿瘤体质量(2.09±0.86)g,PDT组肿瘤体质量(1.18±0.61)g,联合治疗组肿瘤体质量(0.74±0.53)g。

图5 PDT联合ADM对小鼠乳腺癌4T1细胞移植瘤生长的影响Figure5 PDT and ADM inhibition on cell growth of 4T1 mouse mammary carcinoma in normal BALB/c mice
3 讨论
随着对PDT治疗肿瘤研究的深入,近年来许多学者不断尝试各种PDT联合方案,旨在进一步提高PDT的抗肿瘤疗效,其中PDT联合化疗受到越来越多的关注。Khdair等[7]发现亚甲蓝介导的PDT联合阿霉素能够对耐药的肿瘤细胞显示出强大的细胞毒性,这两种药物在耐药细胞中的浓度较前明显增高,同时发现P-糖蛋白的表达下降以及活性氧簇的大量聚集,最终导致耐药肿瘤细胞的坏死或者凋亡。本研究中亚甲蓝介导的光动力治疗显示良好的抗肿瘤效应,并呈剂量依赖性。体外及体内结果均提示联合治疗优于单纯化疗或光动力治疗,符合临床综合治疗要求。两种治疗方法相互作用,也可能是联合治疗组治疗效果明显的一个重要原因。PDT和化疗均能促进细胞凋亡和肿瘤的坏死,但是其具体的作用机制是不同的,可能存在交叉的信号通路,因此两种治疗方法联合可以弥补各自的缺点,发挥较强的抗肿瘤作用。
Canti等[8]以低剂量的化疗药物联合PDT治疗小鼠荷瘤模型,发现尽管单独应用低剂量化疗药物并无抑瘤作用,但联合PDT治疗可大大增强抗肿瘤效果。最近的研究报道,观察苯卟啉衍生物单环酸A介导的光动力疗法联合阿霉素治疗小鼠移植瘤,发现两者具有显著的增效作用,且能明显延长小鼠生存期,虽然联合治疗组存在一定的不良反应,但是小鼠可以耐受,未见小鼠异常死亡[9]。本研究中采用PDT联合低剂量阿霉素治疗,结果显示小鼠耐受性良好,毒副反应轻,而抑瘤效果得到加强,说明给予低剂量阿霉素亦可达到增效作用,与国外文献报道类似[8]。ADM组在治疗初期肿瘤生长较缓慢,而在第15d后肿瘤增长加快,提示单纯化疗在肿瘤体积较小时具有良好的抗肿瘤效应,而在瘤体较大时疗效欠佳。而PDT组在整个治疗过程中抑瘤效果显著,显示PDT有良好的肿瘤局部控制作用。联合治疗组抑瘤率达到76.95%,高于ADM组及PDT组,显示出良好的增效作用,与其他文献报道类似[10-11]。Ahn等[12]采用EMT6乳腺癌细胞系建立荷瘤小鼠模型,给予光敏剂血卟啉衍生物腹腔内注射,以不同光照剂量分组治疗,结果显示高于90 J/cm2光照剂量时瘤体可以达到完全缓解。本研究PDT组及联合治疗组分别有1只及2只小鼠治疗效果达到完全缓解,说明PDT联合化疗能有效治疗乳腺癌,部分肿瘤可能达到完全缓解,为临床综合治疗乳腺癌提供一项新的选择。阿霉素在心肌细胞中聚集而导致心肌毒性,限制了该药物的临床应用。在之前的研究中,研究人员观察到联合治疗极大改善了光敏剂及阿霉素在敏感性细胞中的细胞毒性,而且还增加对耐药性细胞的联合细胞毒性作用[7]。联合治疗一方面可以降低阿霉素的有效剂量,另一方面导致耐药性肿瘤细胞的凋亡及坏死比率增加。本研究结果显示PDT联合ADM达到较好的肿瘤抑制作用,同时可以降低阿霉素剂量,减低心肌组织内的分布,从而减少其心肌毒性。
线粒体是细胞内死亡信号途径调控网络中重要的细胞器,凋亡过程中的许多关键过程集中于线粒体上。线粒体膜电位在维持线粒体膜的完整性和功能方面起重要的作用,而线粒体膜电位下降被认为是细胞凋亡早期的标志[13]。本研究发现亚甲蓝介导的光动力疗法及联合治疗可显著降低细胞的线粒体膜电位,提示线粒体途径在PDT诱导细胞凋亡中发挥着重要的作用。阿霉素主要作用部位是细胞核,药物进入细胞核与DNA结合,从而抑制核酸的合成和有丝分裂,而光动力治疗主要作用于胞浆,尤其是线粒体,因而光动力联合阿霉素化疗可以通过不同途径来达到增效的目的。
综上所述,亚甲蓝介导的光动力疗法对乳腺癌细胞及移植瘤的生长抑制作用明显,联合阿霉素可增强抑瘤效果。体外实验表明光动力疗法抑制小鼠乳腺癌细胞增殖呈浓度依赖性。体内实验表明光动力疗法可以明显抑制小鼠乳腺癌皮下移植瘤生长,而联合阿霉素可以增强抑瘤作用。细胞水平光动力治疗以凋亡为主,其机制可能与降低肿瘤细胞线粒体膜电位相关。
1 Lee E,Phua DH,Lim BL,et al.Severe chlorate poisoning successfully treated with methylene blue[J].J Emerg Med,2013,44(2):381-384.
2 Gupta G,Radhakrishna M,Chankowsky J,et al.Methylene blue in the treatment of discogenic low back pain[J].Pain Physician,2012,15(4):333-338.
3 Gifford SM,Peck MA,Reyes AM,et al.Methylene blue enteric mapping for intraoperative localization in obscure small bowel hemorrhage:report of a new technique and literature review:combined intraoperative methylene blue mapping and enterectomy[J].J Gastrointest Surg,2012,16(11):2177-2181.
4 Zuluaga MF,Lange N.Combination of photodynamic therapy with anti-cancer agents[J].Curr Med Chem,2008,15(17):1655-1673.
5 Wagner M,Suarez ER,Theodoro TR,et al.Methylene blue photodynamic therapy in malignant melanoma decreases expression of proliferating cell nuclear antigen and heparanases[J].Clin Exp Dermatol,2012,37(5):527-533.
6 金正均.合并用药中的相加[J].中国药理学报,1980,1(2):70-76.
7 Khdair A,Handa H,Mao G,et al.Nanoparticle-mediated combination chemotherapy and photodynamic therapy overcomes tumor drug resistance in vitro[J].Eur J Pharm Biopharm,2009,71(2):214-222.
8 Canti G,Nicolin A,Cubeddu R,et al.Antitumor efficacy of the combination of photodynamic therapy and chemotherapy in murine tumors[J].Cancer Lett,1998,125(1-2):39-44.
9 Tong ZS,Miao PT,Liu TT,et al.Enhanced antitumor effects of BPD-MA-mediated photodynamic therapy combined with adriamycin on breast cancer in mice[J].Acta Pharmacol Sin,2012,33(10):1319-1324.
10 Xie Q,Jia L,Liu YH,et al.Synergetic anticancer effect of combined gemcitabine and photodynamic therapy on pancreatic cancer in vivo[J].World J Gastroenterol,2009,15(6):737-741.
11 Crescenzi E,Varriale L,Iovino M,et al.Photodynamic therapy with indocyanine green complements and enhances low-dose cisplatin cytotoxicity in MCF-7 breast cancer cells[J].Mol Cancer Ther,2004,3(5):537-544.
12 Ahn TG,Lee BR,Choi EY,et al.Photodynamic therapy for breast cancer in a BALB/c mouse model[J].J Gynecol Oncol,2012,23(2):115-119.
13 Grebenová D,Kuzelová K,Smetana K,et al.Mitochondrial and endoplasmic reticulum stress-induced apoptotic pathways are activated by 5-aminolevulinic acid-based photodynamic therapy in HL60 leukemia cells[J].J Photochem Photobiol B,2003,69(2):71-85.
