153Sm-Annexin V凋亡显像的实验研究
2013-01-07赵颖如孙雷娜牛瑞芳徐文贵
刘 江 赵颖如 王 健 孙雷娜 牛瑞芳 徐文贵
放化疗是恶性肿瘤除手术外的常规治疗手段,其治疗肿瘤的机制之一是干扰DNA的合成及细胞的分裂,从而诱导肿瘤细胞产生凋亡,达到抑制或清除肿瘤的目的。细胞凋亡早期,细胞膜脂双层内层的磷脂酰丝氨酸(phosphatidyl serine,PS)外翻,暴露于细胞膜表面,可与Ca2+依赖性磷脂结合蛋白Annexin V快速紧密的特异性结合。体外应用放射性核素标记Annexin V后引入体内,Annexin V迅速与细胞凋亡级联反应初始事件的外翻PS结合,通过SPECT探测放射性核素衰变时释放的γ光子,间接使凋亡细胞示踪达成凋亡显像。细胞凋亡是一个连续动态时间较长的生物学过程,由于99mTc的半衰期相对较短,不利于连续追踪监测及捕捉细胞凋亡活动的高峰期,进而确立最佳凋亡显像时间窗等,故本研究尝试选用半衰期相对较长的153Sm标记Annexin V进行凋亡显像,现报道如下。
1 材料与方法
1.1 材料
1.1.1 试剂153Sm购自北京原子高科有限技术公司;人基因重组Annexin V购自Sigma公司,美国;二乙三胺五醋酸(DTPA),吡啶,乙酸酐,无水乙醇,甲基亚矾等化学试剂(均为国产分析纯)。
1.1.2 仪器 SPECT购自美国GE公司;活度计购自美国CAPINTEC,INC公司;γ计数器购自美国Centocor公司。
1.1.3 实验动物 长耳白家兔(2.2~2.5 kg,雄性)及昆明品系小鼠(20~30 g,雌雄各半),均购自天津市动物中心。
1.1.4 细胞及动物模型 人肺小细胞癌细胞株NCIH446、接种鼠源肺癌细胞的荷瘤小鼠的对照组及诱导凋亡组均由本院中心实验室提供。
1.2 方法
1.2.1 环DTPA法标记153Sm-Annexin V 环DTPA制备:取DTPA 1g,乙酸酐2 mL,吡啶12mL放入棕色瓶内进行反应。反应温度为66~67℃,时间为24 h,抽滤经乙酸酐、无水乙醇各洗3次后自然风干所得白色粉末即为环DTPA。取Annexin V(200 μg/mL)0.5 mL,环DTPA的甲基亚矾溶液,缓冲液为NaHCO3(浓度0.1 mol/L,pH 8.2),于24~26℃反应1 h,用PBS(浓度0.1 mol/L,pH 为7.4,含NaCl 0.1 mol/L)透析除杂质,并在无菌情况下进行除菌过滤,分装在无菌瓶中,密封后置于4℃的冰箱内保存备用。显像前加入10mCi放射性核素153Sm摇匀,静置5~30 min可得无色透明液体153Sm-DTPA-Annexin V,即153Sm-Annexin V。
1.2.2 物理、化学、生物学检测153Sm-Annexin V:无色透明,pH为7.4,比活度为100 μg/10 mCi/2 mL。放化纯RCP:薄层层析法测定RCP>90%,37℃静置3 h后测得RCP约≥90%。标记率采用蛋白透析方法,将标记好的153Sm-Annexin V放入透析袋内,透析外液为PBS 800 mL,放入4℃冰箱内透析过夜,利用γ计数器分别测量透析袋内、外液的CPM值,为CPM内和CPM外。按公式计算其标记率R:R=CPM内/(CPM内+CPM外)×100%。透析法测得153Sm-Annexin V标记率为88.6%。检菌:将1支153Sm-Annexin V注入盛有培养液的培养瓶中,于37℃保温1周,未见有细菌检出。热原检测:雄性长耳白家兔3只,体质量2~2.5 kg,将1支153Sm-AnnexinV静脉注入,注药后监测家兔体温无明显升高。毒理测定:昆明品系小鼠30只,雌雄各半,体质量20~30 g,分为3组,每组10只。每组鼠尾静脉内分别注入153Sm-Annexin V相当于人用量的100、500和1 000倍,1周内观察小鼠死亡情况,计算得出LD50>333 μg/kg体质量。应用家兔进行血浆药代动力学测定:雄性长耳白家兔3只,每只耳缘静脉注入3 μg/300 μCi153Sm-Annexin V,分别于注药后10、20、30 min,以及1、2、3、5、6、12、24、48、72 h取血0.2 mL备用。利用γ计数器测其1min的放射性计数CPM值,以每毫升血中CPM值代表血药浓度,绘制放射性核素标记Annexin V的时量曲线。计算得出血浆半衰期13 min。
1.2.3 体外细胞培养凋亡显像实验 人肺小细胞癌细胞株NCIH446及环磷酰胺(cyclophosphamide,CTX)诱导凋亡细胞模型均由本院中心实验室提供,显像前37℃加入153Sm-Annexin V(0.1 μg/10 μCi)并恒温保持1h,SPECT平面静态采集图像分析。SPECT静态采集方法:配备低能高分辨平行孔准直器,矩阵1 024×256,能峰103KeV,窗宽20%。应用异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记Annexin V联合碘化丙啶(propidiumiodide,PI)染色法测定细胞凋亡作阳性对照。
1.2.4 荷瘤小鼠动物凋亡显像实验 接种鼠源肺癌细胞的荷瘤小鼠及经CTX诱导凋亡动物模型均由本院中心实验室提供,经鼠尾静脉注射153Sm-Annexin V(3 μg/300 μCi)后0.5~4 h应用SPECT平面静态采集图像,采集方法同上。应用TUNEL染色测定细胞凋亡作阳性对照。
2 结果
2.1 体外细胞培养凋亡显像实验
对照组:即人肺小细胞癌细胞株NCIH446未经CTX诱导凋亡,加入153Sm-Annexin V不能产生特异性结合,中央区培养细胞部位无放射性浓集,呈阴性(图1A)。实验组:即人肺小细胞癌细胞株NCIH446经CTX诱导凋亡,加入153Sm-Annexin V产生特异性结合,中央区培养细胞部位出现放射性浓集,呈阳性(图1B),经Annexin V-FITC/PI联合染色法证实(图1C)。
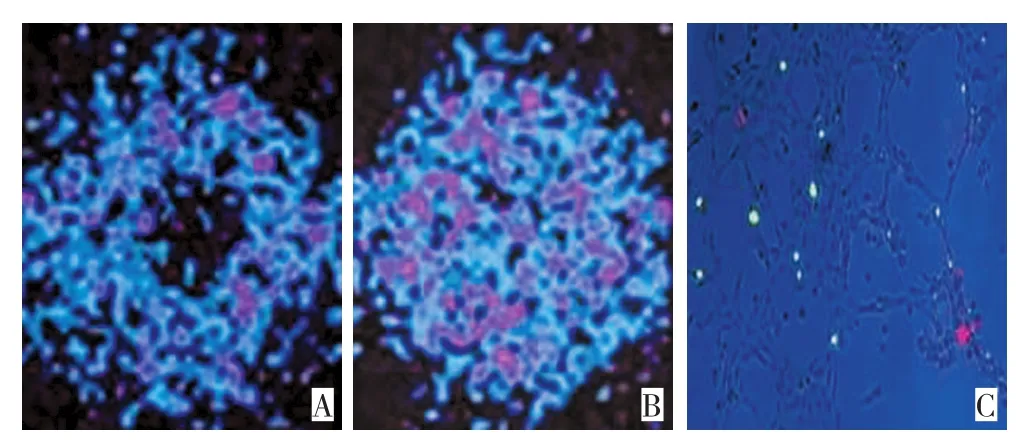
图1 体外细胞培养凋亡显像实验及Annexin V-FITC/PI联合染色Figure1 Apoptosis imaging in cultured cells and Annexin V-FITC/PI joint staining results
2.2 荷瘤小鼠动物凋亡显像实验
对照组:即接种肺癌细胞的荷瘤小鼠未经CTX诱导凋亡,加入153Sm-Annexin V不能产生特异性结合,肿瘤组织部位无放射性浓集(箭头处),呈阴性(图2A),本底为自发凋亡或坏死影像。实验组:即接种肺癌细胞的荷瘤小鼠经CTX诱导凋亡,加入153Sm-Annexin V产生特异性结合,肿瘤组织部位可见放射性浓集(箭头处),呈阳性(图2B),肿瘤组织经TUNEL染色检测证实(图2C)。
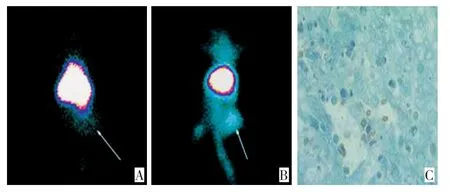
图2 荷瘤小鼠动物凋亡显像实验及TUNEL染色Figure2 Apoptosis imaging in tumor-bearing mice and animals and results of TUNEL staining
3 讨论
1972年Kerr等[1]首次提出生物学“细胞凋亡”概念。现今已涉及器官移植、心脏疾病、中枢神经系统疾病、恶性肿瘤治疗及急性血栓诊断等多个领域。应用放射性核素标记Annexin V进行体内凋亡显像是近年来研究热点之一。细胞凋亡(cell apoptosis),又称为程序性细胞死亡(programmed cell death,PCD),是一种区别于细胞坏死的由多种基因调控的主动性细胞死亡过程,可见于胚胎发育、组织发生、组织分化、免疫调节等诸多生理现象和恶性肿瘤、自身免疫性疾病、病毒感染性疾病、艾滋病等多种病理情况[2-3]。肿瘤的发生不仅与细胞异常增殖、分化有关,而且还与细胞凋亡的异常密切相关。细胞凋亡的减少或受到抑制会破坏细胞增殖和死亡之间的平衡,使得细胞增殖相对活跃并最终导致肿瘤的发生[4]。抗肿瘤治疗的机制之一是干扰DNA的合成及细胞的分化,诱导肿瘤细胞产生凋亡。因此,进行细胞凋亡的检测可以评估肿瘤对治疗的敏感性和耐受程度,预测疗效并对进一步治疗方案的选择制定给予指导,而且还可以为抗肿瘤的新药研发提供有力佐证[5-7]。细胞凋亡的检测分为体内和体外两种,体外法为取材后离体检测,取材会对人体组织器官造成创伤不能反复连续使用,离体检测也只能反映某一时间点细胞凋亡,不能实时动态监测活体内凋亡的发生、发展过程。体内检测主要依靠影像学完成,具有活体、无创、实时监测等优势而被临床广泛研究和应用。
放射性核素凋亡显像是研究最早成熟的体内凋亡探测技术,其原理在于利用核素标记化合物与细胞凋亡过程中产生的特异性靶结合,使放射性核素浓聚在细胞凋亡部位而达到显示细胞凋亡的目的。磷脂酰丝氨酸PS是构成细胞膜的带负电荷的磷脂成分,依靠翻转酶(floppase)、移位酶(translocase)两种ATP能量依赖酶的作用来维持其内向性,正常状态下位于细胞膜脂双层的内层。细胞凋亡早期,细胞内Ca2+浓度增加,导致翻转酶、移位酶失活的同时激活爬行酶(scramblase)使PS外翻,即PS由内膜移向外膜暴露于细胞表面[8-10]。目前认为,PS外翻是细胞凋亡级联反应的初始事件[11]。膜联蛋白V(Annexin V)是一种人体内源性蛋白,不具抗原性,属于Ca2+依赖性磷脂结合蛋白家族,在Ca2+存在的情况下,Annexin V能与PS快速紧密的特异性结合[12-13]。体外应用放射性核素标记Annexin V后引入体内,仍保持原有生物活性的Annexin V能迅速与细胞凋亡级联反应初始事件的外翻PS结合,通过单光子发射型计算机断层显像仪(single photon emission computed tomography,SPECT)探测放射性核素衰变时释放的γ光子,间接使凋亡细胞示踪,实现凋亡显像。
Belhocine等[14]应用99mTc-Annexin V对15例恶性肿瘤患者(肺癌10例、淋巴瘤3例、乳腺癌2例)在第1次化疗后进行凋亡显像,其中8例肿瘤部位摄取阳性,追踪随访治疗有效;5例肿瘤部位摄取阴性,追踪随访治疗无效;另外2例乳腺癌患者肿瘤部位摄取阴性,但追踪随访治疗有效,结果显示99mTc-Annexin V可用于肺癌及淋巴瘤的疗效评价,在乳腺癌中的应用需进一步研究。Kartachova等[15]对38例受试者(淋巴瘤3l例,非小细胞肺癌4例,头颈部鳞状细胞癌3例)在治疗前后分别进行99mTc-Annexin V凋亡显像,分析得出显像结果与治疗效果之间呈正相关。以上研究均表明放射性核素标记的Annexin V凋亡显像可用于人体内临床评价肿瘤的早期治疗效果。本研究发现153Sm-Annexin V体外标记率及放化纯高,化学性质稳定,无菌、无热原,毒理测定合格适于人体内凋亡显像。进一步研究证实体外细胞培养及荷瘤小鼠动物凋亡显像均阳性,为应用放射性核素153Sm-Annexin V在抗肿瘤治疗前后进行人体内的凋亡显像奠定基础。同时153Sm半衰期较长(46 h),可以克服99mTc半衰期较短(6 h)凋亡显像时重复注射的弊端,更容易进行连续追踪监测、捕捉细胞凋亡活动的高峰期,进而确立最佳凋亡显像时间窗,有更为广阔的临床应用前景。
值得注意的是,细胞坏死时出现细胞膜整合性丧失,同样可以使PS外翻,进而在凋亡显像中呈阳性,故放射性核素体内凋亡显像尚无法区分细胞坏死和细胞凋亡,153Sm-Annexin V凋亡显像亦是如此。同时本研究采用的153Sm-Annexin V进行凋亡显像时有肝脾摄取伪影,不适用于上腹部的肿瘤的监测评估。另外,本实验组也将对153Sm-Annexin V在荷瘤小鼠体内的生物学分布;同一种荷瘤小鼠对不同化疗药物组合诱导凋亡的最佳显像时间窗以及不同荷瘤小鼠对其相应化疗药物诱导凋亡的最佳显像时间窗进行进一步的实验研究。
1 Kerr JFR,Wyllie AH,Currie AR.Apoptosis:A Basic Biological Phenomenon With Wide-ranging Implications in Tissue Kinetics[J].Br J Cancer,1972,26:239-257.
2 Glaser M,Goggi J,Smith G,et al.Improved radiosynthesis of the apoptosis marker 18F-ICMT11 including biological evaluation[J].Bioorg Med Chem Lett,2011,21(23):6945-6949.
3 Fortt R,Smith G,Awais RO,et al.Automated GMP synthesis of[(18)F]ICMT-11 for in vivo imaging of caspase-3 activity[J].Nucl Med Biol,2012,39(7):1000-1005.
4 Shi H,Kwok RT,Liu J,et al.Real-time monitoring of cell apoptosis and drug screening using fluorescent light-up probe with aggregation-induced emission characteristics[J].J Am Chem Soc,2012,134(43):17972-17981.
5 Lederle W,Arns S,Rix A,et al.Failure of annexin-based apoptosis imaging in the assessment of antiangiogenic therapy effects[J].EJNMMI Res,2011,1(1):26.
6 Sobrio F,Medoc M,Martial L,et al.Automated Radiosynthesis of[(18)F]ML-10,a PET Radiotracer Dedicated to Apoptosis Imaging,on a TRACERLab FX-FN Module[J].Mol Imaging Biol,2013,15(1):12-18.
7 Sun IC,Lee S,Koo H,et al.Caspase sensitive gold nanoparticle for apoptosis imaging in live cells[J].Bioconjug Chem,2010,21(11):1939-1942.
8 Vangestel C,Peeters M,Oltenfreiter R,et al.In vitro and in vivo evaluation of[99mTc]-labeled tricarbonyl His-annexin A5 as an imaging agent for the detection of phosphatidylserine-expressing cells[J].Nucl Med Biol,2010,37(8):965-975.
9 Vangestel C,Peeters M,Mees G,et al.In vivo imaging of apoptosis in oncology:an update[J].Mol Imaging,2011,10(5):340-358.
10 Wang MW,Wang F,Zheng YJ,et al.An in vivo molecular imaging probe(18)F-Annexin B1 for apoptosis detection by PET/CT:preparation and preliminary evaluation[J].Apoptosis,2013,18(2):238-247.
11 Niu G,Chen X.Apoptosis imaging:beyond annexin V[J].J Nucl Med,2010,51(11):1659-1662.
12 Yang TJ,Haimovitz-Friedman A,Verheij M.Anticancer therapy and apoptosis imaging[J].Exp Oncol,2012,34(3):269-276.
13 De Saint-Hubert M,Wang H,Devos E,et al.Preclinical imaging of therapy response using metabolic and apoptosis molecular imaging[J].Mol Imaging Biol,2011,13(5):995-1002.
14 Belhocine T,Steinmetz N,Hustinx R,et al.Increased uptake of the apoptosis-imaging agent(99m)Tc recombinant human Annexin V in human tumors after one course of chemotherapy as a predictor of tumor response and patient prognosis[J].Clin Cancer Res,2002,8(9):2766-2774.
15 Kartachova MS,Valdés Olmos RA,Haas RL,et al.99mTc-HYNIC-rh-annexin-V scintigraphy:visual and quantitative evaluation of early treatment-induced apoptosis to predict treatment outcome[J].Nucl Med Commun,2008,29(1):39-44.
