p16和ProEx C在宫颈活检低度鳞状上皮内病变中的表达及意义
2013-01-05潘升华安慧敏吴文珍孙利敏张亮陈国荣夏康池晓萍
潘升华,安慧敏,吴文珍,孙利敏,张亮,陈国荣,夏康,池晓萍
(1.温州医科大学附属第三医院 病理科,浙江 温州 325200;2.温州医科大学附属第一医院 病理科,浙江 温州 325000)
宫颈低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)及高度鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)的预后[1]及治疗方法均不同,对阴道镜活检诊断LSIL的患者只要求在半年后随访宫颈细胞学;而对HSIL的患者则需要采用宫颈电环切术(loop electrosurgical excision procedure,LEEP)或冷刀锥切等积极的治疗措施[2]。我们在日常工作中经常收到一些活检仅诊断为LSIL,但因患者焦虑等社会性因素而非常规地施行了LEEP甚至子宫全切术的标本,术后病理却发现已经存在HSIL。造成手术前后病理诊断不一致的原因可能包括活检取材于HSIL的周边组织、尚处于HSIL的初起状态等,因而对活检诊断为LSIL的病例有必要进行进一步甄别,以便对那些可能已经实际存在HSIL或者将快速发展为HSIL的患者尽早进行干预治疗,从而更加有效地预防宫颈癌的发生。
p16和ProEx C是近年研究、应用较多的鉴别宫颈LSIL和HSIL的两个抗体,我们通过免疫组织化学方法检测p16和ProEx C在宫颈活检病理诊断LSIL的标本中的表达情况,以探讨实现这种甄别的可能。
1 材料和方法
1.1 病理标本 选取温州医科大学附属第三医院2007年1月至2013年6月间经阴道镜宫颈活检病理诊断LSIL、短时间(11~89 d)之内行LEEP或子宫全切术治疗的病例141例,其中包括术后病理诊断为HSIL的病例83例(HSIL组)和随机选取的术后病理诊断为LSIL的58例(LSIL组),均以其宫颈活检标本为研究对象。所有标本均经3位高年资主治医师以上病理医师在遮蔽原病理诊断的情况下分别重新阅片、确认。
1.2 免疫组织化学染色 所有标本均经4%甲醛固定,常规石蜡包埋切片。免疫组织化学采用EnVison法。p16购自上海长岛生物技术有限公司,为鼠抗人单克隆抗体(克隆号16P07),稀释比为1:100;ProEx C的两个组分TopoIIa(DNA topoisomerase IIa)及MCM 2(Minichromosome maintenance pro-tein 2)亦均购自上海长岛生物技术有限公司,均为鼠抗人单克隆抗体(克隆号分别为Ki-S1和CRCT2.1),稀释比分别是1:50和1:100,预先稀释后混合制备为ProEx C。均常规设置阴性和阳性对照。
1.3 免疫组织化学结果判断 p16阳性表达见于胞核,可伴有胞浆染色,为部分或全层上皮着色。ProEx C定位于基底/基底旁细胞和病变细胞的胞核,部分可见胞浆着色。结果判断标准参考Shi等[3]和Ozaki等[4]的研究并作适当调整,以便与组织学分级方法相一致,即ProEx C和p16的阳性结果取决于阳性细胞在鳞状上皮垂直平面的分布情况:阳性细胞分布于鳞状上皮下1/3为1+,鳞状上皮下2/3为2+,超过下2/3到全层着色为3+,未见阳性细胞或仅见于基底及基底旁则标为-。若各部位染色不均,则以最显著处为准。并将-及1+记为阴性表达,2+及3+记为阳性表达。
1.4 统计学处理方法 数据处理使用SPSS 21.0统计软件。采用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 p16及ProEx C表达情况 p16在LSIL组染色较浅,呈浅棕色胞核或胞核伴胞质染色,阳性部位多在鳞状上皮下1/3处(见图1);其在HSIL组则染色深,呈棕色或深棕色,多呈鳞状上皮全层染色(见图2)。p16在LSIL组和HSIL组中阳性率分别为25.9%(15/58)及78.3%(65/83),LSIL组明显低于HSIL组,差异有统计学意义(P<0.01)。在LSIL组ProEx C染色浅,呈浅棕色、棕色胞核染色,阳性部位多位于基底部或旁基底部(见图3);HSIL组ProEx C染色深,呈棕色或深棕色,接近鳞状上皮全层染色(见图4)。ProEx C在LSIL组和HSIL中阳性率分别为36.2%(21/58)及63.9%(53/83),LSIL组低于HSIL组,差异有统计学意义(P<0.01)。详见表1。

图1 p16在LSIL组中呈鳞状上皮下1/3染色(×200)
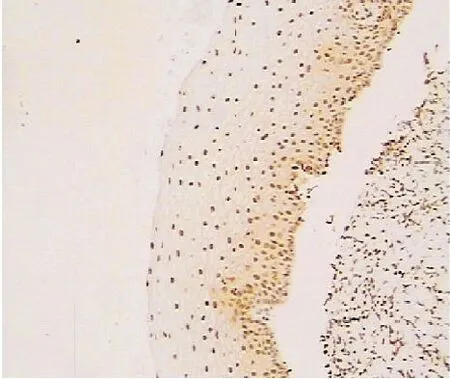
图2 p16在HSIL组中呈鳞状上皮全层染色(×200)

图3 ProEx C在LSIL组中呈基底部及旁基底部染色(×200)

图4 ProEx C在HSIL组中呈鳞状上皮几乎全层染色(×200)
2.2 p16及ProEx C对存在HSIL的预测价值 p16、ProEx C、p16 & ProEx C和p16/ProEx C预测宫颈可能实际存在/将快速发展为HSIL的灵敏度分别为78.3%、63.9%、53.0%、89.2%,差异有统计学意义(P<0.01);p16或ProEx C其中之一呈阳性(p16/ProEx C)时有着最高灵敏度(89.2%),但与单用p16(78.3%)相比较,其差异无统计学意义(P>0.05)。p16、ProEx C、p16 & ProEx C和p16/ProEx C预测HSIL的特异度分别为74.1%、63.8%、87.9%、50.0%,差异有统计学意义(P<0.01);当p16和ProEx C同时阳性(p16 & ProEx C)时有着最高的特异度(87.9%),与单用p16(74.1%)相比较,其差异亦无统计学意义(P>0.05)。

表1 p16及ProEx C在宫颈活检病理诊断为LSIL标本中的表达情况
3 讨论
研究表明,高危型人乳头瘤病毒(HPV)感染是宫颈癌及宫颈癌前病变发生的主要原因[5-6]。HPV感染宫颈鳞状上皮后大部分患者能自行清除,仅少数人呈持续感染状态,数年后逐步发展为CIN(cervical intraepithelial neoplasia)I、CINII、CINIII乃至浸润性癌。目前认为高危型HPV引起宫颈癌前病变和宫颈癌的机制与其产生的早期蛋白E6、E7有关。E6可以通过泛素链接酶E6AP与P53结合,引起P53的降解[7];E7则可结合并阻断视网膜母细胞瘤蛋白(retinoblastoma protein,pRb)的活性[8]。通过E6-P53和E7-pRb途径,HPV可以绕过正常细胞周期调控,启动细胞提前进入增殖周期,引起肿瘤的发生,同时也造成包括p16、MCM2和TopoIIa在内一系列的细胞周期相关蛋白的异常表达。
p16是由p16INK4a抑癌基因所编码的核蛋白,主要通过与cyclin D1蛋白竞争性结合激酶CDK4/CDK6,抑制pRb磷酸化和E2F(adenovirus E2 promoter transcription factor)的释放,阻止细胞由G1期进入S期,而发挥抑制肿瘤生长作用。p16INK4a基因在多种肿瘤,如乳腺癌、结肠癌、食管癌、霍奇金病等中因发生缺失、突变、甲基化、RNA剪接加工错误而失活,故呈低表达或失表达[9];但在几乎所有的HSIL、宫颈浸润性鳞状细胞癌、腺癌和近70%的LSIL中均存在p16的过表达[3]。其分子机制为HPV的E7蛋白包绕宿主细胞Rb基因的产物pRb,并使之失活而释放E2F,从而阻断了p16抑制pRb磷酸化的活性,使得p16的抑癌功能丧失;同时破坏了p16-CDK4/CDK6-pRb-E2F负反馈环路,引起p16反应性的过度表达[10]。因而p16过表达提示HPV DNA已经整合入宿主细胞基因组,并导致了细胞的异常增殖,开始具有恶性演进的倾向性。研究显示随着宫颈病变级别的升高,p16的表达相应增强[3],且p16表达强度与高危型HPV的拷贝量呈正相关[11]。本组研究发现即使活检病理诊断仅为LSIL,如果出现p16高表达,其宫颈仍存在HSIL或者将快速发展为HSIL的较大可能,p16可以作为预测宫颈活检LSIL病变转归的标记物。
ProEx C是由MCM 2和TopoIIa组成的鸡尾酒抗体,用于检测这两个细胞周期调控蛋白的表达情况。MCM 2是MCM复合体的一个组分,后者是细胞DNA复制启动和延长的必需调控蛋白,在G1期负责前复制复合体的信息传导,在S期则保持各基因组的稳定。MCM 2在休眠细胞中低表达,在增生活跃的细胞中高表达,其在细胞从G0进入G1期之前表达即开始升高,G1末期和S早期达到峰值[12]。研究表明,在高危型HPV感染和宫颈CIN病变时MCM 2过表达[13]。TopoIIa是TopoII的两个同工酶之一,主要位于核基质内,通过调节DNA空间构型变化,在DNA复制、转录、重组、修复以及染色体分离等生命活动中发挥重要作用。TopoIIa的表达有赖于细胞周期,在正常细胞中仅见于S期和G2/M期,但在肿瘤细胞中,TopoIIa表达率增高且不再依赖细胞增殖周期,其在G0、G1期即可出现表达[14],使得在恶性增殖细胞中的表达比良性增生细胞更高。屈王蕾等[15]认为随着宫颈癌前病变程度的升高,TopoIIa蛋白表达随之上调,且与细胞中高危型HPV的拷贝量呈正相关。ProEx C将MCM 2和TopoIIa联合使用,可发挥两个抗体的协同作用,防止单独应用MCM 2和TopoIIa时可能存在的漏标情况[3,16]。Badr等[17]研究显示在HSIL病变中ProEx C呈强阳性表达,其表达率明显高于LSIL,故认为ProEx C可应用于证实HSIL病变,并且猜想ProEx C可能可以用于分类LSIL。该猜想得到本组研究的支持,即在活检诊断LSIL而术后检出HSIL的标本中ProEx C的阳性率为63.9%(53/83),高于术后仍为LSIL的阳性率36.2%(21/58),ProEx C可对病理诊断LSIL的活检标本进行进一步筛选,ProEx C阳性表达,提示该LSIL患者预后欠佳。
p16和ProEx C在不同病变性质的宫颈组织中的表达已有较多研究[3,17-19],研究者较一致地认为p16和ProEx C在宫颈HSIL及宫颈癌中呈高表达,在LSIL病变及反应性病变中表达率及表达强度较低,二者可以作为HSIL与LSIL鉴别的有效标记物。然而,对于出现相对较强p16和ProEx C表达的LSIL,其预后、转归及生物学行为较之阴性表达的LSIL是否有所不同,相应的是否应该对这两类LSIL采取不同的处理措施,却少有报道。
本组研究以病理诊断LSIL的宫颈活检标本为对象,研究显示宫颈活检LSIL患者出现p16和/或ProEx C阳性表达,提示患者宫颈可能已经存在HSIL或者将在短时间内发展为HSIL,p16和ProEx C同时阳性时其灵敏度为53.0%(44/83),特异度达到87.9%(51/58),当P16和ProEx C其中之一出现阳性表达时,敏感度为89.2%(74/83),特异度为50.0%(29/58)。可以认为如果p16和ProEx C同时阳性,提示存在/将快速发展为宫颈HSIL的高度可能,应当尽早对患者采取LEEP等积极的干预治疗,如果p16或ProEx C阳性,则可根据细胞学检查、HPV感染、患者意愿等情况,积极随访或采取积极的治疗。
[1] Holowaty P, Miller AB, Rohan T, et al. Natural history of dysplasia of the uterine cervix[J]. J Natl Cancer Inst, 1999,91(3): 252-258.
[2] National Comprehensive Cancer Network (NCCN). NCCN clinical practice guidelines in oncology cervical cancer screening (v.2.2012)[EB/OL]. http://www.nccn.org/professionals/physician_gls/pdf/cervical_screening.pdf.
[3] Shi J, Liu H, Wilkerson M, et al. Evaluation of p16INK4a,minichromosome maintenance protein 2, DNA topoisomerase II alpha, ProEX C, and p16INK4a/ProEX C in cervical squamous intraepithelial lesions[J]. Hum Pathol, 2007,38(9): 1335-1344.
[4] Ozaki S, Zen Y, Inoue M. Biomarker expression in cervical intraepithelial neoplasia: potential progression predictive factors for low-grade lesions[J]. Hum Pathol, 2011, 42(7):1007-1012.
[5] zur HH. Papillomaviruses and cancer: from basic studies to clinical application[J]. Nat Rev Cancer, 2002, 2(5): 342-350.
[6] Bosch FX, Lorincz A, Munoz N, et al. The causal relation between human papillomavirus and cervical cancer[J]. J Clin Pathol, 2002, 55(4): 244-265.
[7] Nomine Y, Masson M, Charbonnier S, et al. Structural and functional analysis of E6 oncoprotein: insights in the molecular pathways of human papillomavirus-mediated pathogenesis[J]. Mol Cell, 2006, 21(5): 665-678.
[8] Munger K, Howley PM. Human papillomavirus immortalization and transformation functions[J]. Virus Res, 2002,89(2): 213-228.
[9] 龚振明, 傅继梁. p16INK4a基因的功能及其调控[J]. 生物化学与生物物理进展, 2002, 29(2): 193-196.
[10]Tringler B, Gup CJ, Singh M, et al. Evaluation of p16INK4a and pRb expression in cervical squamous and glandular neoplasia[J]. Hum Pathol, 2004, 35(6): 689-696.
[11] 瞿文珍, 周凯, 高晓, 等. P16 (INK4A)在宫颈癌及癌前病变脱落细胞中表达的临床意义及其与HPV16、18型的关系[J]. 温州医学院学报, 2005, 35(4): 294-297.
[12]Bailis JM, Forsburg SL. MCM proteins: DNA damage, mutagenesis and repair[J]. Curr Opin Genet Dev, 2004, 14(1):17-21.
[13] Ishimi Y, Okayasu I, Kato C, et al. Enhanced expression of Mcm proteins in cancer cells derived from uterine cervix[J].Eur J Biochem, 2003, 270(6): 1089-1101.
[14] Villman K, Stahl E, Liljegren G, et al. Topoisomerase II-alpha expression in different cell cycle phases in fresh human breast carcinomas[J]. Mod Pathol, 2002, 15(5): 486-491.
[15] 屈王蕾, 高宝辉, 董剑达, 等. Topo IIa在宫颈癌前病变中的表达及其与高危型人乳头瘤病毒感染的关系[J]. 医学研究杂志, 2012, 41(2): 25-28.
[16] 杨其昌, 刘宏斌, 朱燕, 等. ProEXC、p16和Ki-67在宫颈鳞状上皮内肿瘤形成诊断中的应用[J]. 中华病理学杂志, 2012,41(6): 405-407.
[17]Badr RE, Walts AE, Chung F, et al. BD ProEx C: a sensitive and specific marker of HPV-associated squamous lesions of the cervix[J]. Am J Surg Pathol, 2008, 32(6): 899-906.
[18]Guo M, Baruch AC, Silva EG, et al. Efficacy of p16 and ProExC immunostaining in the detection of high-grade cervical intraepithelial neoplasia and cervical carcinoma[J].Am J Clin Pathol, 2011,135(2): 212-220.
[19]Walts AE, Bose S. p16, Ki-67, and BD ProExC immunostaining: a practical approach for diagnosis of cervical intraepithelial neoplasia[J]. Hum Pathol, 2009, 40(7): 957-964.
