胃腺癌血管生成拟态和HIF-1α的表达及意义
2013-01-04汪晓庆张诗武
汪晓庆 张诗武 吴 强 王 弦
(1安徽医学高等专科学校病理学教研室;2安徽医科大学病理学教研室,合肥230601)
胃恶性肿瘤是消化道最常见的恶性肿瘤之一,而胃腺癌的发生率占胃恶性肿瘤的95%,是目前世界上第二常见的癌症[1]。胃腺癌由于早期症状不明显,发现时多为晚期,临床上主要的治疗方法是手术切除加化疗的综合治疗模式,但患者的5年生存率仅为5%-17%,局部复发与术后转移扩散仍是主要的致死原因。目前关于其血供途径的研究主要集中于肿瘤诱导血管生成方面,对于血管生成拟态(Vasculogenic mimicry,VM)与胃腺癌的关系研究较少。缺氧诱导因子-1α(Hypoxia inducible factor 1α,HIF-1α)是低氧主要标记物,位于与缺氧相关基因调控网络的中枢,是缺氧状态下肿瘤细胞的主要调节因子,在维持肿瘤细胞新生血管形成及促进肿瘤增殖和转移中起重要作用[2,3]。有文献报道,与VM生成相关的分子或基因可能是HIF-1а下游基因产物的作用靶点。本实验拟通过CD34和PAS双重染色技术观察胃腺癌中是否存在VM和HIF-1α蛋白的表达,并进一步探讨VM的发生和HIF-1α蛋白表达的关系及HIF-1α蛋白表达的临床病理意义。
材料和方法
1.临床资料
收集安徽省第二人民医院2006年1月-2008年4月临床病例资料完整的、经手术切除的胃腺癌121例。其中中分化腺癌59例,低分化腺癌62例,女27例,男94例,年龄36-79岁,肿瘤直径<5cm者50例,≥5cm者71例,有淋巴结转移者86例,无淋巴结转移者35例。低分化胃腺癌中癌细胞呈团块状排列的有26例,呈索状排列的有36例。术后均经2位以上丰富经验的病理医师阅HE染色切片证实为胃腺癌,且术前均未接受化疗或放疗。
2.主要试剂
鼠抗人单克隆抗体 CD34(MAB-0034)、S-P超敏试剂盒(鼠/兔)(KIT-9710),购自福州迈新生物技术有限公司。鼠抗人单克隆抗体HIF-1α克隆号SC-53546(即 用 型 )、浓 缩 型 DAB 试 剂 盒 (ZLI-9018),购自北京中杉金桥生物技术有限公司。PAS染色液为安徽医科大学病理教研室配制。
3.CD34和PAS双重染色方法及VM结构的观察
首先采用链霉素抗生物素蛋白-过氧化物酶(SP)法,进行CD34免疫组织化学染色,DAB显色后水流冲洗1min。然后置于0.5%的高碘酸溶液中还原10min,水流冲洗2min后置于Schiff液中,避光环境下PAS液反应15min,自来水冲洗2min,蒸馏水返色10min。苏木精浅染细胞核,脱水,透明,封片。CD34和PAS双重染色的切片在显微镜下观察,肿瘤细胞围成内含红细胞的管腔样结构,管腔壁未见CD34阳性、呈梭形的内皮细胞环绕,此种管腔样结构判定为VM;管壁有CD34阳性细胞和PAS阳性的基底膜样结构,无论管腔内有无红细胞,均判定为内皮依赖性血管。
4.HIF-1α免疫组化染色及结果判定
将胃腺癌标本根据是否存在VM设为VM阳性组和VM阴性组,进行HIF-1α免疫组织化学染色。HIF-1α免疫组织化学染色方法与CD34免疫组织化学染色步骤一致,但无PAS复染步骤,在DAB显色后即进行苏木精衬染,脱水透明,封片。结果判定:HIF-1α蛋白以细胞核内有棕黄色细颗粒为阳性,高倍镜(×400)下每张切片随机选择5个视野,计数200个细胞/视野,共计1000个,无阳性细胞为阴性(-),阳性细胞数<10%为(+),10%-50%为(++),>50%为(+++)[4]。
5.统计学处理
应用SPSS 11.5软件进行χ2检验,P<0.05为差异有统计学意义。
结 果
1.胃腺癌标本中存在VM
121例胃腺癌患者中有44例存在VM,HE染色镜下观察管腔样结构由肿瘤细胞围成,无内皮细胞衬覆,管腔内有红细胞存在,管腔内不见坏死崩解的肿瘤细胞及炎细胞(图1)。CD34和PAS双重染色显示围成管腔的肿瘤细胞CD34染色均阴性,证实其不是内皮细胞(图2,3),部分病例可见一层断续的或连续的PAS阳性物质围成基底膜样结构分开肿瘤细胞和红细胞。
2.胃腺癌组织中HIF-1α的表达情况及其与患者临床病理指标的关系
实验中HIF-1α蛋白在胃腺癌组织中的阳性率为62.81%(76/121)。HIF-1α主要定位于肿瘤细胞核(图4,5)。肿瘤间质也可见HIF-1α阳性细胞。肿瘤坏死区周围和肿瘤浸润边缘癌细胞HIF-1α表达明显增多。
胃腺癌组织中HIF-1α的表达与患者临床病理指标的关系(表1)。
3.胃腺癌组织中 HIF-1α的表达与VM 关系(表2)。
实验中VM阳性组和VM阴性组HIF-1α蛋白表达阳性率分别为77.27%(34/44)和54.55%(42/77),两组之间的差异有显著性(P<0.05)。
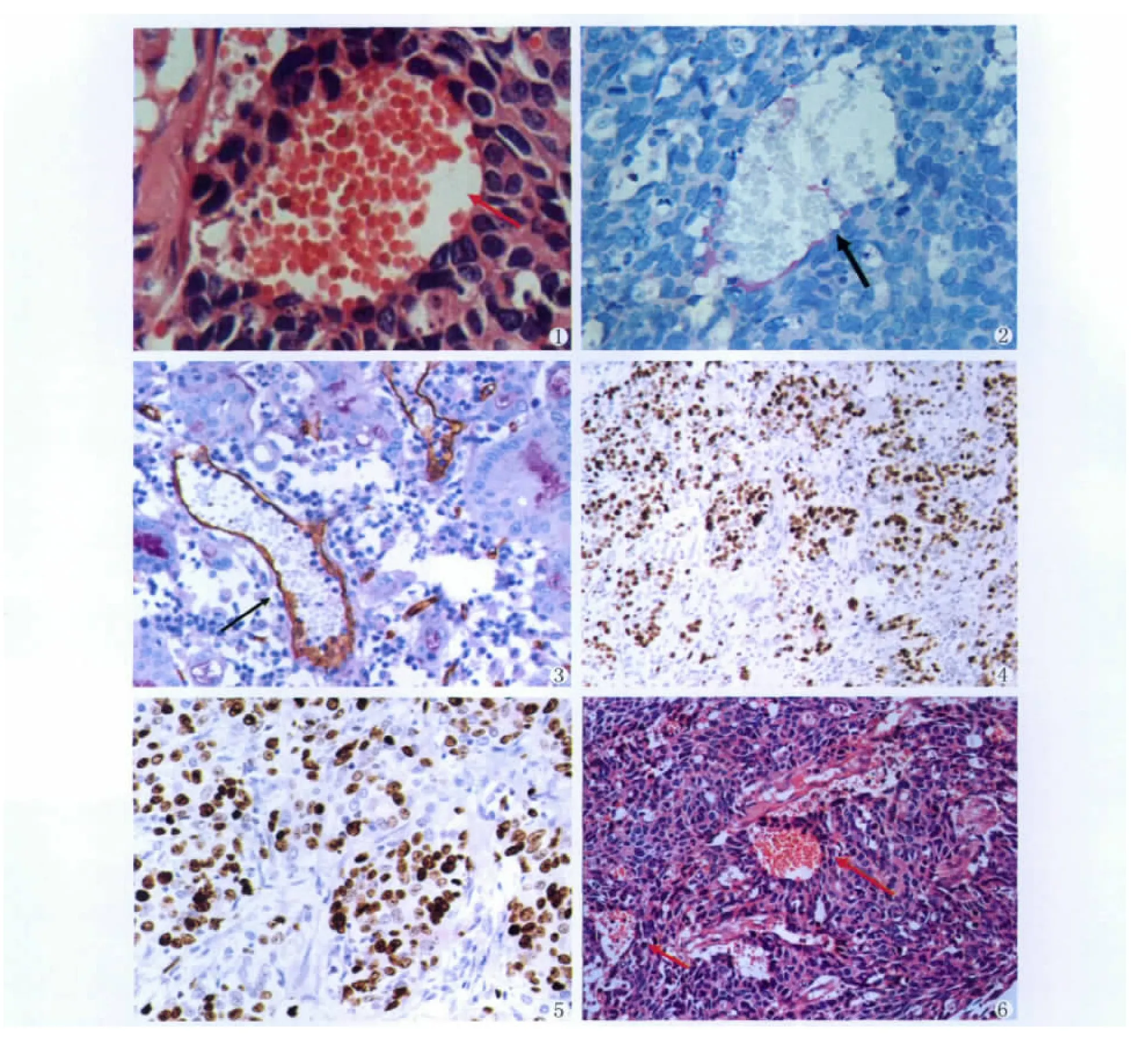
图1 箭头所示为胃腺癌中肿瘤细胞围成的VM.(HE×400)图2 箭头所示胃腺癌中肿瘤细胞围成的VM,围成管腔的肿瘤细胞CD34染色阴性,可见一层PAS阳性物质围成基底膜样结构分开瘤细胞和红细胞.(CD34和PAS双重染色×400)图3 箭头所示CD34阳性的内皮依赖性血管,与图2对比.(CD34和PAS双重染色×400)图4 胃腺癌组织中HIF-1α的阳性表达,表现为棕黄色颗粒定位于细胞核.(SP×200)图5 腺癌组织中HIF-1α的阳性表达,表现为棕黄色颗粒定位于细胞核.(SP×400)图6 箭头所示呈片状分布胃腺癌细胞中的VM.(HE×200)Fig.1 The arrow shows the VM enclosed by cancer cells of gastric carcinoma.(HE×400)Fig.2 The arrow shows the VM enclosed by cancer cells of gastric carcinoma.The CD34 staining of cancer cells that circle as tube cavity indicates negative.A layer of PAS positive substance,surrounding as a pattern of basement membrane,detaches cancer cells and red cells.(CD34 &PAS dual staining×400)Fig.3 The arrow shows endothelial dependent vessels of CD34 positive compares with Fig 2.(CD34&PAS dual staining×400)Fig.4 The positive expression of HIF-1αin gastric carcinoma,indicating yellow-brown particles are positioning in nucleolus.(SP×200).Fig.5 The positive expression of HIF-1αin gastric carcinoma,indicating yellow-brown particles are positioning in nucleolus.(SP×400)Fig.6 The arrow shows that VM distributes in sheets pattern in gastric adenocarcinoma cells.(HE×200)
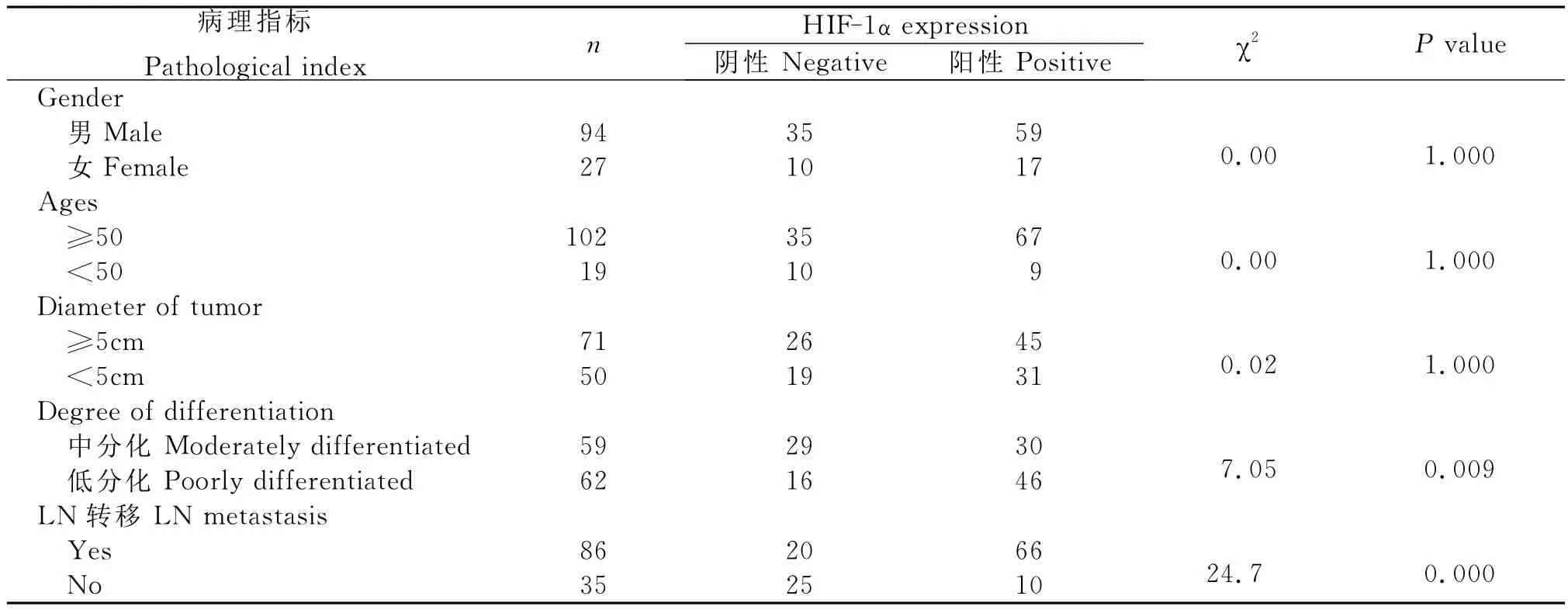
表1 HIF-1α表达与胃腺癌患者临床病理指标的关系Table 1 Relationship between HIF-1αexpression and clinical pathology index of patients suffering from gastric adenocarcinoma

表2 HIF-1α表达与VM的关系Table 2 Relationship between HIF-1αexpression and VM
讨 论
1999年美国Iowa,s大学的 Maniotis和Folberg等[5,6]在研究葡萄膜黑色素瘤微循环时发现一种与经典的肿瘤血管生成途径不同的、不依赖于内皮细胞的肿瘤血管生成模式即VM。VM的特点是管腔内没有血管内皮细胞的衬覆,内皮特异标记的免疫组化染色(KDR、CD34、CD31等)呈阴性反应,肿瘤细胞模仿血管生成形成细胞条索围成管道样结构,血液在这无内皮细胞的管道样结构中流动。由于此种管道样结构无内皮细胞屏障,肿瘤细胞与血液直接接触,因此具有VM的恶性肿瘤临床特征为早期即可发生广泛的血道转移,肿瘤患者预后较差。随着对VM的研究,近年来已在一些高侵袭性恶性肿瘤中如卵巢癌、恶性胶质瘤等发现了VM[7,8]。本实验应用免疫组织化学和特殊染色技术在胃腺癌中证实了VM的存在。首先复习HE染色切片发现在一些中低分化的胃腺癌组织中存在由肿瘤细胞围成的管道样结构,管道内有红细胞存在,管壁未见梭形的内皮细胞衬覆。CD34和PAS双重染色后发现围成管道的肿瘤细胞CD34染色均阴性,证实其不是内皮细胞,腔内可见一层PAS阳性物质围成基底膜样结构分开肿瘤细胞和红细胞,管腔周围未见炎细胞浸润及肿瘤细胞坏死的组织碎片存在,提示该管腔并非肿瘤中央区域坏死后形成的空腔,而是一种功能性微循环。
恶性肿瘤的发生与细胞的过度增殖有关,而肿瘤细胞的增殖需要消耗大量的氧和营养物质,虽然恶性肿瘤具有诱导血管生成的能力并形成微血管网,但由于微血管网结构和功能的不足,导致肿瘤缺氧和坏死持续存在[9-11],故缺氧是实体肿瘤微环境普遍存在的一种现象。HIF-1α是缺氧条件下广泛存在于哺乳动物和人体内的一种转录因子,其过度表达与肿瘤细胞的增殖、浸润、转移等密切相关[12]。HIF-1α下游靶基因众多,包括 VEGF、EPO、Nos、Fit-1、葡萄糖转运因子1、3、糖酵解等,这些基因的表达可导致肿瘤组织氧运输能力增强、肿瘤细胞有氧代谢减慢而无氧代谢增强以及诱导肿瘤新生血管的形成等,这些都使得肿瘤细胞在缺血缺氧环境中易于生存并发生局部浸润、转移[13-14]。本实验研究结果显示,HIF-1α蛋白表达在胃腺癌组织中的阳性率为62.81%(76/121),且与肿瘤的淋巴结转移及分化程度密切相关。提示肿瘤的分化程度越低,肿瘤细胞恶性程度越高,瘤细胞增殖更为迅速、更易缺氧,HIF-1α可能通过转录激活氧的运输、糖代谢、肿瘤血管形成等过程中的靶基因,从而影响肿瘤细胞生长、分化、存活,使得肿瘤细胞能适应缺氧的微环境,并不断增殖、浸润和转移。笔者在观察中还发现VM在肿瘤细胞呈片块状分布者中更多见(图6),可能是呈片块状生长的肿瘤细胞更易缺氧,单纯依靠内皮依赖性血管不足以满足肿瘤自身生长需要。从而肿瘤通过一系列分子事件启动促进VM形成的信号转导通路,部分肿瘤细胞模拟血管通道,以保证肿瘤的血液供应。本实验结果显示,VM阳性组出现HIF-1α阳性的比例高于VM阴性组,两组之间的差异有统计学意义(P<0.05),提示与VM生成相关的分子或基因可能是HIF-1α下游基因产物的作用靶点,HIF-1α是VM形成和肿瘤生长的促进因素。Hentrix等[15]在黑色素瘤裸鼠移植瘤模型中发现缺氧环境使恶性黑色素瘤细胞基因型发生改变,成为胚胎干细胞,并表达某些血管内皮细胞基因,使其能够作为血管内皮细胞样细胞参与VM的形成。还有学者[16]研究发现缺氧能诱导卵巢癌细胞SKOV3和ES2细胞高表达HIF-1αm RNA并形成VM,而在常氧条件下不能形成微管道,且表达HIF-1αm RNA极弱。这些结果均提示了缺氧导致的基因表达改变可能在VM形成过程中起了关键作用。
迄今为止,HIF-1α促进VM 形成的具体机制尚不清楚,这将是笔者今后研究的重点,希望通过笔者的研究可以为抑制肿瘤血液供应提供新的思路。
[1]Pisani P,Parkin DM,Bray F,et al.Estimates of worldwide mortality from 25 cancers in 1990.Int J Cancer,1999,83(1):18-29
[2]Van der Schaft DW,Hillen F,Pauwels P,et al.Tumor cell plasticity in Ewing sarcoma,an alternative circulatory system stimulated by hypoxia.Cancer Res,2005,65(24):11520-8
[3]Zhang S,Guo H,Zhang D,et al.Microcirculation patterns in diffenent stages of melanoma growth.Oncol Rep,2006,15(1):15-20
[4]薛洪燕,施红旗,陈志梅等.乳腺浸润性导管癌中AQP1、HIF-1α、VEGF的表达及意义.浙江实用医学,2010,15(2):91-93
[5]Bissel MJ.Tumor plasticity allows vasculogenic mimicry,a novel form of angiogenic switch.A rose by any other name.Am J Pathol,1999,155(3):675-679
[6]Sood AK,Fleteher MS,Coffin JE,et al.Functional role of matrix metalloproteinase in ovarian tumor cell Plasticity.Am J Obstet Gynecol,2004,190(4):899-909
[7]Li M,Gu Y,Zhang Z,et al.Vasculogic mimicry:a new prognostic sign of gastric adenocarcinoma.Pathol Oncol Res,2010,16:259-266
[8]El Hallani S,Boisselier B,Peglion F,et al.A new alternative mechanism in glioblastoma vascularization:tubular vasculogenic mimicry.Brain,2010,133:973-982
[9]Su M,Feng YJ,Yao LQ,et al.Plasticity of ovarian cancer cell SKO-V3ip and vasculogenic mimicry in vivo.Int J Gynecol Cancer,2008,18(3):476-486
[10]Hess AR,Seftor EA,Gruman LM,et al.Ve-cadherin regulates Eph A2 in aggressive melanoma cells through a novel signaling pathway:implications for Vasculogenic mimicry.Cancer Biol Ther,2006,5:228-233
[11]Fujimoto A,Onodera H,Mori A,et al.Tumour plasticity and extravascular circulation in ECV304 human bladder carcinoma cells.Anticancer Res,2006,26:59-69
[12]Semenza GL.Defining the of hypoxia inducible factor in cancer biology and therapeutics.Oncogene,2010,29(5):625-634
[13]张伟锋,朱宏,曾楷峰等.RNA干扰 HIF-1α对食管鳞癌细胞糖酵解相关基因表达的影响.南京医科大学学报(自然科学版),2010,30:905-909
[14]屈振杰,张惠洁,郭卫东.Livin、缺氧诱导因子-1α在结肠癌中的表达及意义.中华临床医师杂志(电子版),2011,5:3005-3007
[15]Hendrix MJ,Seftor RE,Seftor EA,et al.Transendothelial function of human metastatic melanoma cells:role of the microenvironment incell-fate determination.Cancer Res,2002,62:665-668
[16]Yao LQ,Feng YJ,Ding JX,et al.Primary study of vasculogenic mimicry induced by hypoxia in epithelial ovarian carcinoma.ZhonghuaFuchanke Zazhi,2005,40:662-665
