酸碱平衡体系基于Excel的直观计算
2012-12-31王业根
王业根
盐城卫生职业技术学院,江苏盐城 224005
酸碱平衡体系的计算一般有代数法、图解法、计算机法。代数法是基础,其他两种方法是工具[1]。代数法的关键是推导前与推导中表达式的简化,不恰当的简化容易引起较大的误差。图解法需要准备多种图形模板,准确度不高,对于复杂体系无能为力。计算机法可以达到较高的准确度,但必须选择简便、直观的软件[2]。
基于Excel工作表与宏,建立包含公式的酸碱平衡体系模板,计算滴定过程中的酸度变化,绘制滴定曲线,判断滴定突跃,整个过程简便直观。该方法可修改参数,求解未知量(如酸度、物料浓度与体积、酸常数、缓冲容量等),同时由于没有计算公式的简化,计算结果更为准确。
1 原理
1.1 共轭酸生成常数
酸碱常数是酸碱平衡体系计算的理论基础。为了与滴定常数表达一致,建议统一改用共轭酸生成常数(质子化常数)。以三元弱酸为例。

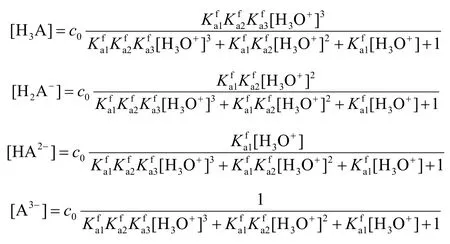
1.2 型体平衡浓度
多种溶液混合时,溶液总体积增大,物料分析浓度应通过稀释公式计算。型体平衡浓度与物料分析浓度和型体浓度分数(分布系数)有关,型体浓度分数则取决于共轭酸生成常数与酸度。以三元弱酸为例。
1.3 质子平衡方程
酸碱反应的本质是质子传递,酸碱平衡体系中得到质子的物质的量应该等于失去质子的物质的量。选择所投物料为零水准,建立质子平衡方程。以NaOH滴定H3PO4、HAc混合酸为例,选择H2O、H3PO4、HAc、NaOH为参考水准,质子平衡方程为:
[H3O+]+c0(NaOH)=[OH−]+[H2PO4−]+2[HPO42−]+3[PO43−]+[Ac−]
NaOH中的OH-是水溶液中的最强碱,全部得到质子生成H2O,在质子平衡方程中用c0(NaOH)表示。
1.4 滴定过程分析
随着滴定剂的不断滴入,溶液总体积不断增加,物料分析浓度不断变化,用迭代法计算滴定过程中的酸度变化,绘制滴定曲线,判断滴定突跃。
1.5 求解未知变量
可变更多个已知条件,如共轭酸生成常数、物料投放浓度与体积、酸度等,以得失质子的物质的量相等为目标,求解未知变量。
1.6 计算缓冲容量
在溶液中加入微量强酸或强碱,计算酸度变化,相应得到溶液的缓冲容量。
2 方法
2.1 Excel工作表的构造
在Excel工作表B2∶M9区域预留条件设置单元格(如图1,不包括图中数据,下同)。在Excel工作表B10∶M18区域预留平衡体系计算单元格(如图2)。在Excel工作表B35∶M1137区域预留滴定过程计算单元格(如图3)。在Excel工作表I22∶M32区域预留滴定突跃范围计算单元格,根据滴定剂目标体积百分数与pH绘制滴定曲线(无数据点平滑线XY散点图),如图4。建立用于存放常见物料参数的“参数表”工作表。
2.2 Excel宏的构建
在Excel界面,执行菜单“工具-宏-Visual Basic编辑器”。在VBA编辑器,执行菜单“插入-模块”,输入宏代码。关闭VBA编辑器,回到Excel界面,创建三个超链接(平衡体系计算、酸度计算、缓冲容量计算)并指向相应的宏,保存Excel工作簿。
3 应用
以0.1mol/L的NaOH滴定10mL 0.1mol/L的H3PO4与10mL 0.1mol/L的HAc混合酸为例。打开已建立的Excel文件,单击“平衡体系计算”,依次输入(1)被测溶液中各种物料的化学式、投放浓度与体积(H3PO4、0.1、10、HAc、0.1、10);(2)滴定剂中各种物料的化学式与投放浓度(NaOH、0.1);(3)H2O的投放体积(0);(4)滴定剂目标体积(40);(5)滴定过程中型体平衡浓度取值公式(H3PO4、F14、H2PO4-、F15、HPO42-、F16、PO43-、F17、HAc、G14、Ac-、G15、H3O+、E13、OH-、E15);(6)滴定突跃控制误差(0.5,百分号不输入);(7)化学计量点时滴定剂体积(10、20、30,系统建议的体积可能稍有偏差)。
3.1 滴定过程数据解读
3.1.1 滴定开始前[H3O+]≈[H2PO4-]≈1.6×10-2mol/L,体系的酸度主要由H3PO4的一级解离所决定,H3PO4一级解离出的H3O+抑制了HAc的解离,[Ac-]≈5.5×10-5mol/L,见图3。
3.1.2 滴定过程中 pH↑,[H3PO4]↓,[H2PO4-]先↑后↓,[HPO42-]先↑后↓,[PO43-]↑,[HAc]↓,[Ac-]先↑后↓,[OH-]↑,型体平衡浓度的变化既与酸度有关,又受到溶液总体积的影响,见图3。
3.1.3 pH变化 分别有三个突跃,第一个突跃为NaOH与H3PO4生成NaH2PO4,第二个突跃为NaOH与HAc生成NaAc,第三个突跃为NaOH与NaH2PO4生成Na2HPO4。只有第三个突跃pH=9.26~10.09,|△pH|=0.83,可选用酚酞指示剂进行滴定,见图4。
3.2 求解未知变量
3.2.1 改变条件,重新计算酸度 例如,将NaOH溶液体积改为30.00mL,单击“酸度计算”,溶液的pH为9.67。
3.2.2 设定酸度,计算滴定误差 例如,将pH改为10.00,执行“工具-单变量求解”,使比值为1,NaOH溶液体积为30.06mL,滴定终点误差为+0.2%。
3.2.3 改变条件,计算缓冲容量 例如,将NaOH溶液体积改为25.00mL,单击“缓冲容量计算”,溶液的缓冲容量为0.013。

图1 已知条件设置

图2 平衡体系计算
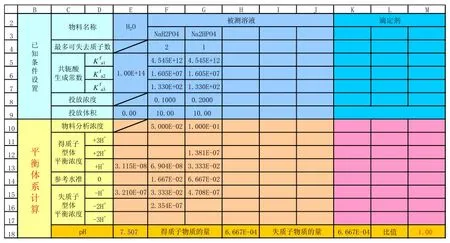
图5 nNaH2PO4-Na2HPO4混合溶液中型体平衡浓度的取值
4 讨论
4.1 关于共轭酸生成常数
共轭酸碱常数数值上与电离常数一致。将电离常数统一改成共轭酸生成常数,有时显得不太习惯。本系统已设置好常见共轭酸生成常数,对于新的物料只需要输入共轭酸的电离常数,系统将自动转换成共轭酸生成常数,并增补进参数表,便于日后再次使用。
4.2 关于最多可失去质子数p
对于一、二、三元强酸(或弱酸),p分别为1、2、3。对于一、二、三元强碱,p分别为-1、-2、-3。对于弱碱,p为0。对于两性离子,如HCO3-、HPO42-、H2PO4-,p分别为1、1、2。
4.3 关于存在多个共轭体系的物料
以20mL 0.10mol/L的(NH4)2CO3溶液为例,该溶液中除H2O外,还存在着NH4+/NH3、H2CO3/HCO3-/CO32-两个共轭体系,可作为10mL 0.40mol/L NH4+与10mL 0.20mol/L CO32-两种物料输入,计算结果pH=9.18。
4.4 关于滴定剂
如滴定剂由多种物料组成,滴定过程中,各物料将共用体积项。如滴定剂目标体积设置过小,可能观察不到某些滴定突跃,此时应适当增加滴定剂目标体积。
4.5 关于共轭体系
如果有多种物料属于同一个共轭体系,则需要注意型体平衡浓度的加和。以NaH2PO4与Na2HPO4混合溶液为例(见图5),各型体平衡浓度取值公式如下:
H3PO4H2PO4-HPO42-PO43-
F13+G12 F14+G13 F15+G14 F16+G15。
[1]孟凡昌,蒋勉.分析化学中的离子平衡[M].北京:科学出版社,1997:8-10.
[2]赵鑫,王殿书,丛培盛,等.pH精算及酸碱滴定曲线绘制通用软件的开发[J].计算机与应用化学,2010,27(2):257-261.
