阻断腹腔淋巴回流减轻重症腹腔感染大鼠急性肺损伤
2012-12-31张淑坤崔乃强卓玉珍张艳敏
张淑坤,崔乃强,卓玉珍,傅 强,张艳敏
肠道有丰富的淋巴管和完整的淋巴引流系统,肺是首个接纳肠道回流淋巴的器官,临床和动物实验也发现,在重症腹腔感染发生时,最先受损的肠外器官也是肺[1-2],所以我们推测腹腔淋巴系统是重症腹腔感染并发急性肺损伤(acute lung injury,ALI)时细菌和内毒素移位的主要途径。本研究采用人工胃液联合大肠杆菌腹腔内注射制备大鼠腹腔感染模型,之后行胸导管结扎和引流,旨在探讨阻断腹腔淋巴回流对腹腔感染大鼠肺损伤的影响。
1 材料和方法
1.1 材料
1.1.1 动物 健康雄性Wistar大鼠40只,体质量(280±20)g,购于中国医学科学院实验动物研究所。
1.1.2 主要试剂 取10.5%盐酸16.4mL,胃蛋白酶(sigma公司)10g,加生理盐水至1000mL,配制成pH=1.5的人工胃液。大肠杆菌菌株来自临床腹膜炎病人,经全自动微生物分析系统(VITEK-AMS)鉴定为大肠杆菌(E.Coli)后接种、培养,配制成2×109cfu/mL的细菌悬浊液。MPO测定试剂盒和考马斯亮兰蛋白测定试剂盒为南京建成生物公司产品,TNF-α检测试剂盒购自Cusabio公司。
1.2 方法
1.2.1 模型制备和处理 40只健康雄性Wistar大鼠,随机分为假手术(SO)组、腹腔感染模型(IAI)组、胸导管结扎(TL)组和胸导管结扎加引流(TLD)组。适应性饲养1周,实验前12h禁食,自由饮水。采用人工胃液联合大肠杆菌腹腔内注射制备大鼠腹腔感染模型[3],SO组以等量10%BaSO4营养肉汤取代菌液注射。TL组于制模后2h以10%水合氯醛3mL/kg腹腔注射麻醉,备皮,消毒,腹正中切口进腹后,将肝、胃推向上方,小肠和左肾翻向右侧,于脊柱左侧约1cm处打开后腹膜,找到位于腹主动脉左后方乳白色、半透明状的胸导管腹段,于靠近膈肌处穿线结扎胸导管。TLD组在结扎胸导管后,在近端以弯成鱼钩状的7号头皮针引流淋巴液(图1),生物胶固定后还纳腹腔脏器,湿纱布覆盖切口并保持湿润状态。持续引流4h,可获得淋巴液约1.2mL。制模后6h各组大鼠分别行右主支气管肺泡灌洗,留取BALF行细胞学分析。距回盲部5~10cm处取末端回肠5cm,和左下肺叶组织行苏木精-伊红染色观察病理改变。继续取5cm末端回肠和左肺上叶,应用酶化学法检测肺和回肠组织MPO活性。

图1 大鼠胸导管引流
1.2.2 右主支气管灌洗和BALF分析 处死大鼠,解剖游离出右主支气管,T形切口,用尖端剪成楔形的塑胶管插入3cm并缝扎固定。用2mL生理盐水行肺泡灌洗2次,滞留5min后缓慢吸出。将两次BALF放入同一离心管中,1500r/min离心10min,回收上清,按试剂盒说明考马斯亮兰法检测BALF中蛋白含量,ELISA检测TNF-α含量。用1mL生理盐水重悬细胞沉淀,取30μL重悬液涂片,进行细胞分类计数。
1.2.3 肺和回肠组织MPO活性 按试剂盒说明化学比色法测定。
1.2.4 肺和回肠组织HE染色 末端回肠和左肺下叶用10%福尔马林溶液固定,石蜡包埋,5μm厚度连续切片,常规HE染色,在光学显微镜下观察肺组织和肠黏膜组织病理改变。
2 结果
2.1 肺和回肠组织病理学改变 光镜下,SO组大鼠肺血管、肺泡间质和肺泡上皮小叶间质均正常。IAI组肺肺毛细血管扩张充血,肺泡壁间质明显增宽,可见断裂、融合,大量炎细胞浸润及广泛实质样变。TL组和TLD组肺泡间质破坏、炎细胞浸润等病理损伤均有所减轻(图2A)。SO组大鼠回肠绒毛结构完整。IAI组和TL组大鼠肠黏膜上皮细胞坏死,绒毛剥脱,变矮,固有膜层有大量炎细胞浸润。TLD组炎细胞浸润和绒毛脱落减少,黏膜厚度及绒毛高度均有改善(图2B)。
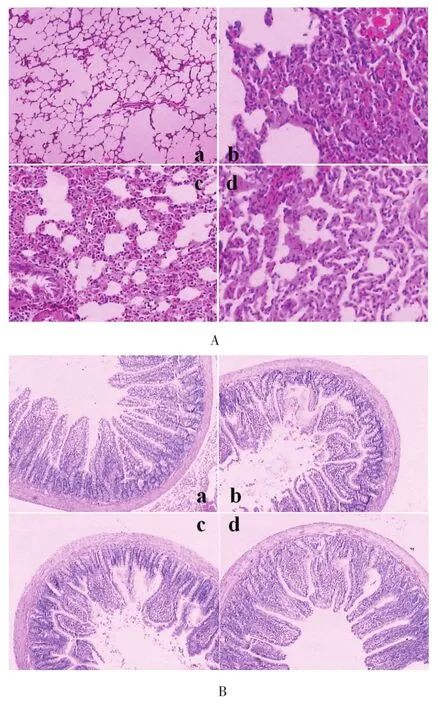
图2 各组大鼠肺(A)和回肠(B)组织病理学变化(HE染色,×200,a SO组、b IAI组、c TL组和d TLD组)
2.2 肺和回肠组织MPO水平 IAI组大鼠肺组织MPO活性较SO组升高(P<0.05);TL组和TLD组大鼠肺组织MPO活性较模型组均降低(P<0.05)。SO组和TL组大鼠回肠组织MPO活性较假手术组升高(P<0.05),TLD组大鼠肺组织MPO活性较IAI组降低(P<0.05,见表1)。
2.3 BALF中性粒细胞百分率变化 IAI组BALF的中性粒细胞百分率高于SO组(P<0.05),TL组和TLD组中性粒细胞百分率均较IAI组降低(P<0.05,见表2)。
2.4 BALF蛋白和TNF-α含量变化 IAI组BALF蛋白和TNF-α含量均高于SO组(P<0.05),TL组和TLD组蛋白和TNF-α含量均较IAI组降低(均P<0.05,见表3)。
表1 各组大鼠肺和回肠组织MPO变化(±s,U/g)

表1 各组大鼠肺和回肠组织MPO变化(±s,U/g)
注:与SO组比较,aP<0.05;与IAI组比较,bP<0.05
组别SO组IAI组TD组TDL组肺0.71±0.14 1.24±0.35a 0.86±0.24b 0.91±0.21b回肠0.58±0.12 1.26±0.26a 1.41±0.42b 0.72±0.25b
表2 各组大鼠BALF白细胞比例变化(±s,%)

表2 各组大鼠BALF白细胞比例变化(±s,%)
注:与SO组比较,aP<0.05;与IAI组比较,bP<0.05
组别SO组IAI组TD组TDL组中性粒细胞3.20±1.32 8.93±2.89a 4.99±2.01b 5.22±1.54b巨噬细胞87.55±5.81 85.25±5.27 86.50±7.07 86.17±5.46淋巴细胞9.25±5.11 5.82±4.07 8.50±7.02 9.87±4.27
表3 各组大鼠BALF蛋白和TNF-α含量变化(±s)

表3 各组大鼠BALF蛋白和TNF-α含量变化(±s)
注:与SO组比较,aP<0.05;与IAI组比较,bP<0.05
组别SO组IAI组TD组TDL组蛋白(g/L)0.19±0.04 0.59±0.1a 0.26±0.08b 0.24±0.07b TNF-α(μg/g)3.20±1.19 4.71±1.22a 3.38±1.07b 3.58±0.99b
3 讨论
祖国医学认为,肺与大肠通过经脉联系,一阴一阳表里相对,脏腑阴阳表里相合。肺的肃降决定着肠的通降传导,同时肠的通降传导又反过来影响着肺的肃降。临床上根据这一理论,采用通里攻下法治疗重症腹腔感染取得良好疗效[4]。尽管“肺与大肠表里”这一传统理论经受了现代医学临床实践的检验和考验,但仍缺乏客观证据阐明两者的相互联系途径和作用机制。“腹腔感染导致肺损伤”在中医理论属于肺与大肠相表里的“肠病及肺”的范畴,明确腹腔感染导致肺损伤的途径问题,将为“肺与大肠相表里”的临床应用提供新的理论和实验依据。
腹腔感染时,中性粒细胞在肺组织的粘附、聚集和激活,被认为是造成组织损伤的第一步,同时也是引起炎症瀑布效应,造成其他重要器官损伤的机制之一[5]。MPO是中性粒细胞的标志物。我们采用人工胃液联合大肠杆菌腹腔内注射法制备大鼠腹腔感染模型,检测各组大鼠肺组织MPO活性、BALF的中性粒细胞百分比和蛋白含量,观察肺组织病理变化,结果表明,胸导管结扎或引流均能能减轻肺组织中性粒细胞浸润和病理损伤,减少BALF中蛋白漏出。这些结果提示,阻断腹腔淋巴回流能减轻肺组织中性粒细胞集聚造成的病理损伤,淋巴途径在腹腔感染早期并发ALI中起主要作用。
ALI的特征是由肺间质急性炎症反应导致的肺内皮和上皮细胞屏障损伤,细胞因子和炎症介质作为重要的信号因子,在启动、放大和延续局部和全身炎症反应中起重要作用,其中TNF-α是炎性反应中释放最早的内源性前炎性因子[6-7]。在腹腔感染大鼠模型的BALF中,我们检测到TNF-α含量较对照大鼠升高,而胸导管结扎或引流均能减少BALF中TNF-α含量,说明阻断腹腔淋巴回流能减少肺组织炎性细胞因子TNF-α释放,从而减轻或阻止肺脏和全身炎症反应。在本研究中,值得注意的是胸导管结扎在减轻肺组织中性粒细胞浸润和病理损伤的同时,却加重了回肠中性粒细胞浸润和病理损伤,而胸导管结扎并引流能同时减轻肺和回肠组织中性粒细胞浸润和病理损伤。这一结果提示,胸导管中的淋巴液具有组织损伤性,可能是导致器管功能障碍的来源[8]。
既往我们对肠源性内毒索移位后在腹腔感染大鼠各脏器和体液中的分布进行了研究,发现胸导管淋巴液中的内毒素含量明显高于门静脉和股静脉血中的内毒素含量[9]。结合本实验结果表明,在重症腹腔感染早期所致肺损伤中起主要作用的是淋巴途径,而非门静脉途径,同时也提示胸导管中的淋巴液可能是导致器管损伤的最初来源。
[1]崔乃强,赵琪,葛智慧,等.通里攻下法治疗急腹症所致MODS的疗效观察[J].中国中西医结合外科杂志,1996,2(5):315-320.
[2]Tariq M,Moutaery AA,Arshaduddin M,et al.Fluconazole attenuates lung injury and mortality in a rat peritonitis model[J].Intensive Care Med,2003,29(11):2043-2049.
[3]喻文立,崔乃强,刘洪斌,等.清热解毒方剂对腹腔感染大鼠肠黏膜屏障功能的影响[J].中国中西医结合外科杂志,2009,15(3):305-308.[4]崔乃强,傅强,邱奇,等.通里攻下法对SIRS/MODS的治疗价值——多中心临床分析[J].中国中西医结合外科杂志,2007,13(1):3-7.
[5]朱义用,景炳文,娄永华.肠源性感染致早期肺损伤模型的制备及其机制探讨[J].中国危重病急救医学,2000,12(9):541-545.
[6]Togbe D,Schnyder-Candrian S,Schnyder B,et al.Toll-like receptor and tumour necrosis factor dependent endotoxin-induced acute lung injury[J].Int J Exp Pathol,2007,88(6):387-391.
[7]Jesmin S,Yamaguchi N,Zaedi S,et al.Time-dependent expression of endothelin-1 in lungs and the effects of TNF-α blocking peptide on acute lung injury in an endotoxemic rat model[J].Biomed Res,2011,32(1):9-17.
[8]Deitch EA.Gut lymph and lymphatics:a source of factors leading to organ injury and dysfunction[J].Ann N Y Acad Sci.2010,12:E103-111.
[9]刘竞,崔乃强,赵琪,等.肠源性内毒素移位后的体内分布[J].中国急救医学,2000,30(3):146-147.
