梨种质资源SSR引物的筛选与评价
2012-12-29许靖诗乌云塔娜叶生晶冯延芝
许靖诗 ,乌云塔娜 ,叶生晶,王 淋 , 冯延芝
梨种质资源SSR引物的筛选与评价
许靖诗a,b,乌云塔娜a,b,叶生晶a,b,王 淋a,b, 冯延芝a,b
(中南林业科技大学 a. 经济林育种与栽培国家林业局重点实验室;b.林学院,湖南 长沙 410004)
目前在梨种质研究中仍然缺乏足够的SSR引物,因此筛选多态性丰富的SSR标记引物,为进一步研究梨种质资源的群体遗传学特征等提供参考。运用SSR标记技术,从初选后的42对SSR引物中筛选出多态性好、稳定性高的引物。筛选出的12对引物对40个梨样的DNA序列进行了SSR-PCR扩增, 共检测出159个等位基因,平均每个位点检测到13.25个等位基因;平均每个等位基因有效数目为1.236 4,平均I值为0.286 6,平均Nei指数值为0.165 3;系统聚类分析表明,所有样品可以分为3个类群,即栽培梨、日本梨、野生秋子梨。筛选的12对多态性丰富的SSR引物适合用于梨种质资源群体遗传学特征分析,为梨种质资源的收集、保存、鉴定、评价以及亲缘关系研究提供方法和理论依据。
梨;种质资源;SSR分子标记;引物筛选
梨为蔷薇科Rosaceae梨亚科Romoideae梨属Pyrus多年生果树,我国为梨属植物的发祥地, 境内蕴藏着丰富的梨属植物资源[1],对其研究也较多[2-4]。研究梨的遗传多样性对了解不同梨类型起源、进化、种质收集利用与保存均具有重要意义。多年来,研究者从形态学、生物化学、孢粉学和酶学等不同的角度研究了梨属植物的系统关系、品种起源和演化,取得了一定的进展。近年来,DNA标记技术的迅速发展为梨属植物的系统关系等研究提供了新的手段,SSR标记在树种的品种和亲缘关系鉴定等方面也得到了广泛应用。SSR(Simplesequence repeats,简单重复序列)又称微卫星(Micro satellite DNA),主要是1~6个核苷酸的重复序列,广泛存在于人类及动植物基因组中,因重复单位数目的差异形成了SSR位点上的多态性。与其他分子标记相比较,SSR具有以下优点:①共显性,能够提供比显性标记更多的信息;②位点丰富且随机均匀地分布在整个基因组中;③以PCR为基础,技术简便,易于操作,重复性及稳定性好。
近年来,国内外研究者利用SSR标记对梨属植物有了一定研究。例如,2009 年Terakami[5]构建的Housui 遗传图谱,总长度117 4 cm,17个连锁群、335个标记,其中105个SSR标记,224个AFLPs标记,分子标记之间的平均距离为3.5 cm。2007年曹玉芬等[6]利用12对SSR引物对41个梨品种进行扩增,获得114个等位基因。Kimura等[7]通过9对SSR引物鉴别6个种的60个亚洲梨,其中7个SSR引物能将58个品种区分开。
虽然,SSR标记在梨的遗传图谱构建、种质多样性分析、分子辅助育种以及品种鉴定等方面有所应用,但从梨属植物基因组中开发出的SSR引物较少,检测的SSR位点数不足以满足品种鉴别和起源演化研究的需要,因而需要加快引物开发速度,同时扩大种以及品种的鉴定数量和范围,为梨树种的形成与演化、品种鉴别与遗传多样性分析以及亲缘关系研究提供有效途径。
本研究利用SSR标记,以40份梨为供试材料,筛选适合的多态性引物,为进一步研究梨种质资源的群体遗传学特征、演化等提供技术支持。
1 材料与方法
1.1 材 料
1.1.1 实验材料
供试材料包括:采集于郑州果树所的2份秋子梨栽培种、3份砂梨、3份白梨、4份新疆梨、5份西洋梨,采集于内蒙古的6份野生秋子梨,黑龙江的6份野生秋子梨、吉林的3份野生秋子梨;4份日本栽培梨,4份日本岩手山秋子梨(见表1)。采集后的新鲜叶片保存于-80℃冰箱备用。
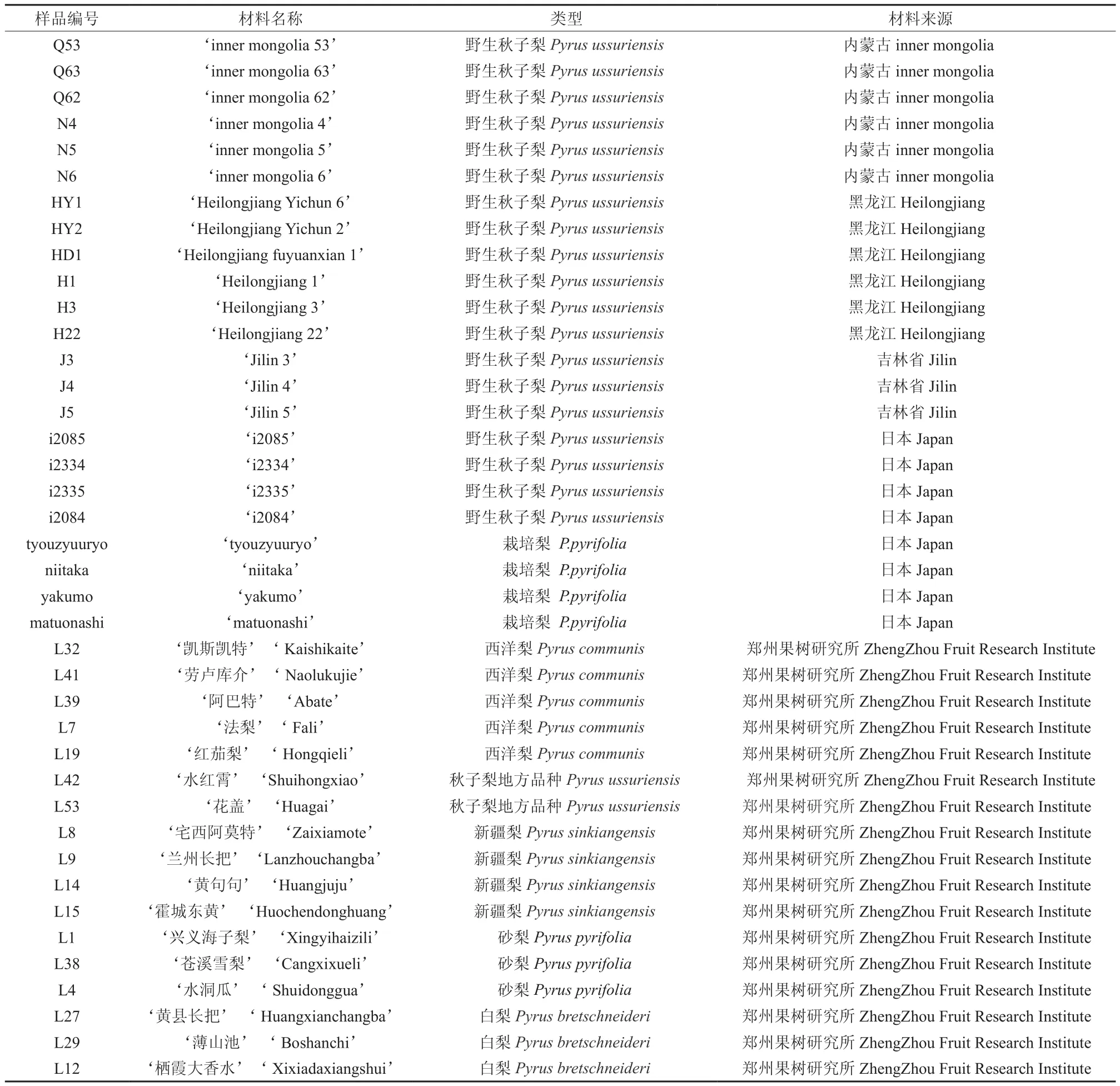
表1 用于SSR分析的供试材料Table1 The tested materials of Pyrus by SSR analysis
1.1.2 实验试剂
主要有:DNA提取试剂盒(购自TIANGEN)、CTAB、Tris、HCL、NaCl、NaOH、β-巯基乙醇、氯仿、异戊醇、乙二胺四乙酸二钠、无水乙醇、琼脂糖、尿素、硼酸、甲醛、丙烯酰胺、甲叉双丙烯酰胺、无水碳酸钠、冰乙酸、硝酸银、过硫酸铵、四甲基乙二胺、甲酰胺、溴酚蓝、二 甲 苯 胺、DNA Marker、dNTPs、PrimeSTAR DNA Polymerase。
1.1.3 主要仪器设备
主要仪器包括:离心机、离心管、研钵、旋转式恒温水浴锅、液氮罐、移液管、微量移液器、1.5 mL和0.5 mL吸头、电泳仪、水平电泳槽、成像凝胶系统、0.5 mL和1.5 mLEppendorf离心管、PCR仪、高压灭菌锅、电子天平、冰箱、稳压直流电泳仪、1 000 mL烧杯、玻璃棒。
1.2 实验方法
1.2.1 引物选择
SSR引物序列由日本开发,基因组DNA的SSR引物由南京金斯瑞公司合成。
1.2.2 DNA提取与检测
DNA 的提取按购自北京天根生物有限公司的植物DNA提取试剂盒(离心柱型)说明书进行,略作改动。提取的DNA在2﹪的琼脂糖电泳检测,并于-20 ℃保存备用。
1.2.3 PCR扩增
PCR反应在Bio-rad公司的扩增仪上进行。PCR反应体系采用正交设计优化的方法,其中酶对PCR反应影响最大,引物次之,模板DNA影响最小[8],最终反应体系见表2。PCR反应条件:(1)94°预变性3 min;(2)98°变性10 s;(3)60°退火5 s;(4)72°延伸 1 min;(5)返回(2),重复30个循环;(6)4°保存。

表2 PCR 扩增反应体系Table 2 PCR amplification reaction system
1.2.4 PCR产物的检测
1.2.4.1 电泳 电泳步骤: (1) 制备4﹪ 聚丙烯酰胺变性凝胶; (2) 将0.5× TBE电极液放入电泳槽内;(3) 小心拔出梳子,将胶板装入电泳槽内,1 200 V、150 mA、100 W预电泳30 min;(4) 扩增产物的变性:加入3×STR 5 mL, 95 ℃下变性5 min 后迅速用冰冷却; (5)将梳子插入,用电极液冲洗上胶面;(6)点样,点样量为4 μL, MARKER为2 μL;(7) 200 V、150 mA、100 W电泳1.5 h。
1.2.4.2 银染 银染方法和步骤:(1)固定:电泳完毕后,卸下玻璃板,用薄钢勺撬去未附有凝胶的玻璃板,将另一块玻璃板以凝胶面朝上浸入1 000 mL体积分数为10﹪的冰醋酸溶液中轻微震荡20 min。(2)水洗:将附有凝胶的玻璃板转移到清水中轻微震荡5 min,重复1次。(3)致敏:将附有凝胶的玻璃板转移至用1 g AgNO3、1.5 mL 37﹪甲醛溶于1 000 mL H2O中配成的致敏液中轻微震荡30 min。(4)水洗:以蒸馏水快速冲洗凝胶2次。(5)显色:将玻璃板放入显色液中,几分钟后即可见结果。显色液为30 g无水Na2CO3、1.5 mL 37﹪甲醛、200 μL Na2S2O3·5H2O 溶于 1 000 mL H2O 中配成。(6)终止:将显色后的凝胶分别放入第一步用过的冰醋酸以及清水中5 min。
1.2.5 SSR数据分析
各引物对应扩增出的等位基因依据分子量从大到小依次按1,2,3…进行编号。在相同迁移率位置上有带记为1 和无带记为0。在记录过程中,统计主要带型,忽略弱杂带型,统计稳定且易于分辨条带,同时考虑品种间带型的比对,构建SSR引物扩增结果的数据库。
2 结果与分析
2.1 引物筛选
利用8份梨样品对500对SSR引物进行初选,筛选出42个多态性好、带型清晰的引物,占总引物数量的8.4﹪。利用40份梨样品对初选的42对引物进行复选,共筛选出12对引物 (见表3) 。这些引物条带清晰,多态性好,稳定性好(见图1、图2),占总引物数量的2.4﹪,占初选引物的28.6﹪。12对引物覆盖了梨的11条染色体,其中引物CH02e02和引物NH009b同时分布在同一条染色体上,其余引物均分布在不同染色体上(见表3)。

表3 12对引物名称及序列Table 3 The name and sequence of 12 pairs of SSR primers

图1 引物NH039在40个内蒙野生秋子梨中的部分扩增情况Fig.1 Amplification results of NH039a for 40 Inner Mongolia Pyrus ussuriensis
2.2 引物多态性分析
筛选出的12对SSR引物在40份梨样中检测到的159个等位基因,平均每对SSR引物检测到13.25个等位基因。不同SSR引物检测到等位基因数不等,其中引物NB105检测到的等位基因数最多为24个,引物BGA35检测到的等位基因数最少,仅7个。产生片段差异最大的引物为NB104a,PCR 产物片段长度从122 bp 到186 bp,产生片段差异最小的引物为BGA35,PCR 产物片段长度从120 bp 到 132 bp (见表 4) 。
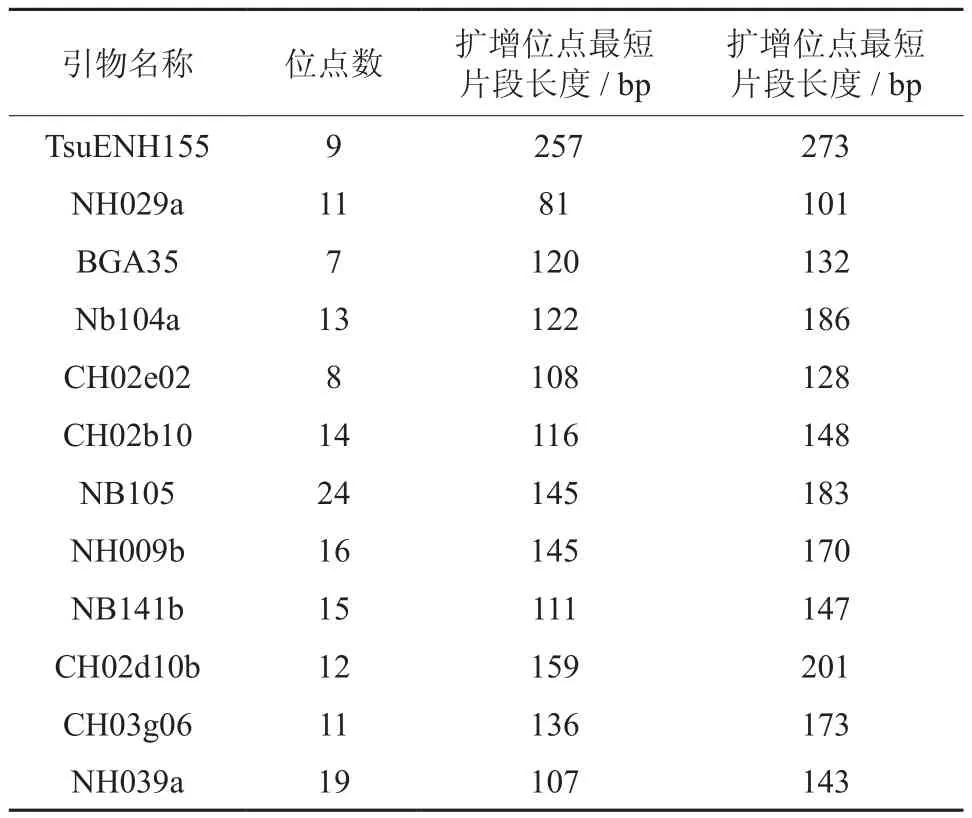
表4 SSR引物扩增梨种质位点多样性Table 4 Alleles diversity of different SSR primer amplified pear germplasm loci

图2 引物CH03g06在40个内蒙野生秋子梨中的部分扩增情况Fig.2 Amplification results of CH03g06 for 40 Inner Mongolia Pyrus ussuriensis
2.3 SSR位点分析
利用12对引物对40份梨样进行SSR检测表明:各位点平均等位基因有效数分布在1.153 2~1.401 0之间,平均每个位点的等位基因有效数目为1.236 4,其中BGA35平均有效等位基因最多,NB105最少。Nei指数(h)则是假定某一特定位点上的两个等位基因,根据各自的基因频率来计算多样性,分布范围在0.251 9~0.122 5之间,平均每个位点的h值为0.165 3。I=1-ΣPi2,Pi为产物条带的表型,根据扩增片段的有无确定产物条带表型,平均每个位点的I值为0.286 6,I值最高的TsuENH155为0.408 9,I值最低的NB105为0.232 6 (见表 5) 。
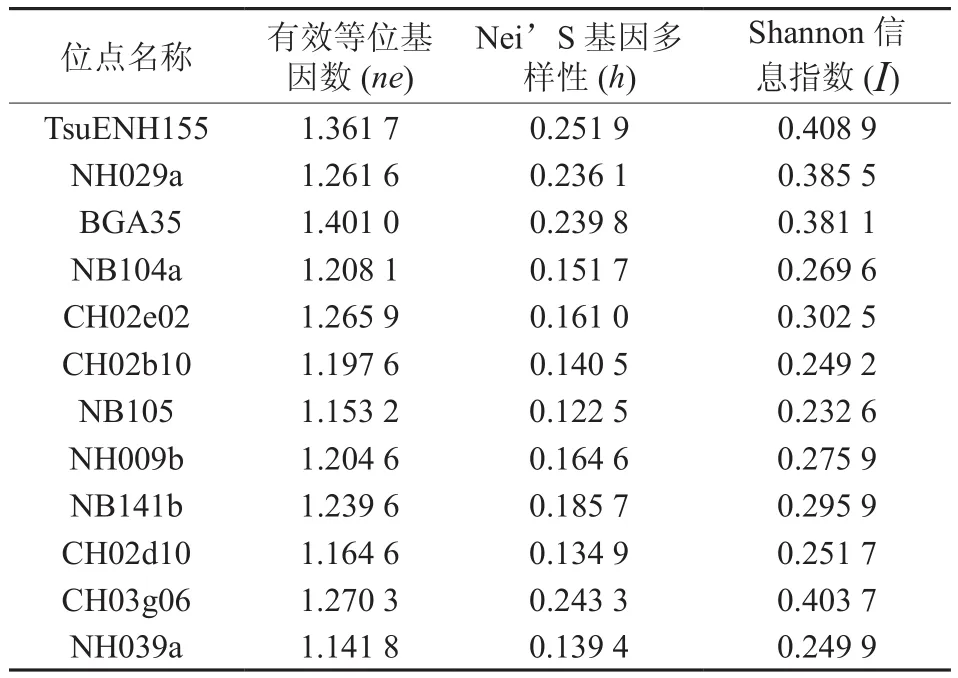
表5 各位点基因的多样性分析Table 5 Genetic diversity analysis of all locus
2.4 聚类树的构建与分析
聚类树建立的依据有2种, 其一是样品之间的相似性系数, 其二是样品之间基因型的遗传距离。本研究根据Nei’s遗传距离,利用POPGENE32软件构建遗传关系UPGMA聚类图(见图3)。
由图3可知,在遗传距离为1.075时L12、L38等14个栽培梨可单独聚为一类。在遗传距离为2.448时,i2085、matuonashi等8个日本梨即可与Q53等15个野生秋子梨聚为两类。同时日本梨可以分为两个亚群,即matuonashii等4个日本栽培梨为一个亚群,i2085等4个日本野生秋子梨为另一个亚群。聚类分析的结果与样品类型基本一致。由此表明所筛选出的SSR引物能有效区分不同类型,不同地区的梨种质资源。

图3 建立在12个SSR指纹数据基础上的40个梨样聚类Fig.3 An UPGMA dendrogram of 40 samples based on 12 SSRS fingerprint
3 结论与讨论
在本研究中,根据梨种质的花、果实、叶片等表型性状和地理位置差异等选择试验材料,由此样本筛选出的SSR引物对梨种质群体学研究等具有指导意义。本研究初选的42对SSR引物分布于梨的17条染色体上,覆盖了梨基因组,筛选出的12对分布于梨11条染色体上的高多态性核心SSR引物,可以扩增出清晰的条带。在聚类图中栽培梨、中国野生秋子梨以及日本梨各自聚为一类,较客观地反映群体结构和地域性差异等信息。在聚类分析中也出现了与群体结构不相符的现象:新疆梨L8单独聚为一类,可能是由于采集的样品L8可能为芽变品种;砂梨L1以及西洋梨L32与中国野生秋子梨聚为一类可能是由于实验所检测的多态性位点不够充足, 尚不足以把所有供试品种完全区分开来,因而还需继续开发新的引物。
2008 年张妤艳等[9]通过6对SSR引物对56份梨材料进行扩增检测到40个等位基因,平均每个位点检测到8个等位基因,而本研究平均每个位点检测到13.25个等位基因。2011 年路娟等[10]利用25对SSR引物对6个分属不同系统的160个梨资源进行多态性分析,共检测到407个等位基因,聚类分析将所有材料分为西洋梨和东方梨两大类。现在,SSR 分子标记技术日趋成熟,且简便易行,运用该技术系统分析我国已有的梨属种质资源,将成为未来发展的热点[11]。
虽然SSR分子标记可应用于梨遗传图谱、品种鉴定等方面,然而,对于遗传多样性的研究由于芽变品种通常只涉及极少数位点的变异,芽变品种和原品种无法通过SSR标记得以区分,仍需要开发可揭示更多遗传位点的SSR标记引物,或使用其他标记方法以提高对于芽变品种鉴别的效率。另外, SSR标记也存在不足,例如在判读扩增条带有无上受人为主观因素影响较大, 不同的人判读结果可能不一致, 因而如何减少人为因素的影响,是其改进的方向。
[1] 王 绪, 邓俭英, 方锋学.ISSR分子标记技术及其在园艺作物中的应用[J].广西农业科学, 2007, 38( 4 ): 371 -374.
[2] 刘 平 , 渠同立 , 郭俊波,等. 影响岗丘瘠薄地黄金梨优质高效生产的因素[J].经济林研究, 2010 ,28( 1 ): 90 -93.
[3] 李志辉 , 张 娟 , 张冬林,等. 日本藤梨果实品质及营养成分分析[J].经济林研究, 2010 ,28( 2 ): 96 -98.
[4] 郭兆夏, 朱 琳, 李星敏,等. 基于GIS 技术的陕西砂梨气候区划[J].经济林研究, 2010 ,28( 2 ): 88 -91.
[5] Terakmi S,Kimura T,Nishitani C,et al . Genetic linkage map of theJapanese pear Housui identifying three homozygous genomicregions [J].J. Japan Soc. Hort. Sci., 2009, 78(4) :417-424.
[6] 曹玉芬,刘凤之,高 源 . 梨栽培品种SSR 鉴定及遗传多样性[J]. 园艺学报,2007,34 ( 2) : 305-310.
[7] Kimura T,Shi Y Z,Shoda M, et al. Identification of Asianpear varieties by SSR analysis[J].Breeding Science,2002,52:115-121.
[8] 梁玉琴,李芳东,傅建敏, 等.化柿属植物SSR-PCR反应体系[J]. 经济林研究,2011,29(4):17-22.
[9] 张妤艳,吴 俊,张绍铃. 基于SSR 标记的梨资源遗传多样性分析[J].农业生物技术学报,2008,16 ( 6) :983-989.
[10] 路 娟,吴 俊,张绍铃. 不同系统梨种质遗传多样性与分类关系的SSR分析[J].南京农业大学学报,2011,34 (2):38-46.
[11] 孙玉彤. SSR分子标记在梨研究中的应用[J]. 河北农业科学,2011, 15 (4) : 45- 47,57.
SSR primer screening and assessment on pear germplasm resources
XU Jing-shia,b,WUYUN Ta-naa,b, YE Sheng-jinga,b, WANG Lina,b, FENG Yan-zhia,b
(a. Key Lab of Non-wood Forest Product of Forestry Ministry; b.School of Forestry , Central South University of Forestry and Technology, Changsha 410004,Hunan,China)
At present, the pear germplasm study lacks enough SSR primers, thus it is necessary to screened out SSR markers primer showing high polymorphismin and to further study the population genetic characteristics. The good polymorphism and high stability primers were selected out from the 42 pairs of SSR primers by SSR molecular primer. The 40 pear samples’ DNA sequence were amplified with 12 pairs of SSR primers by SSR-PCR technique, 159 alleles were detected, on average, 13.25 alleles were detected from per site. Each alleles effective number was 1.236 4, and the average I value was 0.286 6, the h value was 0.165 3. The system clustering analysis showed that all the samples can be divided into three groups: cultivation pear, the Japanese pear, Pyrus ussuriensis Maxim in China. The screened 12 pairs of polymorphic SSR primers were suitable for studying on collection, preservation, identification,evaluation and genetic relationship of pear germplasm resources.
pear; germplasm resources;SSR molecular markers; primer screening
S722.3; S661.2
A
1673-923X (2012)07-0080-06
2012-04-10
国家自然科学基金(编号:31000309)
许靖诗(1987—),女,四川省乐山市人,硕士研究生,研究方向为经济林栽培育种;E-mail:xujingshi870201@126.com
乌云塔娜(1975—),女,内蒙古通辽人,教授,博士, 主要从事经济林育种与栽培的研究;E-mail:tanatana@sina.com
[本文编校:谢荣秀]
