问题化教学设计与互动课堂的建立——以《离子键 离子晶体》为例
2012-12-28王希俭
王希俭
(江苏省苏州实验中学 江苏 苏州 215011)
一、教学思想
师生积极参与、交往互动、共同发展,这是最新的有效教学理念。 问题化教学设计可以让学生参与到富有成效的学习活动中,让学生有行为参与、认知参与又有情感参与,只有以积极的情感体验和深层次的认知参与为核心的全面参与,才能促进学生高层次的发展,教师设计一系列适合学生的问题化学习任务,培养学生的问题意识,通过对问题的探究,培养学生的思维能力、观察能力、表达能力,合作与交流让学生分享经验,让学生产生快乐感、成就感,使师生产生互动。 教师给予学生思考、活动、交往、实践的空间,教师当好课堂学习的组织者、引导着与合作者,问题设计符合学生的需求,有深度、新意和大的思维空间, 使问题成为学生发展核心的好载体,教师要有强烈的问题意识、研究意识,通过问题化教学设计与课堂互动而得到发展。
二、教学目标
(1)知识与技能:了解离子键、离子晶体的意义;理解离子键形成的条件、组成离子键的微粒,理解影响离子键强弱的因素以及定量衡量离子键强弱的方法。 能利用图表来认识离子键的实质和结果。 可与物理学中静电力的计算相结合,晶体的计算与数学的立体几何、物理学的密度计算相结合。
(2)过程和方法:在问题化情景中不断提出问题让学生思考、分析,养成问题意识,提高分析解决问题的能力。 通过数据材料和图表的分析,提高数据、图表解读能力。 通过实验探究活动,提高观察、动手能力。 理解离子晶体的概念、构成及物理性质特征,掌握常见的离子晶体的类型及有关性质。
(3)情感态度与价值观:体会化学键知识的生产、生活价值; 认识化学作为一门科学的本质和科技价值;形成资源综合利用和开发、循环经济的地位及发展的可持续性观念;体验化学理论在生产中的作用。 分析离子键的成键微粒和成键性质,培养学生知识迁移的能力和归纳总结的能力。
三、教学过程
问题1:演示钠在氯气中燃烧的实验,请描述金属钠与氯气发生反应的现象?
[设计意图]引入,从微观到宏观角度认识离子键的形成。
[学生观察]剧烈燃烧,放出大量的热,发出黄光,有大量的白烟生成,集气瓶中黄绿色气体颜色消失,生成物为白色固体。
问题2: 请解释为什么钠能与氯气发生剧烈的化学反应? 上述的白色固体构成的微粒是什么?
[设计意图]培养学生抽象思维能力。
[归纳]Na:1s22s22p63s1→Na+:1s22s22p6
Cl:1s22s22p63s23p5→Cl-:1s22s22p63s23p6
Na-e-→Na+
Cl+e-→Cl-
问题3:氯的电负性为3.0,钠的电负性为0.9,请从电负性的角度判断钠与氯气反应生成物是什么化学键?
[设计意图]从量的角度判断键的类型。
当元素的电负性差比较大,成键的两元素的电负性差用Δx 表示,当Δx>1.7,发生电子转移,形成离子键,所以该反应生成物是离子键
问题4:什么叫离子键?怎样从能量和平衡的角度解释生成物离子键的形成?
[设计意图]从能量和平衡的角度研究离子键。
阴、阳离子之间形成稳定化合物的静电作用。 形成离子键体系的势能与核间距之间的关系如图所示:
横坐标:核间距r;纵坐标:体系的势能V。 下面来考察Na+和Cl-彼此接近时,势能V 的变化。
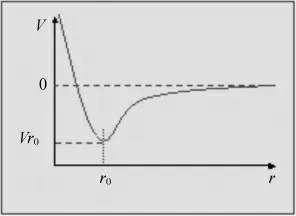
从图中可见:
r>r0, 当r 减小时, 正负离子靠静电相互吸引,V 减小,体系稳定。
r=r0时,V 有极小值,此时体系最稳定.表明形成了离子键。
r<r0时,V 急剧上升, 因为Na+和Cl-彼此再接近时,相互之间电子斥力急剧增加,导致势能骤然上升.
因此,离子相互吸引,保持一定距离时,体系最稳定,即当静电引力与静电斥力达到平衡时,形成稳定的离子键,整个体系达到能量最低状态。
问题5:哪些物质中存在离子键?
[设计意图]从化学键的角度认识、分类物质。
(1)活泼的金属元素(IA、IIA)和活泼的非金属元素(VIA、VIIA)形成的化合物。
(2)活泼的金属元素离子和酸根离子形成的化合物。
(3)铵根和酸根离子(或活泼非金属元素离子)形成的盐。
(4)活泼的金属元素和氢氧根离子形成的化合物。
问题6:阴、阳离子是否只在某个方向才能产生静电作用? 一个阳离子是否只能吸引一个阴离子?
[设计意图]认识离子键的特征。
通常情况下,阴、阳离子可以看成是球形对称的,其电荷分布也是球形对称的,在各个方向上都能与异性离子产生静电作用,只要空间条件允许,一个离子可以同时吸引多个带相反电荷的离子。 因此离子键没有方向性和饱和性。
特点:没有方向性,没有饱和性。
问题7:影响离子键强弱因素有哪些?怎样定量衡量离子键的强弱?
[设计意图]离子键强弱如何衡量。
(1)离子半径的影响;
(2)离子电荷数的影响。
F=Kq1q2/r2
离子半径越小、离子所带电荷越多,离子键就越强。
离子键强弱衡量标准——晶格能。
意义: 拆开1mol 离子晶体使之形成气态阴离子和阳离子所吸收的能量。
符号和单位:U;kJ·mol-1
例如: 拆开1mol NaCl 晶体使之形成气态钠离子和氯离子时,吸收的能量用U 表示:

[讨论]晶格能大小与什么因素有关? 如何影响?
[设计意图]培养学生利用和分析表格的能力。

?
问题8:如何表示离子键的形成?
[设计意图]理解离子键的含义和化学用语的书写。
请写出下列物质的电子式:
MgCl2、Na2O2、NH4Cl、NaOH
问题9:离子化合物常温常压下大都是晶体,晶体和固体有何不同?晶体为什么有固定的几何外形?什么叫离子晶体? 组成离子晶体的微粒是什么? 离子晶体的微粒间的作用是什么? 离子晶体有哪些性质?
[设计意图]培养学生空间想象、归纳、表达能力。
晶体是有规则的几何外形的固体。 由于内部离子在空间按一定规律做周期性重复排列构成的。 离子晶体是离子间通过离子键结合而成的晶体;组成离子晶体的微粒:阴、阳离子;离子晶体微粒间作用:离子键。 性质:具有较高的熔沸点,硬而脆,不导电,熔融或溶于水后能导电。 晶体还有高度对称性、最小内能、相对稳定等。
问题10:离子晶体形成时阴阳离子排列时遵循什么规律?
[设计意图]理解紧密堆积原理。
阴阳离子尽可能紧密地排列,带相反电荷的离子尽可能相互接触,且一种离子周围紧邻的带相反电荷的离子尽可能多。 这样体系能量低,形成的离子晶体稳定。
问题11:离子晶体有哪些晶体结构类型?观察模型,分析晶体微粒排布规律。
[设计意图] 培养观察、分析、综合能力。
(1)ZnS 型 (2)NaCl 型 (3)CsCl 型 (4)CsF 型
问题12:观察氯化钠型晶体模型,氯化钠型晶体的配位数是多少? 每个晶胞中含有几个钠离子? 几个氯离子?它们所围成的空间几何构型是什么形状? 与一个Cl-相邻最近且距离相等的Cl-有几个?
[设计意图]培养观察分析和空间想象能力。
(1)立方晶系,面心立方晶胞;
(2)Na+和Cl-配位数都是6;
(3)Z=4
(4)Na+,Cl-,离子键。
问题13:观察氯化铯型晶体模型,氯化铯型晶体的配位数是多少? 每个晶胞中含有几个铯离子? 几个氯离子?离每个铯离子最近的铯离子有多少个? 与一个C1-相邻最近且距离相等C1-的有几个?
(1)立方晶系,简单立方晶胞。
(2)Z=1。
(3)Cs+,Cl-,离子键。
(4)配位数8∶8。
问题14: 氯化钠和氯化铯都是AB 型离子化合物,两者的配位数却不同,你认为造成这一差异的可能原因是什么?
氯化钠和氯化铯两者的配位数之所以不同,主要在于离子半径的差异。Cs+半径要大于Na+,因而吸引更多的Cl-。 离子晶体中离子配位数的多少主要取决于阴、阳离子的相对大小。
规律:阳离子、阴离子半径比与配位数的关系

四、教学感悟
1.问题化设计和互动课堂教学更好的落实有效教学新课程理念
问题化设计和互动课堂关注的是新课程的理念能否落实到位,关注课堂教学能否根据新课程要求重新塑造,是追求教学的合理化、智慧化和提高教学水平的重要手段,凡事预则立,不预则废。 课堂教学中有两个问题,一是预设,二是生成。 预设需要教师认真思考、设计和斟酌,问题设置符合学生认识水平。 生成是灵动的,有学生提出的,有教师根据学生疑问提出的,在解决问题中出现认知冲突,实现概念的理解和能力的提高。 师生积极参与、交往互动、共同发展。
2.问题化设计和互动课堂教学更好地激发学生的学习激情
通过问题的讨论,师生的互动使课堂焕发生命的活力,教师、学生的思想和文本及已有的知识经验不断交会碰撞,创造火化。 新的信息、新的需求和学习激情不断涌动产生,通过对问题的讨论、辩论、争论、实验、类比,认识不断提高,体验不断加深,情感不断升华。 在这样的课堂中,学生拥有了创造的机会,获得全面的发展,教师的劳动也就闪耀着智慧的光辉,闪烁着生命本色。
3.问题化设计和互动课堂教学更好的促进教师的专业发展
实施问题化设计和互动课堂教学法,教师必须结合学生的实际合理设计问题,问题要具有一定的难度和明确的考察目标,体现基础性和典型性,是高考的热点和易错点。 问题设计上可以是高考试题的改编和生产实际,为此,教师课前设计必须认真研究新课程,学习新课标,反复揣摩问题如何设置合理。 在互动课堂上,教师要有发现学生共性问题和典型错误的慧眼,共性问题和典型错误产生教师要追本求源,是思维方式、解题方法还是基础知识出现问题等。 每节课都有优点,也肯定存在不足,通过对问题化和互动课堂教学的反思,就能不断提高课堂教学水平,促进教师专业发展。
4.问题化设计和互动课堂教学更好地实现新课程的三维目标
问题化教学把教育理论、教学思想转化为可操作的程度或结构,让课堂教学变成了“师生共振”。 创设问题情境,通过创设的问题情境给学生架起探究的桥梁和引导学生寻求解决问题的正确途径, 使学生在积极思维、消化知识的过程中改组自己的认知结构、培养科学的思维方法和良好的学习态度,新颖有力的问题情境可以激发学生的兴趣, 提高全体学生学习的主动性和积极性,形成教师主导作用和学生主体作用完美结合的课堂气氛,不仅使学生掌握了知识和技能,而且使学生的智力、能力得到全面发展,达到多元化的素质教育目标。 因此,化学课堂教学必须注重问题情境的创设。
[1] 中华人民共和国教育部.普通高中化学课程标准[S].北京:人民教育出版社,2003
[2] 熊新华.论化学学科教学价值[J].中学化学教学参考,2011,(4):6-8
[3] 皮连生主编.学与教的心理学[M].上海:华东师范大学出版社,2003
[4] 王后雄.情感目标理论及其在化学教学中的应用[J].化学教学,2012,(7):5-7
