巨桉无性系Eg5的卡那霉素和头孢霉素敏感性研究
2012-12-28郭利军曾炳山李湘阳裘珍飞
郭利军,曾炳山,刘 英,李湘阳,裘珍飞
巨桉无性系Eg5的卡那霉素和头孢霉素敏感性研究
郭利军,曾炳山,刘 英,李湘阳,裘珍飞
(中国林业科学研究院热带林业研究所 广东广州 510520)
以巨桉无性系Eg5叶片为外植体材料,试验了硫酸卡那霉素(kanamycin sulfate,Km)对外植体愈伤组织诱导增殖、芽分化、芽生根的影响,并且试验了头孢霉素(Cefotaxime,Cef)对外植体再生的影响及其对根癌农杆菌GV3101的抑制效果。结果表明:抑制愈伤组织增殖培养的卡那霉素浓度为17.5 mg/L,完全抑制芽分化的卡那霉素浓度为60 mg/L,完全抑制生根的卡那霉素浓度为400 mg/L;Cef在0~500mg/L范围内,0~300 mg/L Cef对外植体的生长分化影响最小;共培养结束后的外植体经过500 mg/L的Cef处理后,共培养基中添加100 mg/L的Cef便可以完全抑制农杆菌GV3101的生长。
桉树;Eg5;抗生素;根癌农杆菌;敏感性
Eg5是优良的巨桉Euclyptus grandis W.Hill ex Maiden无性系,具有速生、干形通直、分枝角度小、出材率高等特点,在我国江西南部、湖南南部、福建中部等南亚热带地区已广泛栽培,但巨桉Eg5也存在青枯病抗性较低、冰冻抗性较低等问题[1-2]。通过根癌农杆菌介导的遗传转化可以将抗病、抗寒等目的基因转入巨桉基因组中,改良上述不良性状,这是一种非常有潜力的基因工程育种办法。农杆菌进行遗传转化过程中,为了能够筛选出转化细胞,通常会在转化过程中加入一定浓度的卡那霉素等氨基糖苷类抗生素抑制非转化细胞的生长。外植体共培养结束后,为了清除农杆菌,会在培养基中加入适量的头孢霉素或羧苄青霉素等抗生素来抑制农杆菌的生长[3-4]。为了开展Eg5的转基因研究奠定基础,以Eg5组培苗的叶片为外植体材料,研究了硫酸卡那霉素对愈伤组织增殖、芽分化和生根的影响以及头孢霉素对农杆菌GV3101的抑制效果和对再生的影响,现报道如下。
1 材料与方法
1.1 试验材料
以生根培养45 d左右的Eg5无菌生根苗为试验材料,选取顶端完全展开的1~4片带叶柄的叶片为外植体,剪去占全叶1/3长度的叶尖部分。卡那霉素(Km)和头孢霉素(Cef)均购自鼎国生物技术有限公司。
1.2 基本培养基及培养条件
愈伤组织再生培养基为改良MS+TDZ 0.12 mg/L+NAA 0.25 mg/L+蔗糖 30 g/L+琼脂6 g/L,pH 5.6;芽伸长培养基为改良MS+6-BA 0.3 mg/L+IBA 0.05 mg/L+IAA 0.3 mg/L+蔗糖30 g/L +卡拉胶 7 g/L,pH 5.6;生根培养基为改良MS+NAA 0.4 mg/L+IBA 0.8 mg/L+蔗糖30 g/L+卡拉胶7 g/L+活性炭0.1 g/L,pH 5.6;培养基在0.11 MPa高压下,121 ℃灭菌17 min,冷却至50 ℃后加入相应的抗生素。培养温度为(25±2) ℃,先进行10 d的暗培养处理,然后在1 500 lx光照强度下培养。
1.3 试验方法
1.3.1 卡那霉素对愈伤组织诱导增殖的影响试验
将切好的叶片接种在含Km质量浓度为0、5、10、15、17.5 mg/L的再生培养基中进行愈伤诱导及增殖试验,所有Km处理的培养基均添加了100 mg/L的Cef,对照培养基则不添Km和Cef,培养4周后称量愈伤的重量。每个处理5瓶,每瓶6个外植体,重复3次。
1.3.2 卡那霉素对愈伤组织芽分化的影响试验
将切好的叶片接种到不含任何抗生素的再生培养基上,两2周继代一次,培养4周后将愈伤组织接种到含Km质量浓度为20、30、40、50、60、80、100 mg/L的再生培养基中,2周后统计再生外植体的个数;以不加Km培养基为对照,每个处理5瓶,每瓶5个外植体,重复3次。
1.3.3 卡那霉素对芽生根的影响试验
切取长度约2 cm的芽,接种在含Km质量浓度为100、200、300、400 mg/L的生根培养基中,4周后统计生根株数。以不加Km培养基为对照,每个处理15株,重复15次。
1.3.4 头孢霉素对叶片再生的影响试验
将切好的叶片接种在含Cef质量浓度为100、200、300、400、500 mg/L的再生培养基上,两周继代培养1次,培养约4周,待愈伤组织冒出绿色点状芽,即转入含有与上述Cef浓度相同的芽伸长培养基中,2周后统计再生率、每外植体上最大芽长和高于1 mm芽的数量。以不加Cef培养基为对照,每个处理5瓶,每瓶6个外植体,重复3次。
1.3.5 头孢霉素抑菌效果试验
取-75℃冻存的根癌农杆菌菌株GV3101,在冰上解冻后划平板活化培养3 d。挑取单菌落于4 mL液体LB培养基中180 r/min过夜培养,当菌液OD600值达到0.2后,按照1∶40比例接入新鲜LB液体培养基,培养至OD600=0.5,4 000 r/min离心8 min,用等量的液体再生培养基重悬菌体,再将切好的叶片放入侵染液中,置于85 r/min的摇床上侵染1 h;共培养1 d后取出共培养的外植体,放入含有500 mg/L Cef的液体再生培养基中[5-7],轻轻摇动2小时,用无菌水漂洗3次转接到含有Cef浓度为100、200、300、400、500 mg/L的再生培养基上,培养4周,每日观察有无农杆菌长出,以不加Cef为对照,每个处理10瓶,每瓶6个外植体。
1.4 统计分析
所有百分数经平方根反正弦化ASIN(SQRT(X))、个数经平方根转化SQRT(X),采用SPSS分析软件进行方差分析(ANOVA)和Duncan多重比较(P=0.05)。文中数据为未转化数据均值。
2 结果与分析
2.1 硫酸卡那霉素对愈伤组织诱导增殖的影响
Km可对正常植物细胞中70 s核糖体功能产生抑制,使叶绿体不能正常发育,导致植物产生白化现象,能有效抑制正常植物细胞的分化[8]。通过分析添加Km对愈伤组织重量大小的影响,了获得愈伤组织增殖培养阶段Km的适宜质量浓度。从表1可以看出,随着Km质量浓度的提高,Km抑制愈伤组织增殖生长越明显。通过多重比较分析,各处理间Km质量浓度17.5与0、5、10、15 mg/L存在显著差异,而Km质量浓度为0、5、10、15 mg/L各处理间没有显著差异,说明Km质量浓度为17.5 mg/L是抑制细胞愈伤组织增殖培养的临界质量浓度。
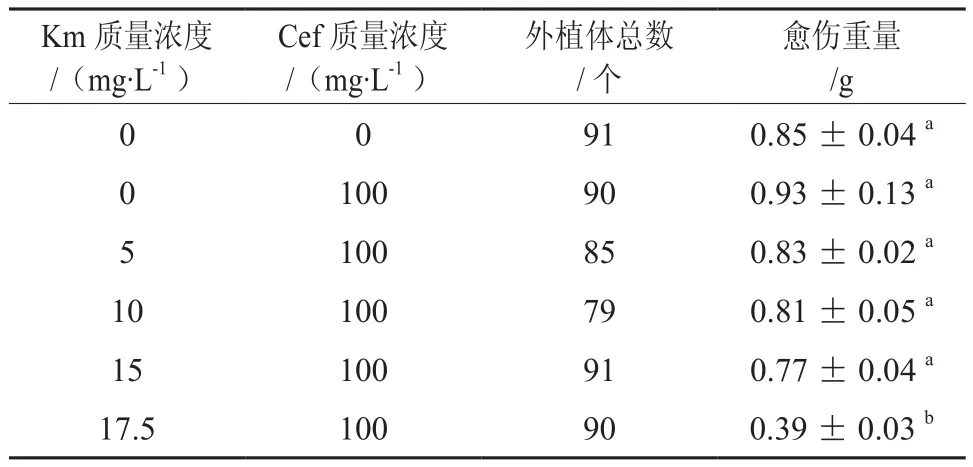
表1 卡那霉素对巨桉Eg5愈伤组织诱导增殖的影响†Table 1 Effect of Kanamycin on callus induction and proliferation of E.grandis clone Eg5
2.2 硫酸卡那霉素对愈伤组织芽分化的影响
与愈伤组织芽分化阶段相比,增殖阶段的Km抗性有所增强,因此需要添加的浓度明显提高。随着Km浓度的提高再生率呈现逐渐降低的趋势(表2),当Km浓度在20~40 mg/L之间时,再生率范围为11.11%~16.67%,芽有轻微失绿现象,当Km提高至50 mg/L时再生率下降至9.16%,且再生芽不能伸长,叶片白化现象明显;当Km质量浓度大于60 mg/L时再生率下降为0,由于较高的Km浓度可能会造成转化芽的无法继续生长,所以愈伤组织芽分化阶段转化芽适宜的Km筛选浓度应为60 mg/L。

表2 卡那霉素对巨桉Eg5愈伤组织芽分化的影响†Table 2 Effect of Kanamycin on bud differentiation of E.grandis clone Eg5
2.3 硫酸卡那霉素对芽生根的影响
生根阶段芽的Km抗性大大增强,笔者在预实验中发现250 mg/L的Km根本不足以完全抑制生根。由表3可以看出,随着Km的增加,生根率及高于2.5 cm苗的百分率均逐渐降低至0。Km达到200 mg/L时,与对照及Km100 mg/L相比再生率及高于2.5 cm苗百分率均显著下降,分别仅有18.64%和7.60%,Km达到300 mg/L时,生根率急剧降至1.33%,高于2.5 cm苗百分率也降至1.78%,Km达到400 mg/L时已经完全抑制了芽的生根,未见高于2.5 cm的苗;Km达到200 mg/L时,与对照及Km100 mg/L相比生根苗叶片变小,株型细小,黄化严重;Km达到300 mg/L时,单株生长缓慢,白化植株比例变大,植株生长极其缓慢,但仍存在少量单株生长状况较好;Km达到400 mg/L时,单株叶片萎蔫,大部分植株褐化,未见生长。所以,生根阶段适宜筛选的Km的质量浓度为400 mg/L。

表3 卡那霉素对巨桉Eg5芽生根的影响†Table 3 Effect of Kanamycin on shoot rooting of E.grandis clone Eg5
2.4 头孢霉素对叶片再生的影响
抗生素的添加应能抑制农杆菌的生长,但又尽可能不对愈伤组织的正常生长和分化产生显著影响。为了防止农杆菌的过度生长影响外植体的愈伤生长及分化,本实验采用Cef抑制农杆菌生长,但过高的Cef浓度会影响外植体的生长和分化[3-4],因此研究不同浓度的Cef浓度对再生的影响对于提高遗传转化效率具有重要的意义。
从表4中可以看出,Cef浓度在0~500 mg/L以内,对再生率影响较小,再生率范围在73.07%~84.44%之间,100 mg/L的Cef还提高了再生率,达到84.44%,但芽的高生长却受到了抑制,每个外植体分化芽的数量也减少;当Cef浓度达到200~300 mg/L时,高于1 mm芽数又明显低于100 mg/L,Cef浓度达到400~500 mg/L时,高于1 mm芽数达到最少;Cef浓度为0~300 mg/L时最大芽高无显著差异,单芽高维持在0.39~0.70 cm之间,达到400 mg/L时最大芽高开始明显低于对照,下降至0.23 cm,Cef达到500 mg/L时最大芽高下降至最低。综上所述,0~300 mg/L Cef对外植体的生长分化影响最小。
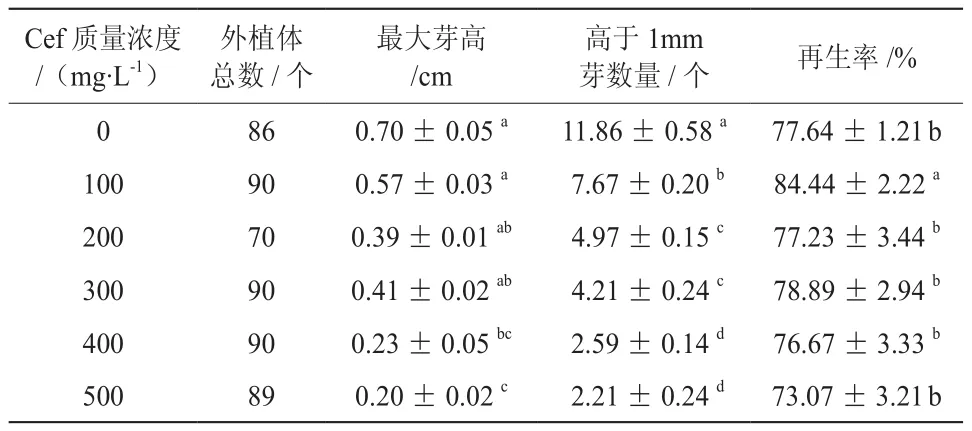
表4 头孢霉素对巨桉Eg5叶片再生的影响†Table 4 Effect of Cefotaxime on bud regeneration from leaves of E.grandis clone Eg5
2.5 头孢霉素的抑菌效果
Cef属于β-半乳糖苷酶抑制型抗生素,可以抑制肽聚糖链的交联,从而干扰农杆菌细胞壁的形成,阻止其生长[9]。本研究采用培养基中加入Cef方式进行抑菌实验,以确定合适的使用浓度。
由表5可知,低浓度的Cef就可以很好的抑制农杆菌的生长,当Cef浓度≥100 mg/L时已经完全抑制了农杆菌的生长,所以对于根癌农杆菌GV3101介导的巨桉EG5遗传转化适宜的头孢霉素抑菌Cef浓度为100 mg/L。
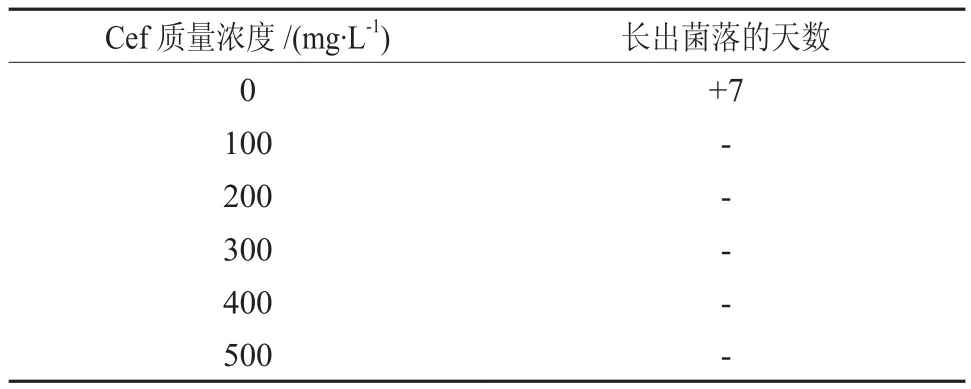
表5 头孢霉素对根癌农杆菌介导巨桉Eg5叶片转化的抑菌效果†Table 5 Inhibition effects of Cefotaxime on Agrobacterium tumefaciens-mediated transformation on leaves of E.grandis clone Eg5
3 结论与讨论
卡那霉素作为一种氨基糖苷类抗生素,可抑制植物叶绿体蛋白质的合成,被广泛用于转化细胞的筛选工作。在黑胡桃木、李子、白杨、赤桉、尾巨桉、蓝桉等许多树种中已经发现卡那霉素可以显著抑制外植体的形态发生[10-17]。本研究也表明Eg5叶片愈伤组织生长、芽再生及生根能力均随着卡那霉素浓度的增加而逐渐下降,白化现象逐渐加重;研究中发现卡那霉素在Eg5叶片转化芽筛选阶段浓度达到了60 mg/L,高出巨桉Eg8和C101茎段[18]筛选浓度一倍,也明显高于赤桉子叶及下胚轴筛选浓度的40 mg/L和9 mg/L[13-14],及尾巨桉茎段和下胚轴遗传转化研究中75 mg/L和40 mg/L[15-16]的浓度值,造成此现象的原因可能是不同桉树树种不同外植体对卡那霉素的本底抗性各不相同,以上也说明巨桉Eg5叶片与其它桉树树种外植体相比有着较高的卡那霉素本底抗性。
席梦利在做杉木茎段转基因研究中发现转化芽筛选阶段卡那霉素浓度达到了40 mg/L,生根阶段卡那霉素筛选浓度降低为8 mg/L[19];尾叶桉的转化研究表明40 mg/L的卡那霉素明显抑制了叶盘的分化,20 mg/L的卡那霉素则完全抑制了再生植株的生根[20],尾巨桉、粗枝木麻黄、银白杨等[21-23]生根筛选浓度从40 mg/L到100 mg/L不等,巨桉Eg5生根阶段卡那霉素抗性显著增强,卡那霉素浓度达到400 mg/L时才能完全抑制生根,与上述生根筛选浓度相比高出了3~49倍,可能有以下原因:(1)由树种本身的特性所决定,巨桉Eg5具有较高的卡那霉素本底抗性;(2)生根培养基中由于添加了活性炭,对卡那霉素有较强的吸附作用;(3)培养基中由于有促进生根的NAA及生根粉等物质,可能很大程度上抵消了卡那霉素对生根的抑制作用。造成巨桉生根阶段卡那霉素筛选浓度较高的原因尚无法确定,上述哪一方面或是几个方面共同起了作用还有待进一步的研究。
头孢霉素是农杆菌介导的遗传转化实验中常用的抑菌抗生素,许多研究表明头孢霉素对外植体的分化有毒害作用[24-26],但也有相关研究表明适量的头孢霉素对外植体的分化存在促进作用。Lin J.J.等[27]曾报道羧苄青霉素和头孢霉素等与生长素2,4-D、NAA等有相似的化学结构,适当浓度的该类抗生素能促进愈伤组织的分化与生长,小麦的抗生素研究[3]也发现100 mg/L的头孢霉素可以改善愈伤的生长、形态发生及器官发生且明显提高了再生率,Yepes L.M[28]做了7个苹果品种的抗生素实验,发现250 mg/L的头孢霉素显著提高了再生率。本研究也表明,100 mg/L头孢霉素可以提高叶片的再生率,这与James D.J.等[29]和Maheswaran G.等[30]所提出的低浓度的头孢霉素对外植体的再生有促进作用的结论相一致。当头孢霉素达到500 mg/L时,本研究发现巨桉的再生率下降不明显,Yepes L.M[28]发现苹果再生率却下降了40%~70%,其原因可能是苹果的头孢霉素适应范围较小,而巨桉适应范围较大所致。
头孢霉素的抑菌效果与农杆菌菌株的类型有关[7],研究表明,共培养结束后的外植体经过500 mg/L的头孢霉素处理后,共培养基中添加100 mg/L的头孢霉素便可以完全抑制农杆菌GV3101的生长,头孢霉素对C58C1、LBA4404、EHA105等其它菌株的抑菌效果及头孢霉素最佳的抑菌浓度还有待于进一步研究。
本研究表明,巨桉Eg5叶片外植体在不同生长分化阶段对卡那霉素的抗性也是不同的,建议研究人员在以后的农杆菌转化研究中,根据树种、外植体类型及其生长阶段的不同研究相应的卡那霉素浓度筛选转化细胞。
[1] 曹季丹,沈文生,潘月芳.蝴蝶果青枯病研究初报[J].广西林业科学 ,1980,(1):36-37.
[2] 林 平.永安桉树造林及其冻害情况调查[J].桉树科技,2001,(1):l5-20.
[3] Mathias R J, Boyd L A.Ceftaxime stimulates callus growth,embryogenesis and regeneration in hexaploid bread wheat(Triticum aestivum L)[J].Plant Science,1986, 46(3):217-223.
[4] Nauerby B, Billing K, Wyndaele R, et al.Influence of the antibiotic timentin on plant regeneration compared to carbenicilln and cefotaxime in concentrations suitable for elimination of Agrobacterium tumfaciens[J].Plant Science,1997,123:169-177.
[5] Khan M, Robin A, Nazim-Ud-Dowla M, et al.Agrobacterium mediated genetic transformation of two varieties of Brassica:optimization of protocol[J].Bangladesh Journal of Agril.Res.,2009, 34(2):287-301.
[6] Spokevicius A V, Beveren K V, Leitch M A, et al.Agrobacterium mediated in vitro transformation of wood-producing stem segments in eucalypts[J].Plant Cell Reports,2005, 23:617-624.
[7] 王关林,方宏筠.植物基因工程[M].北京:科学出版社,2002:1-886.
[8] 曲冠证.小黑杨单倍体耐盐基因(Bet-A)遗传转化的研究[D].哈尔滨:东北林业大学,2002:24-25.
[9] 姜清彬.细枝木麻黄再生体系及农杆菌介导遗传转化研究[D].北京:中国林业科学研究院,2011:51-52.
[10] Michael J B, Gurpreet S S, Charles H M.Genetic transformation of Black Walnut (Juglans nigra)[J].Gen.Tech.Rep., 2004,243:45-58.
[11] Gonzalez-Padilla I M, Webb K, Scorza R.Early antibiotic selection and efficient rooting and acclimatization improve the production of transgenic plum plants(Prunus domestica L.)[J].Plant Cell Reports,2003, 22:38-45.
[12] Confalonieri M, Belenghi B, Balestrazzi A, et al.Transformation of elite white poplar (Populus alba L.cv.“Vilafranca”)and evaluation of herbicide resistance[J].Plant Cell Reports,2000,19:978-982.
[13] Quisen R, Oliveira Y D, Pileggi M, et al.Selective agent and A.tumefaciens overgrowth-control antibiotics in Eucalyptus camaldulensis Cotiledonary culture[J].Brazilian Archives of Biology and Technology, 2009, 52:1485-1492.
[14] Ho C K, Chang S H, Tsay J Y.et al.Agrobacterium tumefaciens mediated Transformation of Eucalyptus camaldulensis and production of transgenic plants[J].Plant Cell Reports,1998,17:675-680.
[15] 赖家业, 石海明, 刘 凯, 等.尾巨桉遗传转化系统建立的研究[J].四川大学学报,2007, (2):415-419.
[16] Chen Z, Tsay J, Chung J.Callus culture of Eucalyptus grandis×urophylla and preliminary studies on organogenesis and Agrobacterium mediated transformation[J].Taiwan Journal of Forest Science,1996, 11(1):43-52.
[17] Moralejo M, Rochange F, Boudet A M, et al.Generation of transgenic Eucalyptus globulus plantlets through Agrobacterium tumefaciens mediated transformation[J].Australian Journal of Plant Physiology,1998, 25(2):207-212.
[18] Yao J L, Wang K L.Eucalyptus transformation method[P].US2005/0086714A1, April.21,2005.
[19] 席梦利.杉木转基因受体系统的建立及遗传转化研究[D].南京:南京林业大学,2004:68-70.
[20] 孔 华, 郭安平, 郭运玲,等.尾叶桉U6遗传转化再生体系的建立[J].热带作物学报,2008,29(4):424-429.
[21] Tournier V, Grat S, Marque C, et al.An efficient procedure to stably introduce genes into an economically important pulp tree(Eucalyptus grandis×Eucalyptus urophylla)[J].Transgenic Research,2003, 12:403-411.
[22] Lea Q V, Bogusza D, Gherbia H, et al.Agrobacterium tumefaciens gene transfer to Casuarina glauca, a tropical nitrogen-fixing tree[J].Plant Science,1996, 118(1):57-69.
[23] 李 慧, 陈晓阳, 李 云,等.银白杨遗传转化中抗生素浓度优化的研究[J].北京林业大学学报, 2005, 27(5):118-121.
[24] Hanhineva K J, Karenlampi S O.Production of transgenic strawberries by temporary immersion bioreactor system and verification by TAIL-PCR[J].BMC Biotechnology,2007, 7(11):1-12.
[25] 张海平.棉花转基因体系的优化和抗黄萎病基因的转化[D].杭州:浙江大学,2008:73-74.
[26] 范春节.尾赤桉再生体系及农杆菌介导的转基因体系研究[D].北京:中国林业科学研究院.2008, 48-51.
[27] Lin J J, Assad-Garcia N, Kuo J.Plant hormone effect of antibiotics on the transformation efficiency of plant tissues by Agrobacterium tumefaciens cells[J].Plant Science, 1995,109:171-l77.
[28] Yepes L M, Aldwinckle H S.Factors that affect leaf regeneration efficiency in apple and effect of antibiotics in morphogenesis[J].Plant Cell Tissue and Organ culture,1994,37:257-269.
[29] James D J, Passey A J, Barbara D J.Agrobacterium mediated transformation of apple and strawberry using disarmed Ti-binary vectors[J].Acta Horticulturae,1989, 280:495-502.
[30] Maheswaran G, Welander M, Hutchinson J F, et al.Transformation of apple rootstock M26 with Agrobacterium tumefaciens[J].Journal of Plant Physiology,1991, 139(5):560-568.
Study on kanamycin and cefotaxime sensitivity of Eucalyptus grandis clone Eg5
GUO Li-jun, ZENG Bing-shan, LIU Ying, LI Xiang-yang, QIU Zhen-fei
(Research Institute of Tropical Forestry, Chinese Academy of Forestry,Guagnzhou 510520,Huangdong, China)
By taking Eucalyptus grandis colne Eg5 leaves as explants, the effects of Kanamycin sulfate on the callus proliferation, bud differentiation and shoot rooting of leaf explants of Eucalyptus grandis clone Eg5 and the effect of Cefotaxime on explant’s regeneration and the growth of Agrobacterium tumefaciens GV3101 were studied.The results showed that the concentration of kanamycin for restraining callus proliferation was 17.5 mg/L, that for fully suppressing bud differentiation was 60 mg/L and that for inhibiting shoots rooting was 400 mg/L.Cefotaxime at a dosage from 0 mg/L to 300 mg/L had minimal impact on the differentiation of leaf explants.With a soak of the explants in the solution of 500 mg/L Cefotaxime, the growth of agrobacterium can be fully inhibited at a Cefotaxime dosage of 100 mg/L in medium.
Eucalyptus; Eg5; antibiotic; Agrobacterium tumefaciens; sensitivity
S792.39;Q943.2
A
1673-923X(2012)03-0075-06
2011-12-19
863高新技术项目(2011AA100202)
郭利军(1983—),男,河北蠡县人,硕士研究生,主要从事热带林木组培快繁和基因转化研究
曾炳山(1969—),男,江西井冈山人,研究员,博士,从事热带林木组培快繁和基因转化研究
[本文编校:吴 毅]
