量子点-Cu2+对L02细胞的联合毒性及NAC的防护作用
2012-12-26赵宇侠林匡飞刘莉莉淮海工学院化工学院环境工程系江苏连云港005华东理工大学资源与环境工程学院国家环境保护化工过程环境风险评价与控制重点实验室上海0037
赵宇侠,林匡飞,张 卫,刘莉莉 (.淮海工学院化工学院环境工程系,江苏 连云港 005;.华东理工大学资源与环境工程学院,国家环境保护化工过程环境风险评价与控制重点实验室,上海 0037)
量子点-Cu2+对L02细胞的联合毒性及NAC的防护作用
赵宇侠1,林匡飞2*,张 卫2,刘莉莉2(1.淮海工学院化工学院环境工程系,江苏 连云港 222005;2.华东理工大学资源与环境工程学院,国家环境保护化工过程环境风险评价与控制重点实验室,上海 200237)
以人胚肝细胞(L02)为研究对象,通过研究量子点及Cu2+(低毒浓度)联合对细胞存活率的影响以及细胞形态的变化确认细胞的毒性,结合抗氧化剂NAC的防护效果探讨复合毒性的氧化损伤机理.结果表明,无论单独Cu2+还是量子点-Cu2+处理组,L02细胞的增殖能力均受到抑制,量子点-Cu2+处理组表现出更加显著的抑制效果,相对与单独Cu2+处理组细胞存活率最大下降300%.经过NAC预处理的细胞在形态和存活率上都显著恢复.说明了安全浓度范围的量子点的与Cu2+共存提高了细胞毒性风险,NAC能够防护量子点与Cu2+单独或联合引起的氧化损伤.
CdTe-MPA量子点;Cu2+;L02细胞;MTT;联合毒性
量子点(QDs)是近年发展起来的一种新型荧光纳米颗粒,也称半导体纳米微晶体,是一种由Ⅱ~Ⅵ族或Ⅲ~Ⅴ族元素组成的纳米颗粒.由于其粒径很小(约 2~10nm),电子和空穴被量子限域,连续能带变成具有分子特性的分立能级结构,与传统的有机荧光染料相比,量子点的具有激发光谱宽,发射光谱窄而对称,颜色可调,光化学稳定性高,不易光解等独特的光学性质.目前,量子点最具前景的应用是在生物和医学领域中作为荧光标记物[1-5],它不仅可以在体外用于细胞骨架的标记,还可以用于生物体内的荧光成像[6-7].量子点越来越广泛应用使得其生物安全性的研究引起人们的广泛关注.关于量子点的毒性机制研究主要集中在量子点高活性表面以及核心 Cd2+的释放所产生的活性氧自由基介导的氧化应激等方面[5-11].
重金属铜存在于各种岩石和矿物中,是生物体自身所必需的元素.铜元素可以以3种氧化态互相转化Cu0、Cu+、Cu2+,铜存在于30多种酶中作为氧化还原催化剂或氧载体,能够通过 Fenton反应在过氧化氢存在的条件下催化羟基自由基的生成[12-13].羟基自由基是毒性很强的自由基,能够通过与脂类,氨基酸,和巯基,RNA,DNA等反应导致细胞损坏甚至死亡[12].
量子点和铜不仅都会通过 ROS产生毒性,并且在生物体内往往都在肝中蓄积[14-15],通常对于铜污染采用的有效的3种主要方法包括络合、沉淀和吸附[16].天然水中,OH-与铜络合形成铜的水解产物 Cu(OH)+、Cu(OH)20、Cu2(OH)22+[16];这就使得量子点的加入对原有铜的毒性存在 2种可能,一是基于共同机制的 ROS损伤,另外可能由于量子点对铜可能的吸附和表面羟基的络和降低其毒性.这种复合毒性无论对环境还是对体内蓄积的共存都存在影响,乙酰半胱氨酸NAC作为著名的抗氧化剂可以通过屏蔽掉相关的氧化损伤减少细胞毒性[17],进而从反面证明细胞的毒性机理.
基于以上考虑,本研究就量子点和Cu2+的联合毒性进行实验,考察量子点的加入对铜离子的毒性的影响,验证上述假设.同时通过抗氧化剂NAC验证是否ROS增加是毒性的主导因素,以期为其可能的体内和环境风险提供参考.
1 材料与方法
1.1 试验材料
实验所用的人胚肝细胞(L02)购自中国科学院细胞库,量子点 CdTe-MPA(巯基丙酸)由华东理工大学化工学院合成,包覆MPA.直径为3.7nm发红光,在水相中合成的发射波长为628nm,摩尔浓度为5.8×10-6mol/L,质量浓度为0.64mg/mL在pH值6~12范围内稳定,合成方法参见参考文献[2].量子点合成后用收集离心用丙醇纯化以去除杂质.RPMI-1640培养基和胎牛血清购自美国Gibco公司.除了特别指出,其他所用的试剂包括无水氯化铜,乙酰半胱氨酸 NAC(N-ace tylcystein),四甲基偶氮唑盐(MTT),2',7'-二氯荧光黄双乙酸盐(DCFH-DA)都购自Sigma试剂公司(St. Louis, MO, USA).
1.2 量子点和Cu2+处理及NAC保护实验
[8]的方法,实验用的 L02细胞用RPMI-1640培养基(GIBCO BRL, Grand Island, NY, USA)加入 10%的胎牛血清 (FBS) (GIBCO BRL, Grand Island, NY, USA)在37℃湿度是95%和5%的CO2条件下培养.细胞在96孔板上以(细胞数) 104个/mL的初始浓度培养,用于分析细胞内Cu2+浓度的实验使用的是12孔板和细胞初始浓度是104个/mL.细胞处理前1 h,含有血清的培养基吸出,细胞PBS缓冲液洗2遍后替换上新鲜的无血清培养基[17].
细胞用不同浓度的单独的或联合的量子点(2~20µg/mL)与Cu2+(2~320µg/mL)处理,培养24h后用于各项分析.NAC的保护作用实验选择10µmol/L的NAC提前2h时加入培养基,然后替换为新鲜的含污染物的培养基处理24h后,再通过测定细胞存活率和观察细胞形态等来考察NAC的防护效果从而推测其损伤机理.QDs从10mg/mL的无血清的培养基配制的母液稀释得到,CuCl2从无菌的超纯水配置的30mg/mL的母液稀释得到.
1.3 MTT法测定细胞存活率
活细胞线粒体可还原MTT为紫色的甲瓒结晶,在一定范围内紫色深浅与活细胞浓度呈线性关系,通过测定甲瓒 570nm波长处的吸光值可反映活细胞活力的变化.取对数生长期细胞接种于 96孔培养板(1×104个/mL),培养 24h使细胞贴壁,弃培养液,每孔加入含量子点或Cu2+的培养基稀释的浓度分别为 0,2.5,5,10,20, 40,80,160μg/mL的Cu2+,和0,2.5,5,10,20,40,80, 160μg/mL的量子点溶液,每个剂量组设定3个复孔.染毒 24h后弃去每孔中的培养液,加入含10% MTT(5mg/mL)的RPMI-1640培养基(不含胎牛血清),继续培养4h后,弃去MTT溶液,每孔加入DMSO 150μL后,于37℃振荡至紫色的甲瓒结晶完全溶解后用酶标仪测定各孔在570nm波长处的吸光度值.确定量子点和 Cu2+对L02细胞的半致死浓度[8,17].
对于联合毒性实验方法如上,量子点选择了2μg/mL(24h细胞致死率 10%)和 2.5,5,10, 20μg/mL浓度的Cu2+,进行了Cu2+单独处理和量子点-Cu2+联合处理的细胞存活率实验.同样在无血清的培养基中处理 24h后替换 MTT在570nm波长处测定了吸光度值.确定量子点的存在对Cu2+细胞存活率的影响.
1.4 细胞形态学观察
将待测试细胞接种于 6孔板(内置盖玻片),培养 24h,待细胞贴壁后,分别加入各种浓度受试物,处理 24h,将盖玻片取出,用细胞固定液(甲醇∶冰醋酸=3∶1)固定 5min,蒸馏水稍洗后加HE (苏木精-伊红)染色 10min,洗片后风干,倒置显微镜(IMT-2, Olympus, Tokyo)下观察细胞形态学变化[8].
1.5 统计分析
数据以均数±标准差(x±s)表示,应用 Origin 7.5软件对数据进行单因素方差分析和T-test检验,*表示以P<0.05置信度下的差异有显著性,代表 QDs-Cu2+联合处理样品对单独 Cu2+处理的差异显著.
2 结果与分析
2.1 量子点与Cu2+对L02细胞毒性的LC50值
由图 1可知,不同浓度的量子点和 Cu2+处理 24h后,随着染毒剂量的增大,细胞增殖能力明显下降,呈剂量-效应关系.量子点对L02细胞的半致死浓度 LC50为 20μg/mL,LC10值约为2μg/mL. Cu2+对 L02细胞的半致死浓度约为31.3μg/mL.
2.2 量子点的加入对Cu2+细胞毒性的影响
为了调查低毒的量子点对原有的污染物Cu2+的影响, Cu2+选择在LC50范围内选择4个浓度 2.5,5,10,20μg/mL,量子点选择 LC10(2μg/mL)进行联合毒性试验.比较量子点与 Cu2+联合组与单独Cu2+处理组的细胞增殖情况(表1).结果表明, LC10浓度量子点的加入能显著提高Cu2+的毒性.除了2.5μg/mL浓度外,选定的其他浓度Cu2+的半致死浓度都被提高到LC50浓度以上,最高增加了3倍.
2.3 NAC的防护作用
由于量子点和 Cu2+的毒性机理都与氧化损伤有关,为了验证2种污染物质是否通过相同的路径诱导产生细胞毒性,考察了 NAC对单独和联合损伤的防护效果.NAC作为有效的抗氧化剂已经被证明能够有效的防护重金属或者纳米材料诱导的氧化损伤[17-18].如果 2种污染物质通过共通的氧化应激路径来实现对L02细胞的损伤,预期NAC能够进行有效的防护.
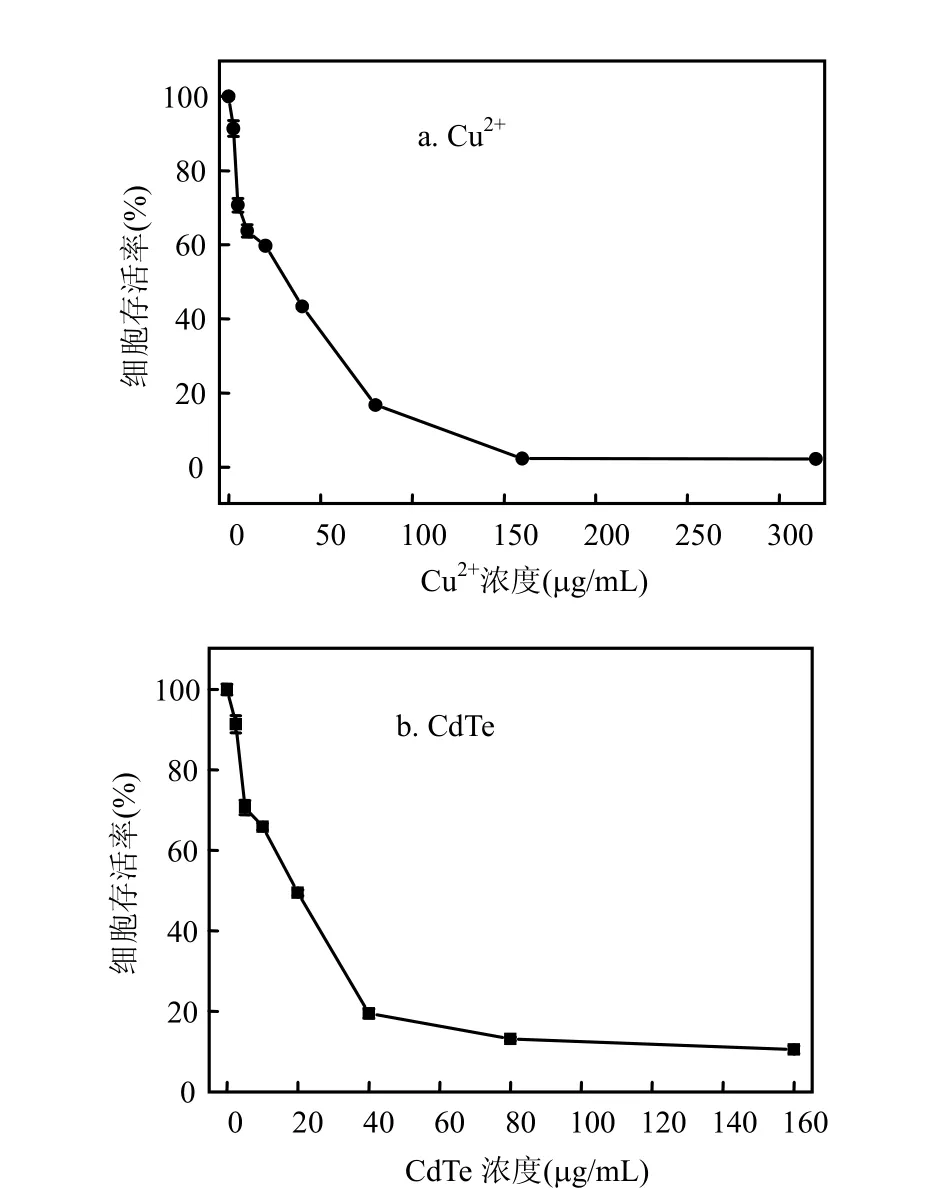
图1 量子点和Cu2+ 对L02细胞存活率的影响Fig.1 Effect of QDs and Cu2+ on L02 cells viability
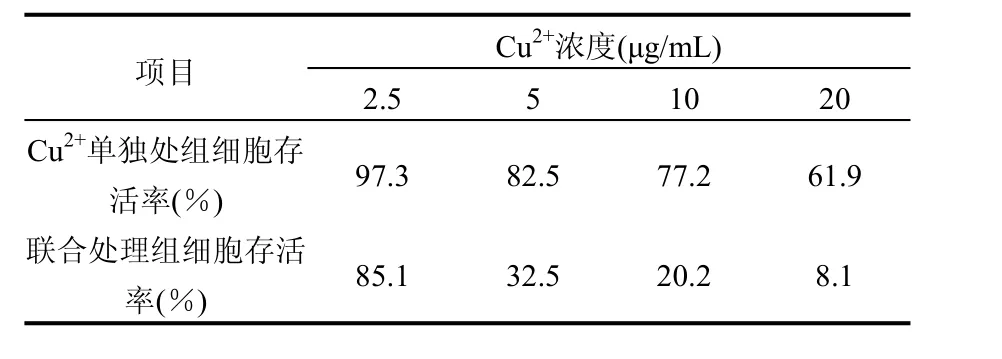
表1 量子点对Cu2+诱导的细胞毒性的影响Table 1 Effect of QDs on Cu2+ induced cell viability decrease
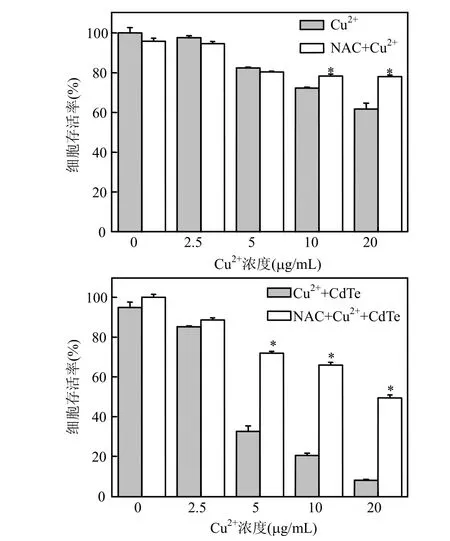
图2 NAC对Cu2+和QDs-Cu2+诱导的细胞毒性的影响Fig.2 Effect of NAC on Cu2+and QDs-Cu2+ induced cell viability loss
如果两者通过其他的损伤路径造成对细胞的伤害,那么 NAC至少不能够实现全面防护.选择10μmol/L的NAC提前2h加入培养基,然后替换为新鲜的含污染物的培养基处理24h后,再测定细胞存活率.根据MTT结果考察NAC的防护效果从而推测其损伤机理[8].
结果表明,NAC几乎能够有效的恢复Cu2+单独处理组或者量子点与 Cu2+联合处理组的细胞存活率损失.在调查浓度范围内,NAC显著地提高了污染物带来的L02细胞的增殖能力的下降,结合前面的研究证明的量子点的加入显著提高了Cu2+诱导的L02细胞ROS的产生水平(最高提高400%)[19],说明量子点与原有的污染物Cu2+的主要损伤路径是通过氧化胁迫来实现的.
2.4 细胞形态学观察
通过 HE染色观察各处理组的细胞形态变化(图3),基本和MTT结果一致.相对与Cu2+处理组来说,量子点的加入使细胞呈现了更加明显的伤害.在镜下观察可见活细胞数明显减少,细胞间质消失,细胞体积缩小,细胞核浓缩、靠边、深染等各种不同程度的异常变化.NAC处理后的细胞则无论在数量还是在形态都得到了显著的回复,细胞形态正常化.
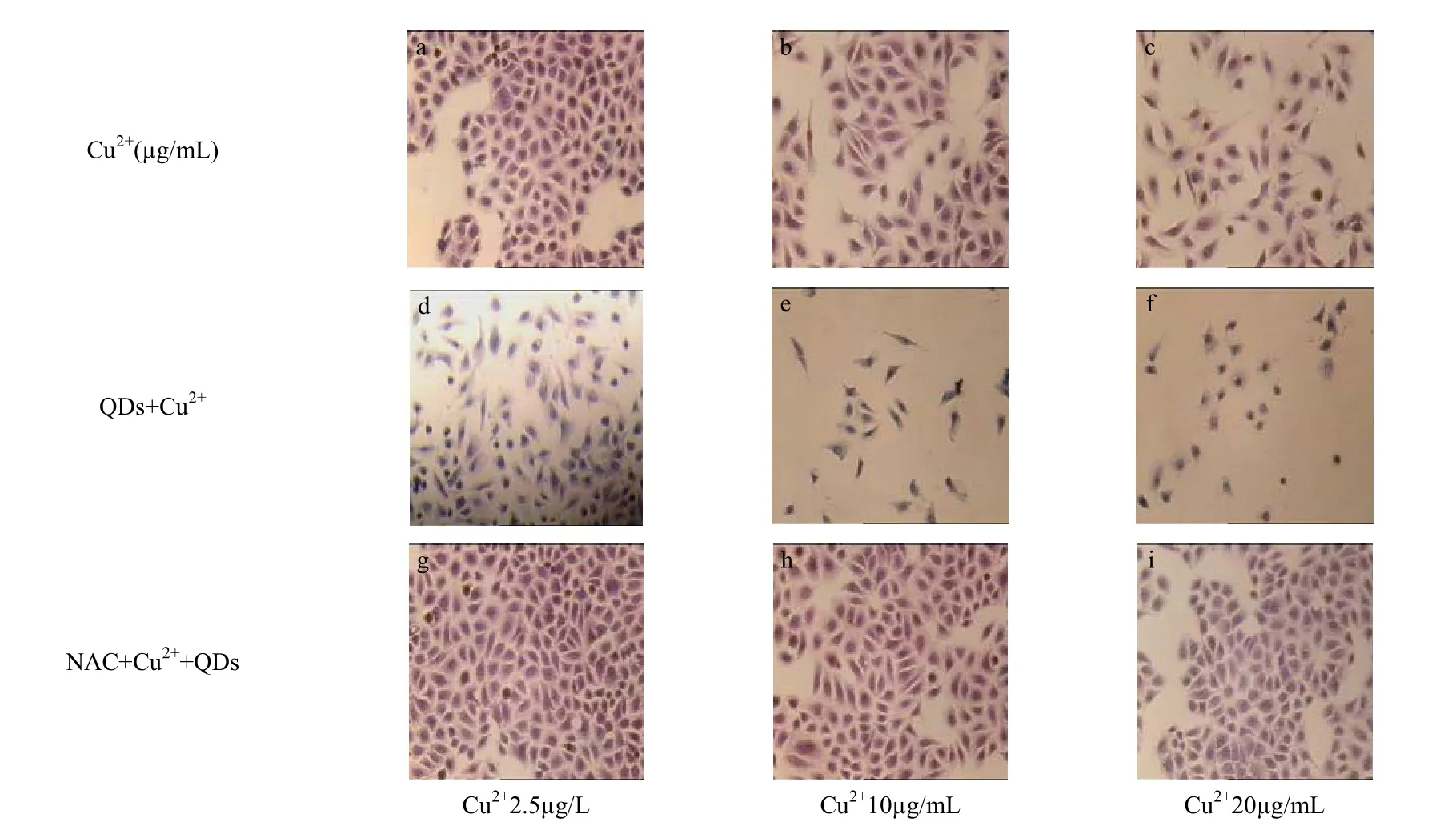
图3 不同处理浓度下单独或者联合处理组的细胞形态染色Fig.3 Effect of NAC on Cu2+ and QDs-Cu2+ induced cell morphology changes
3 讨论
无毒的量子点(LC10)的存在使得原本低毒的 Cu2+(LC50以下)毒性显著提高.这一结果同Wilson等关于过渡金属和超细粉末的联合氧化损伤是一致的[20].也就是说当量子点和Cu2+共存于环境中时并没有由于可能的结合带来毒性的减弱,而是由于共通的氧化损伤带来了毒性的增强.当多种量子点和重金属毒物共存于污染水体中时,将出现复杂的联合毒性效应,所以仅用各种纳米材料或者重金属单一毒性的污染指标判断水污染后的毒性是不可取的.还应从联合毒性的角度采用生物毒性试验方法对水质污染作出较客观的综合评价.
此外,由于纳米技术的产业化,以及纳米材料在医疗诊断、材料改性、环境污染物降解以及生物技术等领域的广泛应用[5,21],不可避免地会带来由于生产增加而带来的环境排放量的增加[14].而且由于其在细胞无损伤的实时成像、药物运送等方面的应用可能带来量子点的体内蓄积,Yang等[22]也证明了量子点在体内会重新再分配并且主要在肝中蓄积[22].同样Cu2+作为原生的环境污染物由于工业和自然地理的原因在造成环境污染,并且作为人体必需的元素也主要是富集在肝脏[23].所以无论量子点和Cu2+在环境中或者由于医疗作用等原因在体内共存并且由此带来复合伤害的危险都存在.这就使得对于复合污染尤其是对于单独污染评价认为是安全基础上的复合毒性的评价和相应的机理以及防护措施的研究等尤其必要.
关于量子点的毒性机制研究主要集中在重金属元素Cd2+的释放、氧化过程中活性氧的产生以及活性氧自由基介导的氧化应激等方面的探讨[5],关于铜的致毒机理有很多,也包括活性氧自由基介导的氧化应激[24]以及通过激活AP-1转录和 JNK/SAPK及p38转导等路径实现.NAC作为有效的ROS防护剂能够有效的防止氧化损伤证明了2种污染物能够通过共通的氧化损伤路径来实现对肝细胞的致毒效应.
氧化应激使机体处于易损状态,它不仅与多种疾病的发生发展有关,此外尚有资料表明活性氧可启动一个链式反应,易与细胞膜上的各种不饱和脂肪酸及胆固醇反应,这种直接作用于细胞的氧化损伤能导致从而导致细胞脂质过氧化水平升高,引起 DNA氧化损伤,细胞凋亡[26].所以考察NAC作为抗氧化剂是否提供有效的防护作用具有现实意义.也就是说可以为可能与量子点有关的环境污染或者体内毒性提供合理的解决路径.
4 结论
4.1 量子点和Cu2+的加入都会对L02细胞产生毒性.两者的LC50分别为20μg/mL和31.3μg/mL并且该毒性都与氧化损伤有关.NAC能够有效的防护量子点和 Cu2+单独作用或者联合作用诱导的细胞毒性.
4.2 无毒的量子点(LC10)的加入显著提高Cu2+(LC50以上)的毒性,使得 Cu2+半致死浓度由31.3μg/mL降为3.83μg/mL.表明了无毒的量子点与无(低)毒的环境污染物的共存可能造成潜在的毒性效应和环境风险.
参考文献:
[1] Gao X H, Cui Y Y, Levenson R M, et al. In vivo cancer targeting and imaging with semiconductor quantum dots [J]. Nature Biotechnology, 2004,22(8):969-976.
[2] Zou L, Gu Z Y, Zhang N, et al. Ultrafast synthesis of highly luminescent green- to near infrared-emitting CdTe nanocrystals in aqueous phase [J]. Journal of Materials Chemistry, 2008,18: 2807-2815.
[3] Michalet X, Pinaud F F, Bentolila L A, et al. Quantum dots for live cells, in vivo imaging, and diagnostics [J]. Science, 2005, 307(5709):538-544.
[4] Howarth M, Takao K, Hayashi Y, et al. Targeting quantum dots to surface proteins in living cells with biotin ligase [J]. Proceedings of the National Academy of Sciences, USA, 2005,102(21): 7583-7588.
[5] 李鸿程,周群芳,刘 伟,等.量子点毒性效应的研究进展 [J]. 中国科学B辑:化学, 2008,38(5):396-403.
[6] Hanaki K, Momo A, Oku T, et al. Semiconductor quantum dot/albumin complex is a long-life and highly photostable endosome marker [J]. Biochemical and Biophysical Research Communication, 2003,302(3):496-501.
[7] 殷海荣,唐 萌,夏 婷,等.量子点CdTe对RAW264.7细胞凋亡和脂质过氧化水平的影响 [J]. 中国现代医学杂志, 2008, 18(18):2593-2597.
[8] 赵宇侠,林匡飞,张 卫,等.量子点与Cu2+对L02细胞毒性的协同作用机理:量子点可能的木马角色 [J]. 环境科学, 2010,31(9): 2196-2201.
[9] Green M, Howman E. Semiconductor quantum dots and free radical induced DNA nicking [J]. Chemical Communications, 2005,(1):121-123.
[10] Ipe B I, Lehnig M, Niemeyer C M. On the generation of free radical species from quantum dots [J]. Small, 2005,1(7):706-709.
[11] Tsay J M, Michalet X. New light on quantum dot cytotoxicity [J]. Chemistry and Biology, 2005,12(11):1159-1161.
[12] Shi LM, Jiang H, Wang J, et al. Mitochondria dyfunction was involved in copper-induced toxicity in MES23.5 cells [J]. Neuroscience bulletin, 2008,24(2):79-83.
[13] Halliwell B,Gutteridge J M C. Free Radicals in Biology and Medicine [M]. Oxford:Clarendon Press, 1989:15-19.
[14] Hardman R, A Toxicologic Review of Quantum Dots: Toxicity Depends on Physicochemical and Environmental Factors [J]. Environmental Health Perspective, 2006,114(2):165-172.
[15] Pourahmad J, O’Brien P J A. Comparision of Hepatocyte Cytotoxic Mechanisms for Cu2+and Cd2+[J]. Toxicology, 2000, 143:263-273.
[16] 易 秀.铜对生物有机体的毒性及抗性机理 [J]. 农业环境保护, 1997,l6(4):l87-l89.
[17] Lovric J, Cho S J, Winnik F M, et al. Unmodified Cadmium Telluride Quantum Dots Induce Reactive Oxygen Species Formation Leading to Multiple Organelle Damage and Cell Death [J]. Chemistry and Biology, 2005,12:1227–1234.
[18] Jorge L P, Gonsebatt M E. The role of antioxidants and antioxidant-related enzymes in protective responses to environmentally induced oxidative stress [J]. Mutatation Research, 2009,674:137-147.
[19] Zhao Yuxia, Lin Kuangfei, Zhang Wei, et al. Quantum Dots Enhance Cu2+-induced Hepatic L02 Cells Toxicity [J]. Journal of Environmental Science, 2010,22(12):1993-1998.
[20] Wilson M R, Lightbody J H, Donaldson K, et al. Interactions between ultrafine particles and transition metals in vivo and in vitro [J]. Toxicology and Applied Pharmacology, 2002,184,172-179.
[21] Nel A, Xia T, Mädler L, et al. Toxic potential of materials at the nanolevel [J]. Science, 2006,311(5761):622-627.
[22] Yang R S H, Chang L W, Wu J P, et al. Persistent Tissue Kinetics and Redistribution of Nanoparticles, Quantum Dot 705, in Mice: ICP-MS Quantitative Assessment [J]. Environmental Health Perspective, 2007,115(9):1339-1343.
[23] Luza S C, Speisky H C. Liver copper storage and transport during development: implications for cytotoxicity [J]. American journal of clinical nutrition, 1996,63(5):812-820.
[24] SinghRana S V, Metals and apoptosis:Recent developments [J]. Journal of trace elements in experimental medicine, 2008,22:262–284.
[25] Mattie M D, McElwee1 M K, Freedman J H. Mechanism of Copper-Activated Transcription: Activation of AP-1, and the JNK/SAPK and p38 Signal Transduction Pathways [J]. Journal of Molecular Biology, 2008,383:1008-1018.
[26] Finkel T, Holbrook N J. Oxidants, oxidative stress [J]. Nature, 2000,408:239-247.
Combined toxicity of QD-Cu2+on L02 cells and protective effect of NAC.
ZHAO Yu-xia1, LIN Kuang-fei2*, ZHANG Wei2, LIU Li-li2(1. School of Chemical Engineering, Huaihai Institute of Technology,Liangyungang 222005, China; 2.Research Center of Risk Assessment and Management on Hazardous Chemicals, School of Resource and Environmental Engineering, East China University of Science and Technology, Shanghai 200237, China). China Environmental Science, 2012,32(1):162~167
The oxidative injury of individual QDs or Cu2+to hepatic cells were both reported, the combined toxicity is concerned due to the co-existence of these two chemicals in human liver. We thus employed human hepatic L02 cells to test the combined toxicity of QDs and Cu2+(lower toxicity) through the cell viability decrease and cell morphology changes, meanwhile, the protective effect of antioxidant reagent NAC was used to evaluate the oxidant injury associated toxicity mechanism. The results showed that both QDs and Cu2+could decrease the cells viability, and addition of IC10of QDs could significantly improve Cu2+induced cell toxicity with cell viability decrease up to 300 %. NAC showed remarkable protective effects with almost identical cell viability and cell morphology compared to the control, indicating the coexistence of lower toxicity of QDs could improve Cu2+induced L02 cells toxicity, and NAC could effectively decrease QDs-Cu2induced oxidant injury toxicity.
CdTe-MPA quatum dots;Cu2+;L02 cells;MTT;combined toxicity
2011-03-11
国家自然科学基金资助项目(40901148,41001316);淮海工学院自然科学基金项目(kx10516);连云港市科技局农业攻关项目(NY1007)
* 责任作者, 教授, kflin@ecust.edu.cn
X171.5
A
1000-6923(2012)01-0162-06
赵宇侠(1974-),女,吉林农安人,讲师,博士,研究方向为环境毒理学和环境微生物.发表论文10余篇.
