多环芳烃污染对桑园土壤微生物结构及种群多样性的影响
2012-12-25姜睿玲杨统一唐玉斌陈芳艳江苏科技大学生物与化学工程学院江苏镇江212018
姜睿玲,杨统一,唐玉斌,陈芳艳 (江苏科技大学生物与化学工程学院,江苏 镇江 212018)
多环芳烃污染对桑园土壤微生物结构及种群多样性的影响
姜睿玲,杨统一,唐玉斌*,陈芳艳 (江苏科技大学生物与化学工程学院,江苏 镇江 212018)
采用磷脂脂肪酸(PLFAs)分析法和变性梯度凝胶电泳(DGGE)考察了受多环芳烃(PAHs)污染的桑园3个区域的土壤微生物群落结构及种群多样性的变化.PLFAs分析结果表明,区域2中微生物PLFA总量最高,主要为细菌和真菌;聚类分析揭示,土壤中微生物的PLFAs主要分为3大类群;冗余分析表明,土壤PAHs污染程度对土壤微生物群落结构有一定的影响.DGGE指纹图谱分析结果显示,在PAHs污染较高区域,其电泳条带较多,且3个区域中Shannon指数和Simpson优势度差异达显著水平,区域2种群优势度较高;主成分分析表明,不同区域微生物的种群结构存在显著性差异.
桑园土壤;微生物多样性;多环芳烃;PLFAs;PCR-DGGE
多环芳烃(PAHs)是环境中存在的一种典型的持久性有机污染物,许多PAHs具有致癌、致畸、致突变和生物难降解特性[1].开展PAHs污染土壤微生物多样性的研究,将有助于了解PAHs对土壤微生物群落结构的影响.土壤微生物群落是土壤生态系统的重要组成部分,在环境气候的形成、地球化学循环、地质演化和生物进化中扮演着重要角色[2].近年来,土壤受到的污染日益严峻,这对土壤微生物多样性造成严重威胁[2-3].目前,不依赖分离培养的微生物研究方法,为土壤微生物研究提供了新的技术,包括生物标记法和分子生物学方法等.磷脂脂肪酸(PLFAs)是生物体细胞膜的主要组成成分之一,是存活微生物的生物标记,细胞死亡后数分钟到数小时内磷脂化合物会迅速分解,且不同类群的微生物具有特异的脂肪酸[4-5].因此,土壤 PLFAs组成和含量的变化在一定程度上可以反映土壤中存活的微生物群落结构及其数量的动态变化[6].另外,近年来基于16S rRNA的变性梯度凝胶电泳(DGGE)等分子生物学技术在表征微生物群落遗传多样性方面发挥着愈来愈重要的作用.其中PCR-DGGE在微生物群落多样性和种群动态检测中得到广泛应用[7].
研究表明,土壤微生物活性和群落功能多样性受到土壤质地和植物种类组成的影响[8].目前,关于桑园土壤微生物多样性的研究鲜有报道,本研究分别采用PLFAs和PCR-DGGE技术从不同的层面分析PAHs复合污染对桑园土壤微生物群落结构及种群多样性的影响,为生态桑园的建设提供理论依据.
1 材料与方法
1.1 样品采集及处理
供试土样于2011年5月取自江苏省镇江市某路域桑园.沿公路一侧垂直于公路设置3个取样区域,第一个采样点距离公路50m.每个区域间隔150~200m(图1).各区域均采用正方形5点法取样,将每个区域的5个点的土样混合在一起,构成一个区域的一次采集的混合土样,每个区域分别按照这种方法取 3个重复样,3个区域共取 9个混合土样(重复样).取土深度为0~20cm,各处理混合均匀后除去砂砾和动植物残体,一部分冻干后于-20℃下保存,随后进行土壤微生物 PLFAs的提取和测试分析;另一部分直接在-20℃下保存,以备进行分子生物学实验.
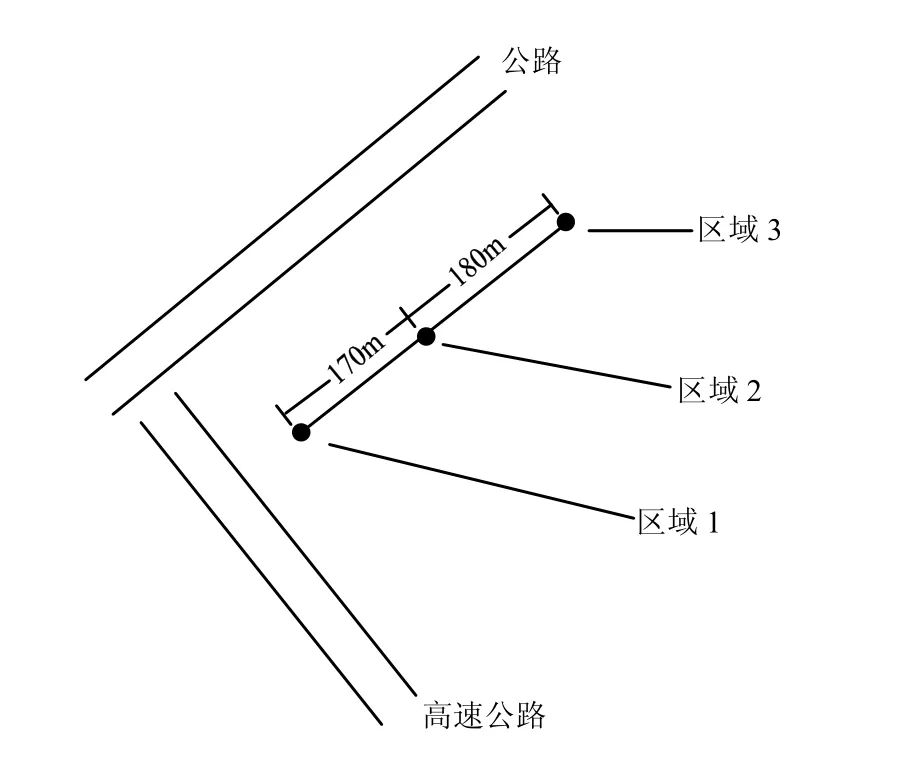
图1 某路域桑园示意Fig.1 Schematic diagram of road-side mulberry orchard
此桑园 3个区域的土壤成土母质是石英砂岩、古代沉积岩、页岩的风化物.3个区域土样的理化性质见表1.
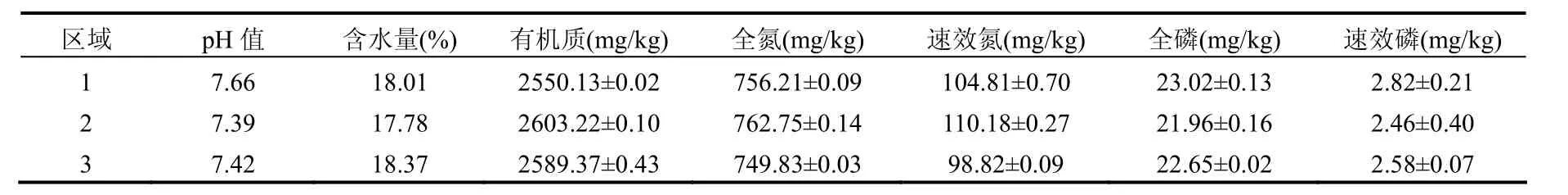
表1 供试土壤基本理化性质Table 1 Physical and chemical properties of the soil tested
因桑园靠近高速公路,常年受汽车尾气影响,汽车尾气中的PAHs可通过空气沉降作用进入土壤中.除图1所示的高速公路外,还有一条与图1所示公路相垂直、在桑园右侧(向北看)与桑园边缘相距200m左右的公路,也对桑园土壤的PAHs污染有所贡献.此外,桑园土壤中的PAHs还可能来源于附近大桥上汽车尾气以及郊区居民对稻麦草的焚烧等其他途径.3个区域共检测到15种PAHs,分别为:NAP (萘)、ACY(苊烯)、FLU(芴)、PHE(菲)、ANT(蒽)、FLT (荧蒽)、PYR(芘)、CHR ()、BaA (苯并[a]蒽)、BbF (苯并[b]荧蒽)、BkF (苯并 [k]荧蒽)、BaP (苯并[a]芘)、IPY (茚苯(1,2,3-cd)芘)、DBA (二苯并(a, n)蒽)、BPE (苯并(ghi)苝(二萘嵌苯)).监测结果表明,区域2可能处于 PAHs最佳沉降点,其 PAHs总含量最高(3.469mg/kg),区域3次之(0.933mg/kg),区域1最低(0.637mg/kg).
1.2 PLFAs生物标记分析方法
土壤微生物群落结构分析采用磷脂脂肪酸分析法.PLFAs的提取和测定参照 Bligh[9]方法并略作修改.步骤为:称6g土样加20mL脂类提取液(V氯仿:V甲醇:V柠檬酸缓冲液=1:2:0.8),250r/min避光振荡4h,以4500r/min离心并取上清液,重复操作,合并上清液,加8mL氯仿和8mL柠檬酸缓冲液,静置过夜.取 5mL下层溶液,氮气吹干后加1mL氯仿.过硅胶柱,含磷脂的极性脂类用 5mL甲醇洗,洗液吹干后溶于1mL甲醇+甲苯混合液(体积比1:1),加1mL 0.2mol/L KOH,水浴.依次加2mL正己烷,0.3mL 1mol/L醋酸,2mL去离子水.以4500r/min的速率离心并收集上层液,吹干后溶于 200µL含内标(C19:0)的正己烷中,转入1.5mL进样瓶中,-20℃冰箱中避光保存,备GC-MS分析.
采用美国Agilent 6850型气相色谱仪,包括全自动进样装置、石英毛细管柱及氢火焰离子化检测器.分离柱为Agilent 19091B-102E超25%苯基甲基硅氧烷25.0m×200μm×0.33μm柱.进样口温度250℃,程序升高柱温:起始170℃,以5℃/min升高到260℃,再以40℃/min升高到310℃,保持1.5min.后运行170℃保持1.5min.载气为氦气,分离比为 100:1.进样量为 2mL.PLFAs的鉴定采用美国MIDI公司(MIDI,Newark,Delaware,USA)开发的基于细菌细胞脂肪酸分析鉴定的 Sherlock MIS 4.5系统.
磷脂脂肪酸的系统命名,以总碳数:双键数和双键距分子末端位置命名,i和a分别表示支链的异构和反异构,c和t分别表示双键的顺式和反式结构,cy表示环丙基脂肪酸,10Me表示一个甲基在距分子末端第10个碳原子上[10].不同的生物标记代表着不同类型的微生物.根据现在已有的研究结果[11],本研究以 i11:03OH、12:00、13:0 2OH、14:1 w5c、i15:1 G、i15:0、a15:0、15:00、i15:0 3OH、i16:0、a16:0、16:00、a17:0、i17:0 3OH、cy17:0、18:00、cy19:0 w8c和16:0 N alcohol作为细菌特定脂肪酸;其中革兰氏阳性菌(G+)以i15:0、a15:0、i16:0、a16:0、a17:0和16:0 N alcohol表示;革兰氏阴性菌(G¯)以 i17:0 3OH 和 cy17:0表示;放线菌以 10 Me18:0,TBSA 表示;真菌源脂肪酸以 18:3ω6c (6,9,12)和18:1 w9c表示[12].
1.3 土壤DNA提取及16S rRNA可变区的PCR扩增
DNA提取采用美国Mobio强力土壤DNA提取试剂盒(PowerSoil® DNA Isolation Kit).采用细菌的 16S rDNA通用引物对稀释后的土壤总DNA进行扩增.引物序列是:338F:5-ACTCCTACGGGAGGCAGCAG-3;534R:5-GCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGATTACCGCG GCT GCTGG-3.PCR反应采用50µL扩增体系,包括:10×PCR Buffer 5μL, dNTP混 合 物 (各 2.5mmol/L) 4μL,引 物 338F (20μmol/L)1μL,引物 534R(20μmol/L) 1μL,模板DNA 2.5ng,TaKaRa rTaq (5U/μL) 0.25μL,ddH2O补至 50μL.PCR反应条件为:94℃ 1 0min,94℃变性1min,55℃退火1min (每个循环降低0.1℃), 72℃延伸1min 30s,共30个循环,最终72℃延伸10min. PCR产物用1.0%琼脂糖凝胶电泳进行检测.
1.4 PCR产物的变形梯度凝胶电泳分析
采用美国 Bio-Rad 公司 The DcodeTMUniversal Mutation Detection System进行变形梯度凝胶电泳.采用 8%胶浓度,变形范围为 30%~60%,电泳条件为150V,时间420min.电泳结束后采用银染染色.
1.5 数据处理与统计分析
PLFAs数据用Microsoft Excel 2003处理;方差分析、主成分分析及聚类分析等多元统计分析用软件 SPSS18.0完成;利用 Quantity One软件(Bio-Rad)对DGGE图谱进行数字化处理;采用平均距离法 (UPMGA)聚类分析;选用 Shannon指数(H)、Shannon均匀度(E)和Simpson优势度(D)表征土壤微生物状态.

式中:Pi为第i个DGGE条带的灰度占每个泳道总条带灰度的比率;S为DGGE条带总数.
2 结果与讨论
2.1 PLFAs生物标记种类数及含量的变化
桑园3个区域土样中共检测到22种PLFAs,不同的生物标记代表不同类型的微生物,其在不同区域土壤中的分布有所差异(图2).

图2 PLFAs图谱Fig.2 PLFAs spectrum of graph of the tested soils
由图2可知, cy17:0仅出现在区域3中,而i16:0只出现在区域2和区域3中,同时,区域3中没有i11:0 3OH,而区域2中没有18:0和10Me 18:0;其余的17种PLFAs在3个区域中均有不同浓度的分布.总体而言,不同区域的 16:0、18:1w9c、a16:0、i20:0、a15:0含量均较多,共占总PLFAs含量的58.85%.研究表明脂肪酸 16:0可代替总PLFAs表征土壤总微生物量[13],3个区域中16:0浓度:区域2>区域1>区域3,由此可见, PAHs污染严重的区域,其微生物总量较高,这可能是因为PAHs为土壤微生物提供了丰富的碳源,刺激了微生物的活性,使其代谢旺盛,生长繁殖速度较快.当然,也可能与区域2有机质和氮的含量偏高有关.
2.2 不同浓度 PAHs对土壤微生物群落结构的影响
土壤中细菌、真菌、放线菌含量反映土壤微生物的区系结构[14].由图3可发现,受PAHs污染最严重区域,其土壤中细菌、真菌含量较高,不含放线菌.其中,细菌中革兰氏阳性菌含量最高,而受PAHs污染较为严重区域革兰氏阴性菌含量最高.通过方差分析发现,不同浓度的PAHs对革兰氏阳性菌、革兰氏阴性菌和真菌均有显著影响.对于革兰氏阳性菌:区域 2>区域 1>区域 3,说明PAHs能特异性地刺激土壤革兰氏阳性菌的生长.对于革兰氏阴性菌:区域3>区域2>区域1,表明较高浓度 PAHs不利于革兰氏阴性菌的生长,适当浓度的PAHs对革兰氏阴性菌的生长具有刺激作用.而对于真菌:区域2>区域1>区域3.整体来看,土壤中检测到的放线菌PLFAs最少,区域2中未检测到放线菌,表明在较高浓度 PAHs污染的土壤中,放线菌在生存竞争中处于劣势.

图3 不同区域土壤微生物的群落结构Fig.3 Microbial community structure of soil samped from different area
2.3 土壤微生物群落PLFAs的聚类分析
聚类分析结果如图4所示,当欧式距离为10时,不同区域土壤微生物的PLFAs被分成三个大类群.类型Ⅰ包括磷脂脂肪酸i11:0 3OH、12:0、i15:1G、13:02OH、14:1w5c、16:0N alcohol、18:0、 18:3w6c(6,9,12)、i15:0、cy17:0、10Me18:0、i16:0和cy19:0 w8c,此类群特征是:在3区域中含量都较低,而且有些PLFAs只在某2个区域甚至某1个区域中存在;类群Ⅱ包括磷脂脂肪酸 a15:0、a17:0、i20:0、i15:0 3OH、a16:0、18:1w9c、16:0,其特征是这些磷脂脂肪酸在 3个区域中均有分布且含量较高;类群Ⅲ包括磷脂脂肪酸 i17:0 3OH,它是区域3中含量最高的磷脂脂肪酸.

图4 桑园土壤微生物群落的PLFAs聚类分析Fig.4 Cluster analysis of PLFAs of microbial community in mulberry orchard soil
2.4 土壤微生物PLFAs与环境因子关系的冗余分析
冗余分析(RDA)显示不同区域微生物PLFAs与PAHs之间的关系(图5).由图5可知,从区域上分析,区域1和区域3的差异较小,而与区域2的差异较大.区域1在RDA1上比较分散,正负半轴均有分布,而区域2集中在RDA1的正半轴,区域 3分布在 RDA1的负半轴.从区域和PAHs的关系来看,区域2与绝大多数PAHs成正相关,且与FLU相关性最高,只与BPE和PRY成负相关,这与检测出区域2中PAHs浓度最高相一致.区域1与PAHs相关性最小.从土壤微生物的PLFAs与PAHs的关系来看,细菌PLFAs总浓度与绝大多数PAHs有正相关性,与FLU呈显著正相关性;而真菌PLFAs总浓度与FLT、ACE、ANT和 ACY呈正相关性且相关性较大,而与其他PAHs相关性较小;放线菌 PLFAs总浓度只与PYR和 BPE呈正相关性且相关性较小,与其余PAHs均成负相关性.从土壤微生物的PLFAs与区域来看,区域2与细菌PLFAs总浓度呈显著正相关性,区域3与放线菌PLFAs总浓度呈显著正相关性.总的来说,区域2中的细菌受到PAHs的影响最大,其次是真菌.

图5 区域与环境因子的冗余分析Fig.5 Redundancy analysis of regional and environmental factors
2.5 DGGE图谱分析
对3个区域9个样品的PCR扩增产物进行DGGE分析(图6).从图6可见,3个区域中总条带数为区域2>区域3>区域1,结合区域中PAHs含量发现,较高的 PAHs有利于土壤微生物多样性提高.万春黎等[15]研究石油污染土壤中细菌群落结构特征时发现,未受石油污染的土样中,能检测到的微生物群落条带较少,这与本文的研究结果一致.不同区域土样分离出来的条带不一样,其中条带 2、5、9、10、22、26、27、28、29、30和31为3个区域共有条带,而条带3和7是受PAHs污染相对较严重的区域2所特有条带. 这可能由于土壤中细菌能利用 PAHs作为其碳源,且许多细菌开始降解 PAHs,随着时间的推移,逐渐成为该区域土壤中的优势菌.因此条带 3和 7可能对应的是土壤中PAHs的高效降解菌株.
2.6 桑园土壤微生物群落多样性指数分析
多样性指数Shannon指数(H)、Shannon均匀度(E)和Simpson优势度(D)是从不同角度反映土壤微生物群落结构特征的度量值,它们可以反映群落类型的不同,群落结构的差异,群落演替的动态变化[16].根据DGGE图谱,分别计算Shannon指数、Shannon均匀度和Simpson指数(表2).

图6 不同土壤样品的DGGE图谱Fig.6 DGGE fingerprint of microbial communities of different soil samples
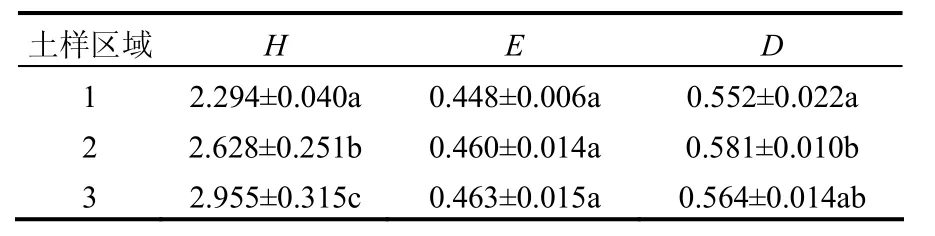
表2 桑园土壤微生物群落多样性指数Table 2 Diversity index of microbial community in mulberry orchard soil
由表2可知,多样性指数H和均匀度E为区域3>区域2>区域1,而优势度D为区域2>区域3>区域1.这可能由于长期受PAHs污染的情况下,污染程度相对较低的区域3中,其土壤中细菌更适应该种生态条件,从而导致种群数量相对较高,而PAHs污染相对较严重的区域2,其土壤中细菌利用PAHs作为碳源,随着时间的推移,许多细菌开始逐渐降解 PAHs,繁殖并成为该区域的优势菌种,因此区域2种群优势度较高.当然,区域2种群优势度较高,也可能和区域2土壤氮素较高有关.Shannon均匀度表明PAHs对土壤微生物的均匀度影响差异不显著.朱艳华等[17]研究指出低浓度原油增加了微生物生物量,而高浓度产生抑制作用,原油污染存在中等浓度效应;高浓度原油污染土壤“优势群体”丰富度较高,即群落区域单一化.而原油中含有丰富的 PAHs,其研究结果与本研究一致.
2.7 DGGE图谱的主成分分析
主成分分析可比较微生物群落种群多样性差异的大小,根据DGGE图谱,对不同区域的土壤微生物类群进行主成分分析,得到 2个主成分PC1和 PC2,它们分别解释了总变异的61.6%和25.9%(图7).
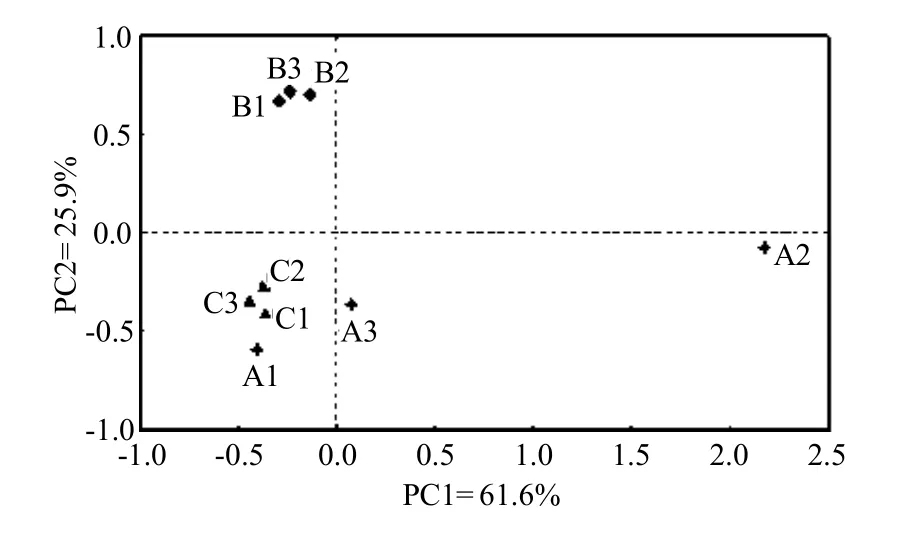
图7 DGGE图谱的主成分分析Fig.7 Principal components analysis of DGGE profiles
由图7可看出,区域2和区域3分布在PC1的负方向,区域 1在 PC1的正负方向均有分布;区域2分布在PC2的正方向,而区域1和区域3分布在PC2的负方向.区域3在PC1上的得分值最低,其次为区域2,且两区域的得分值较接近,而区域1在PC1上的得分值较高且有很好的分离.总体来看,PAHs污染程度不同的区域其土壤微生物DGGE条带有较大差异.
3 结论
3.1 在不同程度的PAHs污染下,3个区域土壤的微生物群落结构发生了明显变化,不同区域土壤微生物的PLFAs可根据不同特征分成3个大类群.
3.2 PAHs污染能显著改变土壤中细菌的结构多样性,区域 2中细菌(革兰氏阳性菌)和真菌含量较高.DGGE图谱表明3和7是区域2特有条带,可能是降解PAHs的优势菌种.
3.3 多样性指数分析表明, PAHs污染存在中等浓度效应, 细菌能利用PAHs作为碳源,并逐渐降解PAHs,形成优势种群.
[1] 何 娇,孔火良,高彦征.表面改性秸秆生物质环境材料对水中PAHs的吸附性能 [J]. 中国环境科学, 2011,31(1):50-55.
[2] 杨翠云,郭淑政,刘 琪,等.石油污染土壤微生物多样性的研究技术及进展 [J]. 安徽农业科学, 2009,37(33):16479-16482, 16533.
[3] Brussaard L, De Ruiter P C, Brown G G. Soil biodiversity for agricultural sustainability [J]. Agriculture Ecosystems and Environment, 2007,121(3): 233-244.
[4] 陈振翔,于 鑫,夏明芳,等.磷脂脂肪酸分析方法在微生物生态学中的应用 [J]. 生态学杂志, 2005,24(7):828-832.
[5] 颜 慧,蔡祖聪,钟文辉.磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用 [J]. 土壤学报, 2006,43(5):851-859.
[6] 王曙光,侯彦林.磷脂脂肪酸方法在土壤微生物分析中的应用[J]. 微生物学通报, 2004,31(1):114–117.
[7] 辜运富,张小平,涂世华,等.变性梯度凝胶电泳(DGGE)技术在土壤微生物多样性研究中的应用 [J]. 土壤, 2008,40(3):344-350.
[8] 孟庆杰,许艳丽,李春杰,等.不同植被覆盖对黑土微生物功能多样性的影响 [J]. 生态学杂志, 2008,2(7):1134-1140.
[9] Bligh E G, Dyer W J. A rapid method of tatal lipid extraction and purification [J]. Canadian Journal of Biochemistry and Physiology, 1959,37:911-917.
[10] Margesin R,Hammerle M,Tscherko D. Microbial activity and community composition during bioremediation of diesel-oil-contaminated soli: effects of hydrocarbon concentration, fertilizers and incubation time [J]. Microbial Ecology, 2007,53(2): 259-269.
[11] Zells L. Fatty acid patterns of phospholipid and lipopolysaccharides in the characterization of microbial communities in soil: a review [J]. Biol. Fert. Soils, 1999,29(2): 111-129
[12] Zells L, Bai Q Y, Beck T, et al. Signature fatty acids in phospholipids and lipopolysaccharides as indicators of microbial biomass and community structure in agricultural soils [J]. Soil Biol. Biochem., 1992,24(4):317-323
[13] Vig K, Singh D K, Agarwal H C, et al. Soil microorganisms in cotton fields sequentially treated with insecticides [J]. Ecotoxicology and Environmental Safety, 2008,69(2):263-276.
[14] Nayyar A, Hamel C, Lafond G, et al. Soil microbial quality associated with yield reduction in continuous-pea [J]. Applied Soil Ecology, 2009,43(1):115-121.
[15] 万春黎,杨 雪,杜茂安,等.石油污染土壤中细菌群落结果特征[J]. 石油学报(石油加工), 2010,26(6):928-933.
[16] 李 晔,孙丽娜,杨继松,等.基于PCR-DGGE的重金属污染土壤微生物种群指纹分析 [J]. 生态环境学报, 2010,19(9):2204-2208.
[17] 朱艳华.污染土壤的微生物学效应及其评价指标 [D]. 呼和浩特:内蒙古大学, 2008.
Effect of PAHs pollution on microbial structure and population diversity of mulberry orchard soil.
JIANG Rui-ling, YANG Tong-yi, TANG Yu-bin*, CHEN Fang-yan (School of Biology and Chemical Engineering, Jiangsu University of Science and Technology, Zhenjiang 212018, China). China Environmental Science, 2012,32(9):1655~1661
Phospholipid fatty acids (PLFAs) analysis method and PCR-denaturing gradient gel electrophoresis (DGGE) technology were used to investigate microbial structure and population diversity of the soil sampled from the three areas of the mulberry orchard, which was contaminated by polycyclic aromatic hydrocarbons (PAHs). The results of PLFAs analysis showed that total PLFA biomass of the microbes in area 2 was the highest, most of which were the bacteria and fungi. Clustering analysis of soil microbes revealed that the PLFAs were mainly divided into three groups. Redundancy analysis demonstrated that PAHs pollution degree had a certain effect on soil microbial community structure. DGGE fingerprint analysis showed that there were more electrophoresis bands in the areas with higher PAHs contamination, and the difference of Shannon index and Simpson dominance degree were significant among three areas. Population dominance degree of the soil in area 2 was the highest. Principal components analysis of DGGE profiles indicated that there were significant differences in population structure of the microbes in different area.
mulberry field soil;microbial diversity;PAHs;PLFAs;PCR-DGGE
2012-02-06
江苏省自然科学基金项目(BK2009726);江苏省普通高校研究生科研创新计划项目(CXZZ11_0274)
* 责任作者, 教授, ybbill@163.com
X171.5, S154.36
A
1000-6923(2012)09-1655-07
姜睿玲(1986-),女,黑龙江青冈县人,江苏科技大学硕士研究生,主要从事环境微生物及其生态学研究.发表论文3篇.
