小流域地下水与地表水微生物组成结构差异及其成因分析
2012-12-25黄小兰陈建耀周世宁谢丽纯杨雪韵蒋华波董林垚江西师范大学地理与环境学院鄱阳湖湿地与流域研究教育部重点实验室江西南昌00中山大学地理科学与规划学院广东广州51075中山大学生命科学学院广东广州51075
黄小兰,陈建耀,周世宁,谢丽纯,杨雪韵,蒋华波,董林垚 (1.江西师范大学地理与环境学院,鄱阳湖湿地与流域研究教育部重点实验室,江西 南昌 00;.中山大学地理科学与规划学院,广东 广州 51075;.中山大学生命科学学院,广东 广州 51075)
小流域地下水与地表水微生物组成结构差异及其成因分析
黄小兰1,2,陈建耀2*,周世宁3,谢丽纯2,杨雪韵2,蒋华波2,董林垚2(1.江西师范大学地理与环境学院,鄱阳湖湿地与流域研究教育部重点实验室,江西 南昌 330022;2.中山大学地理科学与规划学院,广东 广州 510275;3.中山大学生命科学学院,广东 广州 510275)
对中山大学滨海水循环综合试验基地的河道水和地下水进行采样,运用16S rRNA基因分析方法,研究微生物的群落组成、结构,同时,通过Mothur软件分析不同采样点的系统发育多样性和文库稀释曲线.结果表明,上下游河道水和地下水均以变形菌(Proteobacteria),厚壁菌(Firmicutes),古菌(Archaea)为优势种群,变形菌在上游堰、下游堰、R1、R2、R3分别占各自总数的29.7%、30.3%、28.1%、20.9%、14.2%;厚壁菌在上游堰、下游堰、R1、R2、R3分别占各自总数的9.7%、20.3%、19.8%、8.6%、39.6%;古菌(不可培养的泉古菌和广古菌)在上游堰、下游堰、R1、R2、R3分别占各自总数的14.2%、12.3%、11.7%、12.1%、3.5%.表明地下水、地表水微生物组成结构有一定的趋同性.另一方面,酸杆菌(Acidobacteria)、硝化螺旋菌(Nitrospira)、拟杆菌(Bacteroidetes) 和Candidate division OPx等在不同采样点的丰度各异,不同埋藏条件下的地下水和地表水多样性指数与稀释曲线有所不同,揭示小流域的微生物组成、结构具有空间差异.研究显示,受周围水文地质条件、补给差异等影响,微生物种群随之演化,微生物特征与水文地质、化学离子密切相关.
小流域;地下水;地表水;微生物;差异;成因
地表水-地下水的相互作用在全球水循环中发挥着重要的作用.国内外学者在地表水与地下水的相互作用[1-2]的研究取得了显著成果,随着多学科方法的综合应用及交叉研究的加强,微生物-水-岩相互作用成为区域地下水地球化学研究的热点,其中物理、化学、生物的耦合作用尤为重要[3].当前地表-地下水的相互作用几乎涵盖了水循环过程中降雨[4]、截留[5]、蒸发[6]、下渗[7]等数学模拟和物理过程,以及渗滤作用[8]、污染物迁移[9]、氯氟烃(CFCs)测年[10]等化学过程,而生物过程研究的内容主要出现在综述性文章或者针对某种污染的生物修复[11]方面,原位地表水与地下水相互作用的生物过程研究则较少且偏宏观[12].基于此,本研究从微生物的角度出发,通过小流域地下水与地表水微生物组成结构差异及其成因分析,研究地表-地下水微生物分布特征与水文地质、化学离子之间的协同联系,探讨华南滨海花岗岩小流域地下水与河道地表水的交互、演化和环境作用,以期为流域水资源规划、生物多样性和流域生态系统管理等研究提供参考.
1 材料与方法
1.1 研究区概况
珠海市位于北纬21°48′~22°27′、东经113°03′~114°19′.年降水量 1770~2300mm,属亚热带季风气候区,海洋对本地气候的调节作用十分明显.选择位于珠海市区的中山大学滨海水循环综合试验基地为研究对象,基地以雨水、地表水、土壤水、地下水、海水的水分相互转化与物质迁移为理论框架,设立了相关的试验观测设施,整个试验设施分空中、地表、地下3大模块,本研究对象的地表模块为试验小流域的上游堰和下游堰(表1,图 1),其基岩类型为强风化花岗岩,土壤主要是花岗岩风化土壤,土壤厚度 0~3m,该流域的地质特点在珠江三角洲滨海地区十分典型[13];地下模块为R1~R3观测井(表1,图1),根据陕西工程勘察研究院的实地钻探结果,R井组自上而下垂向分布有第四系全新统海陆交互相沉积层(Q4mc)、燕山期花岗岩(γ52),地下水为上层潜水和承压基岩裂隙水.校区内地下水主要受大气降水、地下径流补给与附近地表水体渗透补给,以蒸发及地下水径流的方式排泄,研究区上游堰和下游堰平均流速3~5m/s,地下水流速介于110~132m/a之间.采样时间在2010年6月大雨过后,属雨季.
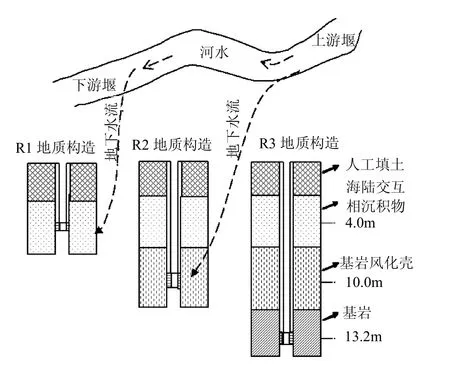
图1 河水-地下水水力联系概念Fig.1 The water power correlation conception diagraph between river water and groundwater
1.2 研究方法
野外调研与实验室分析相结合.野外采样点现场采用GPS定位,用Horiba EC/pH计即时测量水电导率(EC)和pH值等(表1);实验室分析先在现场用无菌聚乙烯瓶采集水样 2L/井,随即经0.8μm和0.22μm滤膜2级过滤,滤后的水样保存好送实验室进行化学离子分析,将 0.22μm滤膜放入消毒后的冷冻存管中,于冰盒中保存,当天运回实验室-20℃以下冰存.
实验室分析方面,采用酸碱滴定法辅以仪器设备分析主要化学组成成分(Ca2+、Mg2+、K+、Na+、Cl-、CO3-、SO42-、HC、Sidiss),然后用GW-Chart软件作出Piper图进行径流不同采样点的化学组成比较;同时,运用16S rRNA基因分析方法[14-15]检测地下水与河道地表水的微生物种群,即首先采取改进的玻璃微珠法[16]提取水样微生物总DNA,利用美国OMEGA公司胶回收试剂盒纯化,置于-20℃保存备用.随后按以下步骤进行实验:(1)PCR(聚合酶链式反应)扩增(扩增采用的引物见表 2):原核类群 PCR反应过程为94℃变性4min,然后94℃,45s,52~55℃ 45s,72℃1min循环30次,72℃延伸10min;古菌PCR反应过程为 94℃变性 4min,94℃ 1min,50~60℃1min,72℃ 1min循环 26次,72℃延伸 10min. (2)PCR产物克隆及RFLP(限制性片断长度多态性)分析:以2μL阳性克隆的菌落PCR产物为模板,分别选用RsaI(GT’ AC)和MspI(C’ CGG) 2种内切酶对 DNA沉淀进行完全酶切,酶切产物用3%琼脂糖凝胶电泳进行检测,分析不同阳性克隆所产生的PCR产物经酶切后的谱型,相同的谱型作为一个OTU,将具有不同谱型的克隆子送上海生工生物技术公司完成序列测定.(3)通过BLAST 程序将测序结果输入 GenBank (http://www.ncbi.nlm.nih.gov/)中进行序列相似性比对分析,通过Mothur和Excel软件生成物种多样性指数和稀释曲线.

表1 样本基本信息Table 1 Basic information of the samples

表2 PCR扩增采用的引物[17-19]Table 2 Primers used for PCR
2 结果与讨论
水样微生物 16S rDNA的部分序列在Genbank核苷酸数据库中接受号为 HQ596988-HQ597006(网址为 http://www.ncbi.nlm.nih.gov/ nuccore/HQ596988- HQ597006).
2.1 微生物种群与多样性
2.1.1 微生物优势种群 数理统计分析中,按占测序总数 5%以上[20]的同类微生物确定为优势种群(表3),试验流域河道水和R井组地下水的微生物均以变形菌门(Proteobacteria),厚壁菌门(Firmicutes),古菌(Archaea)为优势种群,但同为优势群的变形菌门(Proteobacteria),在上游堰分布以α、 β、δ-proteobacteria为优势种群;在下游堰分布以γ、α、β-proteobacteria为优势种群;R1以 α、β、γ-proteobacteria 为 优 势 种 群 ;R2 以 β、δ-proteobacteria为优势种群;R3以 γ、βproteobacteria为优势种群;Archaea除R3外,其余4个水样均属优势微生物种群.Candidate division OPx(Candidate division OP3、OP8、OP11等总称为OPx,x为数字)在上游堰、下游堰、R2井水样中大量存在,而R1和R3井中却没有发现.硝化螺旋菌(Nitrospirae)在R2和R3井有,而在R1井没有检测出,相应地,反硝化细菌(Denitrifying bacterium)在R2和R3井中也有少量存在.蓝细菌在R2、下游堰、上游堰均有分布,而R1和R3井没有发现.

表3 样本优势微生物种群Table 3 Predominant microbial population of the samples
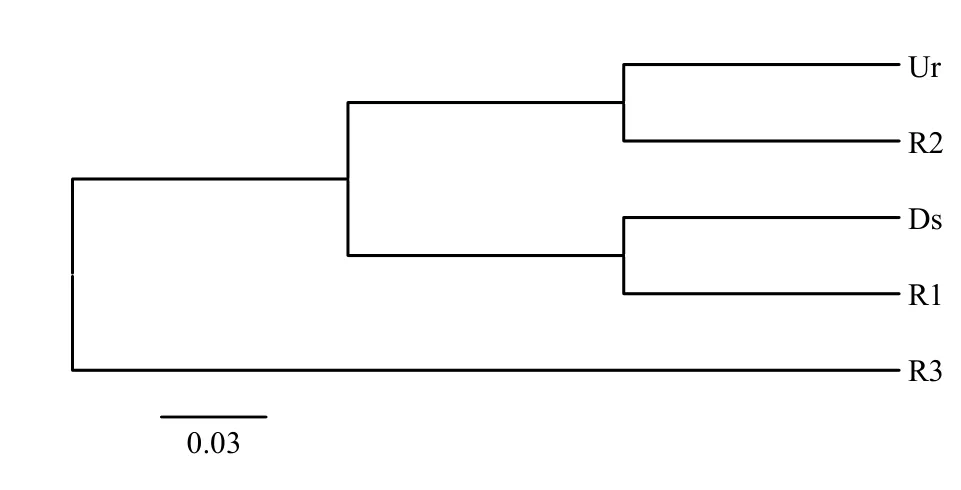
图2 各样点的微生物聚类分析Fig.2 Cluster analysis of Ur, Ds, R1, R2, R3
用MOTHUR软件的UPGMA算法对微生物种群进行聚类分析(图2),从UPGMA树看出,上游堰河道水与R2地下水之间关系较密切,下游堰与R1关系较近,而R3单独一枝,说明13.2m深的地下水微生物与其他4个样点之间的差异更为明显.
系统发育多样性分析运用MOTHUR软件分析5个采样点的系统发育多样性(图3),并生成16S rDNA克隆文库的稀释曲线(图4).
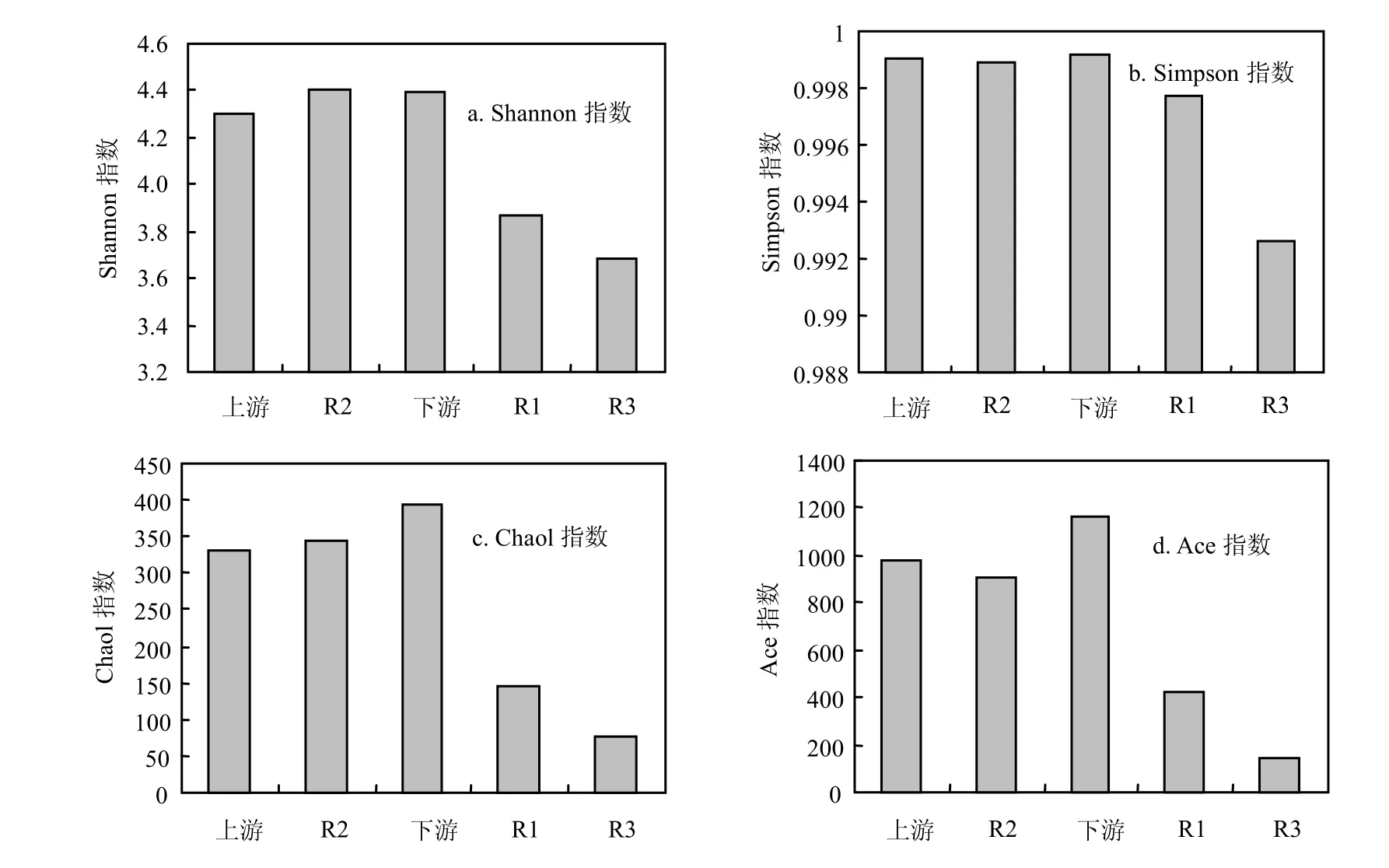
图3 河道水和地下水的系统发育多样性分析Fig.3 The richness/diversity estimators from groundwater and surface water samples
结果表明,上游堰、下游堰和R2井水样的香农指数(Shannon)大于R1、R3井,Simpson、Chao1和 Ace指数也验证了前者的微生物多样性指数高于后者.
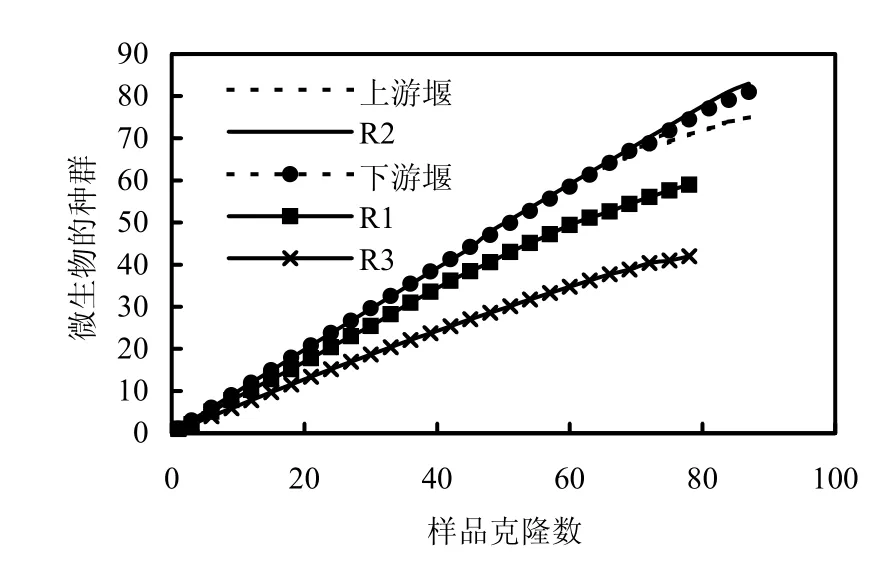
图4 16S rDNA克隆文库的稀释曲线Fig.4 The rarefaction curves from groundwater and surface water samples
当克隆文库的稀释曲线趋于平缓或者趋近平台期时,就可以认为文库的库容已经足够[21]. R3井和R1井的16S rDNA克隆文库的稀释曲线首先趋于平缓,说明R3井和R1井的多样性指数虽然较低,但文库已基本能够代表样品中微生物的多样性.理论上,R1井样品来自浅层非承压含水层,与地表非饱和带联系密切,受地表水(河道)与雨水补给,可供微生物生长繁殖的营养物丰足,因而 R1井水的微生物多样性指数应该也较高,其主要微生物种群与河道水基本一致,只是各种群的丰度稍有差异,这在本次采样分析的前1次采样结果中已有验证(图 5).本次实验结果出现R1井水微生物多样性指数低的原因可能是现场过滤水样时耗费时间稍长,导致优势微生物生长过快而抑制了其他微生物的检出.
2.2 成因分析
2.2.1 水文地质成因 一方面,地下水、地表水微生物组成结构有一定的趋同性;另一方面,受水文地质条件,补给差异等影响,各层微生物种群出现差异并体现地表-地下水之关联.R井组所监测的地下水既包括潜水也包括承压的基岩裂隙水,R1井地质构造以细砂为主,属第四系全新统海陆交互相沉积层(Q4mc);R2井以中风化花岗岩为主,R3井以微风化花岗岩为主,为燕山期花岗岩(γ52).一般地,沉积层具有较丰富的有机质,其中所含的活性有机碳较高,可供微生物利用的物质也相对较高.林立虹等[22]在距地表2.8km深处岩石裂隙的水脉中,发现仅仅依靠地质作用产生的硫酸盐、氢气等能量而生存的微生物种群.R3观测井打入基岩,由于细菌硫酸盐还原作用(2CH2O+SO42−→H2S+2HCO3−)而富硫化氢,这种环境显然不适合好氧微生物发展,在这缺氧的富硫化氢环境中,R3井水发现大量的Bacillus芽孢杆菌(属于厚壁菌门 Firmicutes),芽胞是细菌在极端环境下产生的一种抗逆性强的构造,荚膜也是细菌在特殊环境下产生的一种可使细菌免受恶劣环境损伤的细菌附属物[23],R3井为基岩裂隙水,其水量受补给源控制也不够丰足,处于还原环境,在现场采水样时有明显的臭鸡蛋味,因此在R3井水的分析结果中,各种芽孢杆菌占绝对优势,而其他微生物种群明显少于另外 4个水样.R2井表现一定的承压与缺氧环境,相比而言,R2井水的微生物多样性较丰富,可能与其含水层包涵更多的花岗岩风化破碎层因而与河道水联通有关.
上游堰和下游堰的基岩类型为强风化花岗岩,土壤主要是花岗岩风化土壤,其河道水的补给源除地表径流、壤中流之外,基流也是重要组成部分.曾松青等[24-25]利用同位素研究中山大学滨海水循环综合试验基地的花岗岩小流域,结果表明,基流占小流域全年径流量的比例为 68%~74%.这与 Katsuyama等[26]发现一个花岗岩小流域的基岩地下水对河岸带有大量的补给一致.因此,尽管采样前下大雨,上游堰和下游堰河道水均有部分来自地下水.在微生物组成结构上,表现为上游堰河道水与 R2井水较为接近,均是古菌占最大优势,微生物香农指数也相近;下游堰河道水与 R1井水较为接近,均是厚壁菌门(Firmicutes)占最大优势,这从它们的水力联系和地质构造上(图 5)可得以解释:上游堰与基岩风化壳(燕山期花岗岩(γ52))连通,R2井埋藏条件也主要为燕山期花岗岩风化壳(γ52);下游堰与第四系全新统海陆交互相沉积层(Q4mc)联系密切,R1井埋藏条件也主要为第四系全新统海陆交互相沉积层(Q4mc),与微生物聚类结果一致.
对比分析试验小组于 6月份实测上下游堰水位与R1~R3井水位变化资料(图6),上游堰的水位变化幅度大,依次是下游堰、R1、R2、R3井.R1井埋藏条件为海陆交互相沉积层,与下游堰河床类似,水位变化幅度自然较大;R2井与R3井的主要差别在于前者包涵更多的花岗岩风化破碎层,而后者破碎层较少,但有一定裂隙发育.因而,河道水和R2井地下水比R3井地下水有更强的水力联系;R3井地下水则比较平稳,受地表水影响较小.从时间来看,井水对河道水涨落无明显的延迟,即地下水与河道水微生物的异同不受延迟影响.微生物分布方面,R2井Archaea为最优势种群,与上游堰一致,其余的优势种群如β-proteobacteria,Candidate division OPx, Firmicutes, δ-proteobacteria等,也与上游堰基本相同,但硝化细菌(Nitrospira)在R2井为优势微生物种群而在上游堰却未发现,是因为硝化细菌大多数为专性化能自养型,只有少数为兼性自养型,大多数好氧,怕光.R1井Firmicutes为最优势种群,与下游堰一致,其他如 α, β, γ-proteobacteria、Archaea等也与下游堰基本类同,但R1井有优势种群酸杆菌(Acidobacteria)而下游堰只有少量酸杆菌存在,这与 R1井处于果园,与地表有较多的枯叶腐烂相关.R3井地下水处于还原环境,因而属于厚壁菌门(Firmicutes)的各种芽孢杆菌占微生物总数的 39.6%,为绝对优势,其余优势种群γ-proteobacteria,β-proteobacteria,Nitrospira,Bacte roidetes所占比例明显较少,处于5%~10%之间.
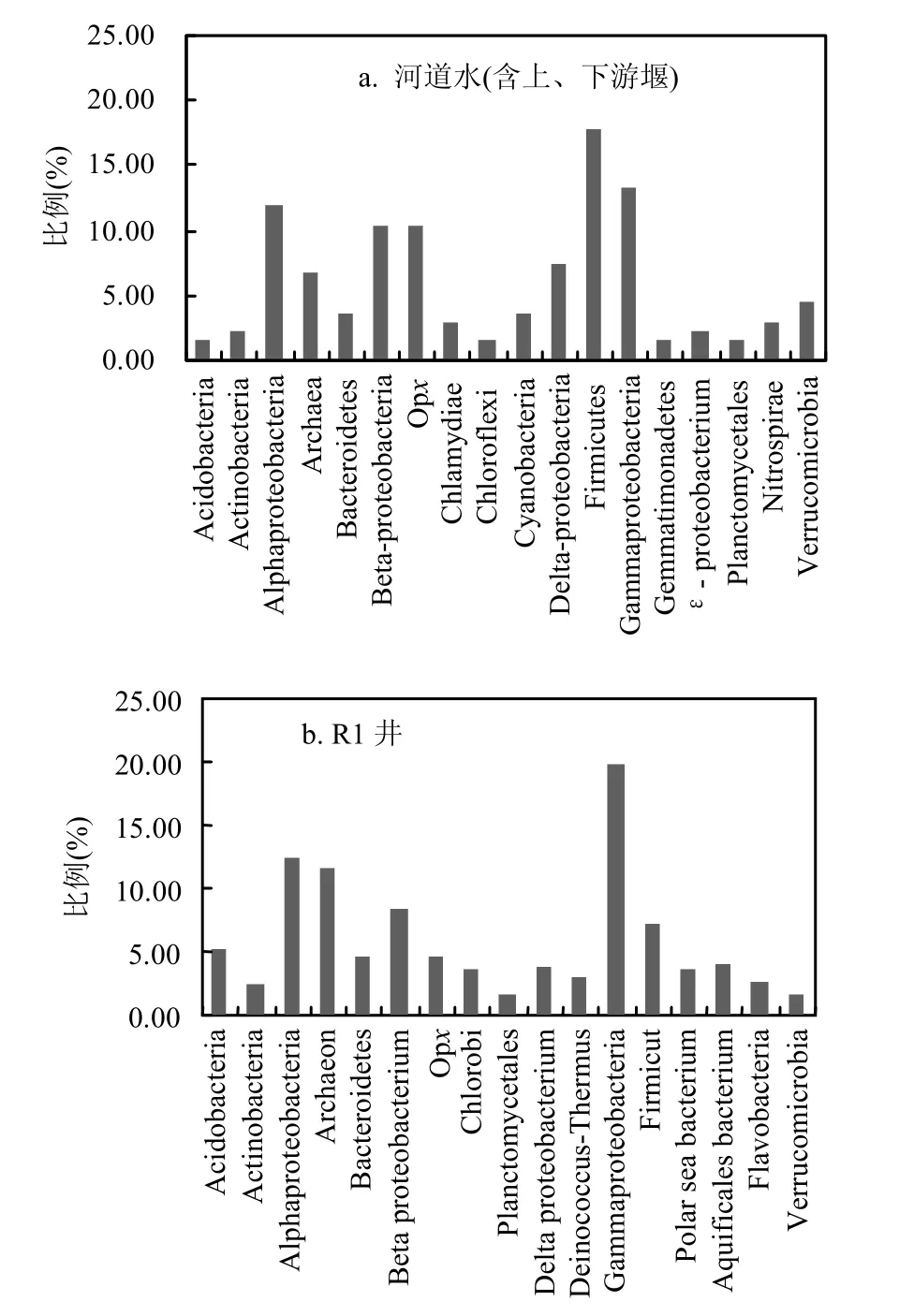
图5 R1井地下水与河道水主要微生物种群Fig.5 Microbial communities of analyzed clones from R1 and surface water samples
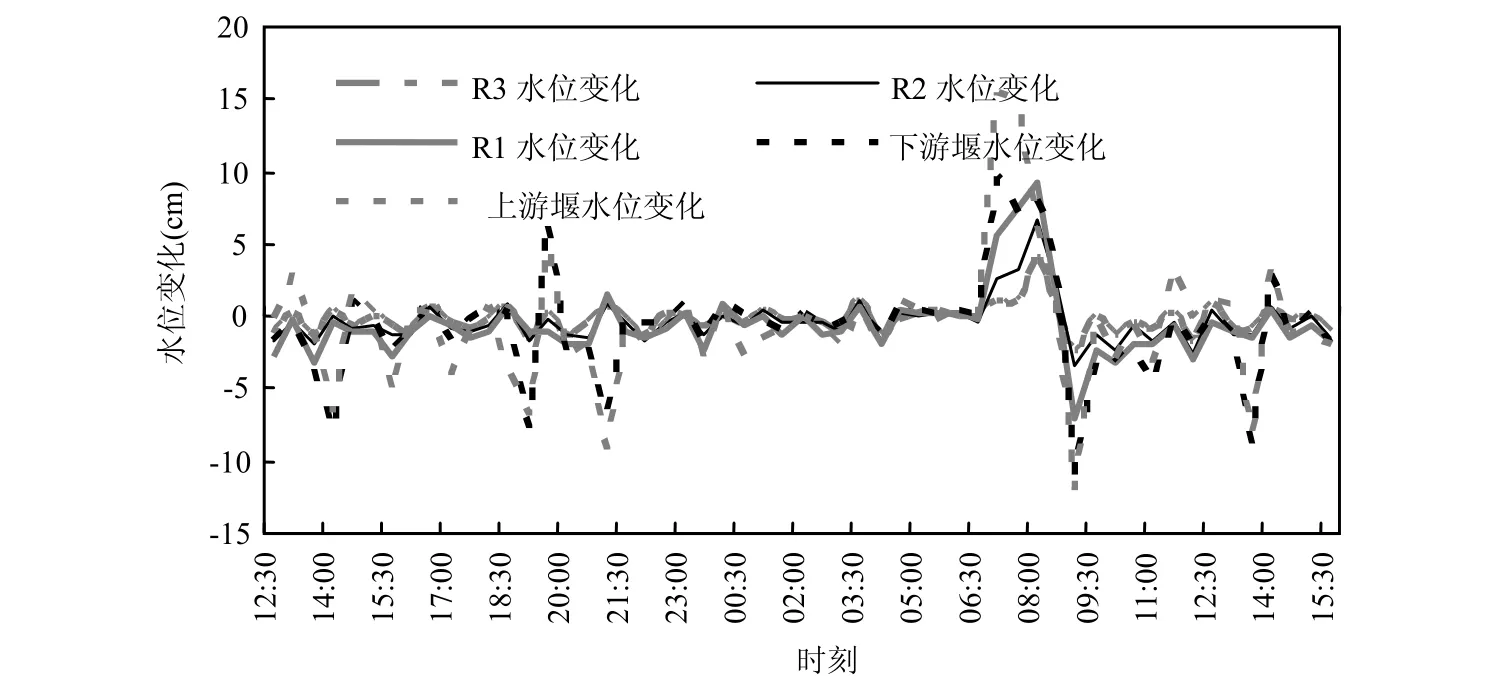
图6 地表水与地下水采样点水位变化比较Fig.6 The comparing of water-level fluctuations between river water and groundwater
2.2.2 化学离子成因 地表地下水的微生物组 成、结构差异也表现与周边环境的化学离子组成相适应,例如,硝化螺旋菌(Nitrospirae)在R2和R3井地下水中有,而在 R1井水中没有检测出,硝化螺旋菌对氮的硝化和亚硝酸盐氧化起作用[27].原先R井所在位置有工人居住,受鸡、鸭、羊等排泄物污染,但自 2009年始,中山大学珠海校区美化清洁校园环境,将果园的居民迁出,R井附近基本保持自然生态环境,最浅层井 R1由雨水和周边地表水入渗补给后原污染物已慢慢稀释和降解,R2和R3井为基岩裂隙水,原先鸡、鸭等排泄污染物尚存留于基岩风化壳层中,因此,随着周边环境的日益变化,微生物组成、结构不断地改变.
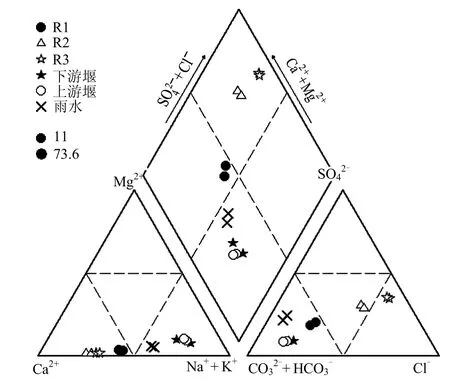
图7 研究区地表水和地下水主要化学离子Piper图Fig.7 Piper diagram for river water and groundwater in the Zhuhai Campus catchment
试验流域基岩由单一的黑云母花岗岩组成,径流的化学组成属于Sidiss-Na+-HCO3−-Cl−型,以溶解Si、Na+、HCO3−和Cl-为主要成分,Ca2+、SO42−则变异系数较大[28],微生物种群中有少量硫酸盐还原菌(sulfate-reducing bacterium)存在.在补给区R井组,地下水径流条件较好,地下水在含水层中停留时间短,水交替迅速,含水层中易溶组分如Cl-、SO42-、Na+、K+等不断被淋滤并由地下径流带走,离子以 Ca2+、HCO3-占优势,形成低矿化度的Ca2+- Na+-HCO3--Cl−型地下水,R井组地下水检 测 出 属 于 γ-proteobacteria 的 海 杆 菌(Marinobacter)和属于β-proteobacteria的脱氯单胞菌属(Dechloromonas),说明 R井组地下水有Na+、Cl−等离子循环.高全洲等[29]研究表明,珠江三角洲滨海地区自然化学风化、海盐沉降和人类活动对径流化学组成有近于相等的贡献水平,此外,自然化学风化过程所产生的 HCO3-离子响应洪水的稀释效应,海盐沉降通量也响应径流的稀释效应.从主要化学离子Piper图(图7)也可以看出,雨季尤其是暴雨时上下游河道水的离子成分更接近雨水,稀释效应显著.尽管如此,河道水与井水中的优势微生物种群一致性较高,不受这种稀释效应影响,此特征表明可从微生物角度辨识地下水/地表水的相互作用.本次水样中自然化学风化和海盐沉降的贡献份额都相对减小,酸沉降的贡献稍有增加,如现场测定的 pH值偏弱酸性(表1),这在微生物组成、结构中也有所反映,表现在本次测序的微生物种群中酸杆菌(Acidobacteria,大多由嗜酸菌组成)均有存在,尤其是在R1井中已达到了优势种群水平.
3 结论
3.1 微生物组成结构方面,浅层潜水与地表非饱和带(土壤)联系密切,受地表水(河道)与雨水补给,一般为氧化环境,其中的微生物组成结构与下游河道水相似,表现为 Firmicutes为最优势种群,其他如,α, β, γ-proteobacteria、Archaea等也与下游河道水基本类同;处于花岗岩破碎带的基岩裂隙水,其略带承压的含水层为主要联系通道与上游河道水交互,相应的微生物组成结构与河道水有较大的相似性,表现为 Archaea为最优势种群,其余的优势种群如β-proteobacteria,Candidate division OPx,Firmicutes,δ-proteobacteria等,也与上游堰基本相同,且微生物多样性指数和稀释曲线也较为接近;处于裂隙发育但破碎层较少的基岩裂隙水,其承压含水层受补给源控制水量不够丰足,地下水位比较平稳,处于还原环境,各种芽孢杆菌占绝对优势,而其他微生物种群较少.
3.2 受水文地质和化学离子等综合影响,酸杆菌在浅层潜水中表现为优势菌,蓝细菌仅在花岗岩破碎带的基岩裂隙水和河道水中系统发育同源性相近,硝化与反硝化菌主要在基岩裂隙水中存在,这些差异的存在表明在每个独特地质构造的含水层中,地下水与地表水的交互程度不同,微生物的组成结构随不同地理时空的物理化学差异而变化并且适应.
[1] VanderVelde Y, deRooij G H, Torfs P J J F. Catchment-scale non-linear groundwater-surface water interactions in densely drained lowland catchments [J]. Hydrology and Earth System Sicence, 2009,13(10):1867-1885.
[2] Bailly-Comte V, Jourde H, Pistre S. Conceptualization and classification of groundwater -surface water hydrodynamic interactions in karst watersheds: Case of the karst watershed of the Coulazou River (Southern France) [J]. Journal of Hydrology, 2009,376:456-462.
[3] 滕彦国,左 锐,王金生,等.区域地下水演化的地球化学研究进展 [J]. 水科学进展, 2010,21(1):127-135.
[4] Vidal J P, Wade S D. Multimodel projections of catchment-scale precipitation regime [J]. Journal of Hydrology, 2008,353: 143-158.
[5] Schellekens J. The interception and runoff generating processes in the bisley catchment, luquillo experimental forest, Puerto Rico [J]. Physics and Chemistry of the Earth, 2000,25(13):659-664.
[6] Zhang Y Q, Chiew F H S, Zhang L, et al. Estimating catchment evaporation and runoff using MODIS leaf area index and the Penman–Monteith Equation [J]. Water Resources Research, DOI: 10.1029/2007WR006563.
[7] Yimer F, Messing I, Ledin S, et al. Effects of different land use types on infiltration capacity in a catchment in the highlands of Ethiopia [J]. Soil Use and Management, 2008,24(4):344-349.
[8] Fukada T, Hiscock K M, Dennis P F, et al. A dual isotope approach to identify denitrification in groundwater at a river-bank infiltration site[J]. Water Research, 2003,37:3070-3078.
[9] Willhelm S R, Schiff S L, Robertson W D. Biochemical evolution of domestic waste water in septic systems: 2.Application of conceptual model in sandy aquifers [J]. Ground Water, 1996,34: 853-864.
[10] 秦大军.地下水CFC定年方法及应用 [J]. 地下水, 2005,27(6): 435-437.
[11] 李昊翔.螺旋藻对重金属的耐受性和吸附研究 [D]. 杭州:浙江大学, 2005.
[12] 滕彦国,左 锐,王金生.地表水-地下水的交错带及其生态功能[J]. 地球与环境, 2007,35(1):1-8.
[13] 孙 涛.新编华南花岗岩分布图及其说明 [J]. 地质通报, 2006,25(3):332-335.
[14] 黄小兰,陈建耀,周世宁,等.珠海市海-陆交错带水环境原核生物多样性 [J]. 应用生态学报, 2010,21(2):452-457.
[15] 黄小兰,陈建耀,谢丽纯,等.小流域地下水流微生物空间差异分析[J].环境科学,2010,31(10): 2299-2304.
[16] 肖 凯,曹理想,陆勇军,等.广东省金山温泉沉积物微生物多样性初步分析 [J]. 微生物学报, 2008,48(6):717-724.
[17] David M W, Michael J F, Stephen C N, et al. natural view of microbial biodiversity within hot spring cyanbacterial mat communities [J]. Microbiol. Mol. Biol. Rev., 1998,62:1353-1370.
[18] Godon J J, Zumstein E, Dahert P, et al. Molecular microbial diversity of an anaerobic digestor as determined by small-subunit rDNA sequence analysis [J]. Appl. Environ. Microbiol., 1997, 63:2802-2813.
[19] Nakamura Y, Kaneko T, Sato S, et a1. Complete genome structure of the thermophilic cyanobacteria Therraosynechococcuselongatus BP-1(Supplement) [J]. DNA Res., 2002,93(4):135-148.
[20] Huang X L, Chen J Y, Zhou S N, et al. Vertical microbiological variation of a coastal aquifer in southern China [J]. Water Science and Technology, 2012,65(4):703-712.
[21] 关统伟,吴晋元,职晓阳,等.硝尔库勒湖沉积物中非培养放线菌多样性 [J]. 微生物学报, 2008,48(7):851-856.
[22] Lin L H, Wang P L, Douglas R, et al. Long-term sustain ability of a high-energy, low-diversity crustal biome [J]. Science, 2006,314(5798):479-482.
[23] 李 鹏,李志会,金琳琳,等.山东肥城寒武纪竹叶状石灰岩菌群分析 [J]. 中国微生态学杂志, 2009,21(8):721-726.
[24] 曾松青,陈建耀,付丛生.同位素在小流域基流计算中的应用研究 [J]. 水文, 2010,30(2):20-24.
[25] 付丛生,陈建耀,曾松青,等.滨海地区潮汐对地下水位变化影响的统计学分析 [J]. 水利学报, 2008,39(12):1365-1376.
[26] Katsuyama M, Ohte N, Kabeya N. Effects of bedrock permeability on hillslope and riparian groundwater dynamics in a weathered granite catchment [J]. Water Resources Research, 2005, DOI: 10.1029/2004WR003275.
[27] 黄小兰,陈建耀.微生物应用于污水污泥处理的研究 [J]. 亚热带资源与环境学报, 2010,5(1):48-55.
[28] 赵新锋.城市化地下水环境效应研究 [D]. 广州:中山大学, 2008.
[29] 高全洲,陶贞.华南滨海花岗岩丘陵的化学风化与化学径流 [J].中国科学D辑:地球科学, 2010,40(6):758-767.
Cause on the differences of microorganism between small watershed surface water and underground water.
HUANG Xiao-lan1,2, CHEN Jian-yao2*, ZHOU Shi-ning3, XIE Li-chun2, YANG Xue-yun2, JIANG Hua-bo2, DONG Lin-yao2(1.Key Laboratory of Poyang Lake Wetland and Watershed Research, Ministry of Education, School of Geography and Environment, Jiangxi Normal University, Nanchang 330022, China;2.School of Geography and Planning, Sun Yat-sen University, Guangzhou 510275, China;3.School of Life Sciences, Sun Yat-sen University, Guangzhou 510275, China). China Environmental Science, 2012,32(9):1647~1654
The surface and underground water of Sun Yat-sen University water cycle experiment base was sampled and analyzed by 16S rRNA gene analytical methods to acquire the data of microorganism communities’ distribution, then, the rarefaction curves and richness/diversity estimators were calculated and compared by Mothur software. Microbiological communities in groundwater were similar to those in surface water , with the predominant group of Proteobacterium, Firmicutes, Uncultured Archaeon(uncultured Crenarchaeote and Euryarchaeote). Proteobacteria made up 29.7%、30.3%、28.1%、20.9%、14.2% of the microbial communities from Shangyouyan, Xiayouyan, R1, R2, R3 , respectively. The same samples from Shangyouyan, Xiayouyan, R1, R2, R3 also consisted of 9.7%、20.3%、19.8%、8.6%、39.6% Firmicutes and 14.2%、12.3%、11.7%、12.1%、3.5% Archaea, respectively. On the other hand, the data of richness and diversity estimators such as Chao1, Ace, Shannon, and Simpson indicated that microorganism diversities were different in groundwater and surface water, which showed the difference among those microorganism’s characteristics. The study concluded that microorganism evolves in response to the change of the hydrogeological and ionic conditions that are influenced by the water environment and the recharging of water resources.
small watershed;groundwater;surface water;microorganism;difference;cause
2012-02-09
国家“973”项目(2012CB417003);广东省自然科学基金项目(9251027501000021);江西省教育厅科技项目(GJJ12186);广东水利科技创新与推广项目(2009-2011);江西省博士后科研项目择优资助(2012)
* 责任作者, 教授, chenjyao@mail.sysu.edu.cn
X172
A
1000-6923(2012)09-1647-08
黄小兰(1968-),女,江西赣州人,副研究员,博士, 主要研究方向为城市化水环境效应.发表论文20余篇.
