cAMP 依赖蛋白激酶(PKA)磷酸化Nef 蛋白对HIV 复制的影响
2012-12-23李培林
李培林
(1. 哈佛大学 医学院医学系, 波士顿 MA 02115; 2. 加州大学旧金山分校 医学院医学系, 旧金山 CA 94121)
Nef 蛋白是人类免疫缺陷病毒(HIV)中一个全长27~35 ku 的辅助蛋白, 与提高病毒载量和病情恶化有关, 在病毒生命周期的早期阶段表达, 需要经过磷酸化和豆蔻酰化才能成熟[1]。 在体外, Nef 蛋白能够增强HIV 在未刺激的外周血单核细胞(PBMC)和CD4+T 细胞中的复制[2-3], 有向下调节细胞表面分子表达的功能,如CD4 主要组织相容性复合体 (MHC)I, 趋化因子受体4 型(CXCR-4), 和CC 趋化因子受体5 型等分子[4-6]。Nef 蛋白和宿主的细胞蛋白之间有很多相互作用, Nef 蛋白和酪氨酸以及丝氨酸蛋白激酶家族成员的相互作用, 能够改变细胞的信号转导通路和提高病毒的复制[7-9]。
研究表明, 丝氨酸蛋白激酶磷酸化Nef 蛋白有助于调节Nef 蛋白的功能。 丝氨酸激酶磷酸化胺基端的Nef 能够影响病毒的传染性, 蛋白激酶C(PKC)是一个丝氨酸家族蛋白激酶, 磷酸化Nef蛋白能够增强其下调CD4 的功能[10-11]。PKA 是一个关键的丝氨酸蛋白激酶, 参与环磷酸腺苷(cAMP) 的信号转导通路, 参与调节T 细胞的功能[12]。 增加PKA 活性可以提高HIV 转录和病毒的复制[13-15]。 此外, HIV 阳性患者的T 细胞中cAMP/PKA 活性有显著增加, T 细胞功能受损。降低细胞内PKA 的活性可以恢复HIV 阳性患者的T 细胞功能[16-17]。 C. Cartier 等[18]研究表明PKA和HIV 之间的有明显的联系, 在一个病毒单周期的实验中, 表明PKA 被HIV 纳入了病毒内, 对HIV 的传染性和复制有重要的作用。
到目前为止, 有间接证据表明, PKA 涉及HIV 的转录和复制。 较早的研究[11]表明, PKA 对Nef 的磷酸化没有影响, 主要是因为使用了佛波醇酯(PMA), 一个PKC 的刺激物。 根据PKA 磷酸化生理底物的的共识网站[12], 笔者发现在Nef蛋白9 号位置上的丝氨酸可能是PKA 磷酸化的位点。 笔者用这个信息来研究PKA 磷酸化Nef 蛋白对病毒复制的影响。 结果表明突变Nef 蛋白9号位置上丝氨酸PKA 磷酸化的位点, 可以影响静态原代细胞中的HIV 复制。
1 材料和方法
1.1 Nef 区域内的定点突变
采用QuikChange 定向突变试剂盒(Stratagene公司), 根据制造商说明试验, 笔者设计了一个HIV 全长(HIVNL4-3)的突变体: 只是把Nef 中9 号位置上的丝氨酸(Ser9)突变为丙氨酸, 其他的HIV 基因保持和野生型的一样(HIV S9A)。
1.2 Nef 蛋白的表达
用pcDNA6/myc-His/B 含有野生型(HIVNL4-3)的Nef 的质粒, 单突变的Nef(S9A)的质粒, 或者空载体的质粒, 使用磷酸钙哺乳动物转染系统(Promega 公司) 去转染293T 细胞。 在转染72 h后, 去掉上清液, 用磷酸盐缓冲液漂洗细胞一次, 用4 %的甲醛固定细胞, 用含有1 % Triton X-100 的磷酸盐缓冲液漂洗细胞,然后在含有1%牛血清白蛋白和含有抗HIV Nef 单克隆抗体的磷酸盐缓冲液4 ℃孵育过夜。 最后用羊抗鼠的IgG耦联的辣根过氧化物酶 (HRP)(BIO-RAD 公司)和FAT DAB 片剂(Sigma 公司)显示结果。
1.3 生产HIV
1) 生产HIV 用50 μg 的HIV 野生型的质粒, 或者是50 μg 有Nef(Ser9)单一的突变HIV的质粒, 使用磷酸钙哺乳动物转染系统(Promega公司)去转染293T 细胞。
2) 生产Nef 蛋白被打包进Nef 删除的HIV。用50 μg 的Nef 被删除的HIV 的质粒(HIVΔNef)和100 μg Nef 表达的质粒一起使用磷酸钙哺乳动物转染系统(Promega 公司)转染293T 细胞。
在转染后72 h, 收获上清液, 通过22-μm孔的过滤器 (Millipore 公司), 用P24 抗原捕获(Beckman Coulter 公司)方法去标准化。
1.4 病毒感染和复制检测
1.4.1 病毒感染检测 用一种对HIV 感染很敏感的TZM-BL 细胞来做病毒感染检测, 检查打包了不同Nef 蛋白Nef 删除 (HIVΔNef) 的HIV病毒。 用3 倍稀释的方法去感染细胞, 用含有40 μg/mL 的DEAE-葡聚糖(Sigma 公司)的培养基, 在96 孔板中进行。 在37 ℃,5%CO2的孵化箱中孵育6 h, 加入病毒融合抑制剂T-20(AnaSpec 公司) 2 μg/mL。 继续孵化48 h, 每孔加入100 μL 的光明GLO 荧光素酶检测系统(Promega 公司) 测量荧光素酶的活性, 用Wallac Victor2 1420 多标记计数器 (Perkin-Elmer 公司)去读取荧光素酶活性。 所有的病毒感染检测, 一式3 份。
1.4.2 病毒复制检测 外周血单核细胞(PBMC)用Ficoll 密度梯度离心的方法从匿名捐献者血液中提取。 静息外周血单核细胞暴露在病毒3 h后, 用完全培养基(RPMI 1640 培养液与10 %胎牛血清, 100 U/mL 青霉素, 100 μg/mL 链霉素,2 mM 谷氨酰胺)洗净3 次, 然后悬浮在新鲜的完全培养基中, 培养在37 ℃,5%CO2的孵化箱中,在感染4 d 后, 用植物血凝素 (PHA, 3 μg/mL)(Sigma 公司)和5 U 的重组白细胞介素-2(rIL-2)(Roche 公司)去刺激PBMC 1 d。 然后把细胞放在新鲜的含有5 U 的重组白细胞介素-2 (rIL-2)培养基里培养。 定期收集上清液和更换新鲜培养基, 并测定P24 Gag 蛋白水平。 所有的病毒复制试验, 一式3 份。
1.5 统计分析
t 检验进行数据分析, 使用Bonferroni 多重比较校正后的表示。
2 结果
由于Nef 的重要职能之一是加强病毒的复制性[19-20], 为了检测Nef 中9 号位置上的丝氨酸(Ser9)PKA 磷酸化位点对病毒复制的影响。 用全长的野生型病毒的DNA (HIVNL4-3), 使用定点突变方法, 笔者构建了一个只有在Nef 有变异的HIV 变种, 是一个含有单个PKA 磷酸化位点(Ser9)的基因突变型(HIV-S9A), 这个HIV 变异用DNA 测序证实, 该突变HIV 只是将Nef 9 位置(Ser9)上的丝氨酸改变为丙氨酸, 没有其他的病毒基因改变。 作为一个Nef 阴性对照, 使用一个Nef 删除的HIV 克隆[3]。 然后, 用野生型或突变型的病毒质粒转染293T 细胞产生病毒, 3 d 后收获上清液, 用P24 测定标准化。 当用等效剂量的HIV 去感染被刺激后的人外周血单核细胞时,无论是野生型HIV (HIVNL4-3), 还是HIV S9A单突变型 (HIV-S9A), 对HIV 的复制都没有影响。 这个结果表明Nef 的突变对刺激后外周血单核细胞中HIV 复制没有影响(见图1)。

图1 HIV 感染刺激后的PBMC
图1 表明, 相比野生型的HIV 病毒, Nef 蛋白的一个PKA 磷酸化位点的突变不减少病毒的复制。 P24 的差异无统计学意义。
根据其他研究[1-3], 一般Nef 对病毒复制的增强功能是在病毒感染没有被刺激的人外周血单核细胞时观察到的。 因此, 笔者以P24 为标准用相同剂量的病毒, 包括野生型或Nef 突变型, 去感染没有被刺激的人外周血单核细胞, 4 d 后再刺激细胞, 在感染第10 天检查HIV 的复制, 和野生型HIV (HIVNL4-3) 相比较, Nef 突变病毒S9AHIV (HIV-S9A), 以及Nef 删除的HIV(HIVΔNef)复制的水平显著降低, (P <0.03, P <0.01, P <0.01), 同时, Nef 突变病毒S9AHIV(S9A)和Nef 删除HIV(HIVΔNef)之间的复制水平差异有统计学意义(P <0.01)(见图2)。 该结果表明, Nef 中9 号位置上的丝氨酸对静态原代细胞中病毒的复制有关键作用, 但是9 号位置以外的区域对病毒复制也有影响。
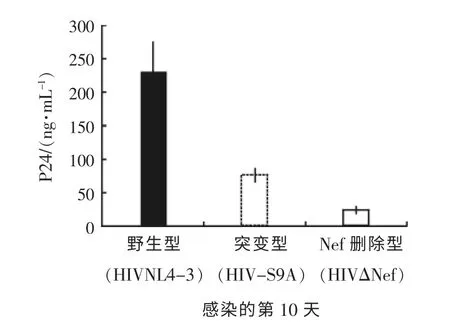
图2 HIV 感染没有刺激的PBMC
由图2 可知, 相比野生型的HIV 病毒来看,Nef 蛋白的一个PKA 磷酸化位点的突变可以减少病毒的复制。 感染后第10 天的病毒产生:包括野生型(HIVNL4-3, 实心柱), 单突变型(HIV-S9A,空心柱虚线), 或Nef 删除型 (HIVΔNef, 空心柱实线)。 用检测P24 释放到上清的方法测定病毒的复制。 结果显示了从3 个不同的捐助者, 3 次独立的外周血单核细胞感染后生产的P24。 单突变型(HIV-S9A)和Nef 删除型(HIVΔNef)病毒产量显著下降, 和野生型HIV 比较差异有统计学意义(P <0.01), 另外单突变型(HIV-S9A)和Nef删除型(HIVΔNef)之间的病毒产量差异也有统计学意义(P <0.01)。
为了进一步确定病毒输出的减少是由于去除掉了Nef 的PKA 磷酸化位点, 笔者直接研究这些Nef 突变对病毒复制的影响, 使用Nef 删除HIV 和Nef 蛋白质进行重组。 有实验表明, 使用Nef 删除HIV 的DNA 或野生型HIV 的DNA 产生的病毒[2-3], 去感染没有被刺激的人外周血单核细胞, Nef 删除HIV 的复制和野生型HIV 相比有明显的下降, 但是如果给Nef 删除的HIV 补充Nef 蛋白, 可以纠正这种下降, 使病毒的复制恢复到野生型HIV 复制的水平。 在这种情况下,Nef 是打包在病毒装配的病毒颗粒里, 但是病毒在复制第一个周期以后没有进一步产生Nef 的能力[1,19-21]。 笔者用共同表达的方式, 用Nef 删除HIV 的DNA、 野生型或者是Nef 基因突变型的DNA, 去转染293T 细胞, 将生产的Nef 蛋白打包进Nef 删除的HIV 病毒颗粒里, 病毒没有自己产生Nef 的能力。 转染细胞后, 收集共同表达的上清液, 分下面几种情况: 删除Nef HIV 的DNA, ①和野生型的Nef 基因 (HIVΔNef+Nef),②和单突变的Nef 基因(HIVΔNef+Nef 的S9A),③和空的载体(HIVΔNef+vector), 病毒的产生用测量P24 的产生量进行。 Nef 蛋白的表达, 用免疫细胞化学方法检查, 结果表明野生型的Nef 蛋白和单突变的Nef 蛋白表达水平在293T 细胞里是基本相等的, 但是空的载体没有蛋白表达 (见图3)。
下一步, 用等效的P24 剂量去感染没有被刺激的人外周血单核细胞, 用的病毒是HIVΔNef+Nef, HIVΔNef+NefS9A, 或HIVΔNef+vector。 这是与Nef 有关的单周期病毒感染检测。
病毒复制结果显示, 病毒含有单突变的Nef(HIVΔNef +NefS9A) 和病毒含有野生型Nef(HIVΔNef+Nef) 相比较, 病毒的复制率明显降低(P <0.001, 用Bonferroni 校正后)(见图4)。 用3 个不同的捐助者的人外周血单核细胞检测获得了相同的结果。

图3 Nef 蛋白的表达
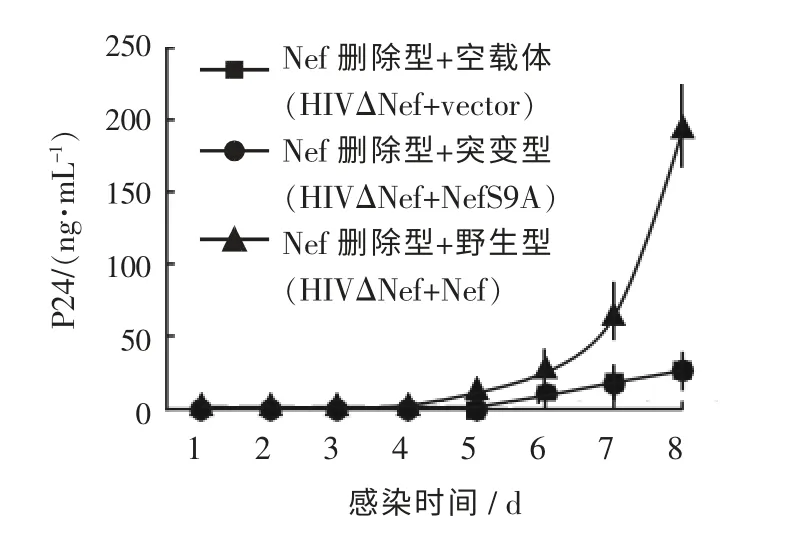
图4 Nef 的单周期的病毒复制检测
图4 表明, 用Nef 的单周期病毒感染检测方法表明磷酸化位点被突变的Nef 蛋白降低了HIV的复制。 含有空载体的Nef 删除HIV(HIVΔNef+vector, 带方型的线), 和含有单突变Nef 蛋白(Nef S9A)的Nef 删除HIV(HIVΔNef+NefS9A, 带圆圈的线)减少了病毒的复制, 与含有野生型Nef蛋白的Nef 删除HIV (HIV Nef+Nef, 带三角的线) 比较, 差异有统计学意义 (P <0.001, 经过Bonferroni 校正)。
由于病毒含有单突变的Nef (HIVΔNef +NefS9A) 蛋白的复制水平和病毒不含有Nef 蛋白的复制显示相同的降低级别, 笔者认为, 把Nef 9 号位置 (Ser9) 上的丝氨酸改变成为丙氨酸(Ala9)的单点突变足以废除Nef 增强在未刺激的原代细胞中对病毒复制的作用。
为了进一步研究Nef 突变使病毒复制下降是由于病毒感染性的变化, 用了一个单周期的病毒感染检测。 笔者采用TZM-BL 细胞, 这是一个对HIV 感染高度敏感的细胞株[22]。 经过6 h 病毒和细胞接触后, 加入了病毒融合抑制剂T20 到细胞上防止病毒进一步感染。 因此, 这个试验提供了单周期的病毒感染检测, 采用了同样的病毒和病毒所含有各种Nef 蛋白。
笔者观察到, 病毒含有不同的Nef 蛋白对病毒的感染没有明显的影响, 无论是病毒含有野生型Nef 蛋白(HIVΔNef+Nef)、 病毒含有单突变的Nef 蛋白(HIVΔNef+NefS9A)或是病毒含有空的载体(HIVΔNef+vector)(见图5)。
在感染48 h 后, 测量荧光素酶的活性。 图5表明, 含有野生型Nef 蛋白的Nef 删除HIV(HIVΔNef+Nef) 的感染率、 含有空载体的Nef 删除HIV(HIVΔNef+vector)的感染率和含有单突变Nef 蛋白的Nef 删除HIV(HIVΔNef+NefS9A)的感染率基本相同, 差异没有统计意义。 该研究结果表明病毒含有突变Nef 蛋白的减少病毒效应在未刺激原代细胞中的产生是因为突变的Nef 蛋白对病毒复制的影响, 而不是对病毒传染性的影响。

图5 单周期的病毒感染检测
3 讨论
笔者观察到, 当只改变Nef 中Ser9 位点时,会明显降低Nef 增强未刺激的原代细胞中病毒复制的作用。 这个特殊现象在一个单周期的病毒检测中, 通过将野生型或突变Nef 蛋白打包在病毒颗粒里的研究得到了证实。 因此, 可以确定蛋白激酶PKA 导致的Nef Ser9 位点的磷酸化, 对Nef蛋白增强未刺激的原代细胞中HIV 复制有重要作用。 由于Nef 蛋白Ser9 点突变对病毒复制有较大影响, 笔者推测, Nef 的蛋白激酶PKA 的磷酸化是在细胞中病毒生命周期的重要一步。
HIV Nef(S9)的蛋白激酶PKA 的磷酸化位点是很保守的, 笔者通过HIV 基因银行(http:/ /www.ncbi.nlm.nih.gov/entrez)审查HIV 的M、N 和O 组序列, 其中M 组包括分支A、B、C、D、F 株和HIV 重组菌株A/D、 A/G, 发现至少有2 530种不同的Nef 序列, 其中约有76.5 %的HIV 的Nef 基因含有该位点。 此外, 有HIV DNA 序列的研究[23]指出在186 个HIV(HIV-1)中Nef(S9)有80 %的保守率。 综合这些结果显示, Nef(S9)蛋白激酶PKA 磷酸化位点可能是HIV Nef 重要的功能部位。 蛋白激酶PKA 和Nef 都有肉豆蔻酸侧链嵌入细胞膜的脂筏中[24-27]。 脂筏是一个专门的微区域, 其高度富集胆固醇和鞘脂, 存在于细胞膜上, 是T 细胞信号传递和关键分子在细胞膜聚集的地方[28], HIV 病毒颗粒从被感染的细胞释放也是从脂筏产生的[29]。 HIV 的Nef 蛋白被蛋白激酶PKA 的磷酸化可能发生在脂筏中, 可能是在病毒颗粒装配时, 也可能是在病毒入侵时。 总之,蛋白激酶PKA 和HIV Nef 蛋白的相互作用, 为研究HIV 感染的预防和治疗提供了一个新方向。
[1] Wu Y T, Marsh J W. Selective transcription and modulation of resting T cell activity by preintegrated HIV DNA[J]. Science,2001,293(5534):1503-1506.
[2] Miller M D, Warmerdam M T, Gaston I, et al. The human immunodeficiency virus-1 nef gene product: a positive factor for viral infection and replication in primary lymphocytes and macrophages[J]. J Exp Med,1994,179(1):101-113.
[3] Spina C A, Kwoh T J, Chowers M Y, et al. The importance of nef in the induction of human immunodeficiency virus type 1 replication from primary quiescent CD4 lymphocytes[J]. J Exp Med, 1994,179:115-123.
[4] Garcia J V, Miller A D. Serine phosphorylation-independent downregulation of cell-surface CD4 by Nef[J].Nature,1991, 350(6318):508–511.
[5] Schwartz O, Marechal V, Le Gall S, et al. Endocytosis of major histocompatibility complex class I molecules is induced by the HIV-1 Nef protein[J].Nat Med,1996,2(3):338-342.
[6] Sloan R D, Donahue D A, Kuhl B D, et al. Expression of Nef from unintegrated HIV-1 DNA downregulates cell surface CXCR4 and CCR5 on T-lymphocytes[J]. Retrovirology, 2010, 7:44.
[7] Fackler O T, Baur A S. Live and let die: Nef functions beyond HIV replication [J]. Immunity, 2002,16(4):493-497.
[8] Geyer M, Fackler O T, Peterlin B M. Structure-function relationships in HIV-1 Nef[J]. EMBO Rep,2001,2(7):580-585.
[9] Renkema G H, Saksela K. Interactions of HIV-1 Nef with cellular signal transducing proteins[J]. Front Biosci,2000,5:D268-D283.
[10] Baur A S, Sass G, Laffert B, et al. The N-terminus of Nef from HIV-1/SIV associates with a protein complex containing Lck and a serine kinase [J]. Immunity,1997,6(3):283-291.
[11] Luo T, Downing J R, Garcia J V. Induction of phosphorylation of human immunodeficiency virus type 1 Nef and enhancement of CD4 downregulation by phorbol myristate acetate[J]. J Virol,1997,71:2535-2539.
[12] Shabb J B. Physiological substrates of cAMP-dependent protein kinase [J]. Chem Rev,2001,101:2381-2412.
[13] Kagnoff M F, Roebuck K A. Human immunodeficiency virus type 1 (HIV-1) infection and expression in intestinal epithelial cells: role of protein kinase A and C pathways in HIV-1 transcription [J]. J Infect Dis,1999,179(Supplement 3):S444–S447.
[14] Rabbi M F, Al-Harthi L, Saifuddin M, et al. The cAMP-dependent protein kinase A and protein kinase C-beta pathways synergistically interact to activate HIV-1 transcription in latently infected cells of monocyte/macrophage lineage[J]. Virology,1998,245:257-269.
[15] Nokta M A, Pollard R B. Human immunodeficiency virus replication: modulation by cellular levels of cAMP[J]. AIDS Res Hum Retroviruses,1992,8:1255-1261.
[16] Aandahl E M, Aukrust P, Skalhegg B S, et al. Protein kinase A type I antagonist restores immune responses of T cells from HIV-infected patients [J]. FASEB J,1998,12:855-862.
[17] Hofmann B, Nishanian P, Nguyen T, et al. Restoration of T-cell function in HIV infection by reduction of intracellular cAMP levels with adenosine analogues[J]. AIDS,1993,7: 659-664.
[18] Cartier C, Hemonnot B, Gay B, et al. Active cAMPdependent protein kinase incorporated within highly purified HIV-1 particles is required for viral infectivity and interacts with viral capsid protein [J]. J Biol Chem,2003, 278: 35211-35219.
[19] Aiken C, Trono D. Nef stimulates human immunodeficiency virus type 1 proviral DNA synthesis[J]. J Virol,1995,69:5048-5056.
[20] Schwartz O, Marechal V, Danos O, et al. Human immunodeficiency virus type 1 Nef increases the efficiency of reverse transcription in the infected cell [J]. J Virol,1995,69:4053-4059.
[21] Miller M D, Warmerdam M T, Page K A, et al. Expression of the human immunodeficiency virus type 1(HIV-1) nef gene during HIV-1 production increases progeny particle infectivity independently of gp160 or viral entry [J]. J Virol, 1995,69:579-584.
[22] Wei X,Decker J M,Liu H,et al. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy [J].Antimicrob Agents Chemother,2002,46: 1896-1905.
[23] Geyer M, Peterlin B M. Domain assembly, surface accessibility and sequence conservation in full length HIV-1 Nef [J]. FEBS Lett, 2001,496:91-95.
[24] Skalhegg B S, Tasken K, Hansson V, et al. Location of cAMP-dependent protein kinase type I with the TCR-CD3 complex [J]. Science,1994, 263:84-87.
[25] Wang J K, Kiyokawa E, Verdin E, et al. The Nef protein of HIV-1 associates with rafts and primes T cells for activation[J].Proc Natl Acad Sci USA,2000,97:394-399.
[26] Zheng Y H, Plemenitas A, Linnemann T, et al. Nef increases infectivity of HIV via lipid rafts [J]. Curr Biol, 2001,11:875-879.
[27] Resh M D. Fatty acylation of proteins: new insights into membrane targeting of myristoylated and palmitoylated proteins [J]. Biochim Biophys Acta,1999,1451:1-16.
[28] Manes S, del Real G, Martinez-A C. Pathogens: raft hijackers[J]. Nat Rev Immunol,2003,3:557-568.
[29] Nguyen D H, Hildreth J E. Evidence for budding of human immunodeficiency virus type 1 selectively from glycolipid-enriched membrane lipid rafts[J]. J Virol,2000,74:3264-3272.
