慢性吗啡依赖大鼠条件性位置厌恶模型脑腹侧被盖区蛋白激酶A 的表达变化*
2012-12-23宋秀花李文强张景丹张瑞岭石玉中
李 毅, 宋秀花, 李文强, 张景丹, 张瑞岭, 石玉中△, 郝 伟
1 华中科技大学同济医学院附属精神卫生中心(武汉市精神卫生中心),武汉 430022
2 新乡医学院第二附属医院,河南省生物精神病学重点实验室,新乡 453002
3 中南大学湘雅二院精神卫生研究所,长沙 410011
毒品成瘾是一种慢性复发性脑病[1-2],吸毒者体内存在“吸毒→成瘾→戒断所致厌恶动机→再吸毒(复吸)”循环[3-4],戒断所导致的厌恶动机是这条复吸通路的重要“源头”,可作为阻断复吸通路的重要“靶点”。条件性位置厌恶(conditioned place aversion,CPA)试验动物模型被广泛用于急、慢性阿片成瘾戒断所致的厌恶性动机的生物学机制研究,该模型敏感、成熟[5-6]。蛋白激酶A(protein kinase A,PKA)是第二信使传导通路的关键分子之一[7-8]。物质依赖戒断后CPA 建立的过程中,有厌恶动机或情绪的产生,那么特定脑区内PKA 的表达变化是不是CPA 的分子基础,目前尚不明了。本实验通过对慢性吗啡成瘾雄性SD 大鼠纳洛酮催瘾戒断后CPA 动物模型,定位于腹侧被盖区(ventral tegmental area,VTA),测定CPA 建立前后PKA 蛋白表达水平。
1 材料与方法
1.1 材料
1.1.1 动物及分组 选用72只SPF雄性(Sprage-Dawley)SD 大鼠[郑州大学实验动物中心提供,许可证号SCXK(豫)2005-0001],10周龄,体重(200±20)g,独立通风笼具系统饲养,颗粒型清洁级饲料[许可证号:SCXK(豫)-2005-0001]喂饲,室温(20±2)℃,自然昼夜循环,非直接光照,所有实验均在8:00~20:00完成。在整个实验过程中,大鼠自由饮水及进食。人道主义对待实验动物。
本研究共分为3组。研究组:慢性吗啡注射+纳洛酮催瘾组(MN 组);对照:慢性吗啡注射+生理盐水“催瘾”组(MS组)和慢性生理盐水注射+纳洛酮催瘾组(SN 组)。吗啡注射从第1天(d1)至第7天(d7)的上午,对照组同期注射等体积的生理盐水。实验方案见表1。
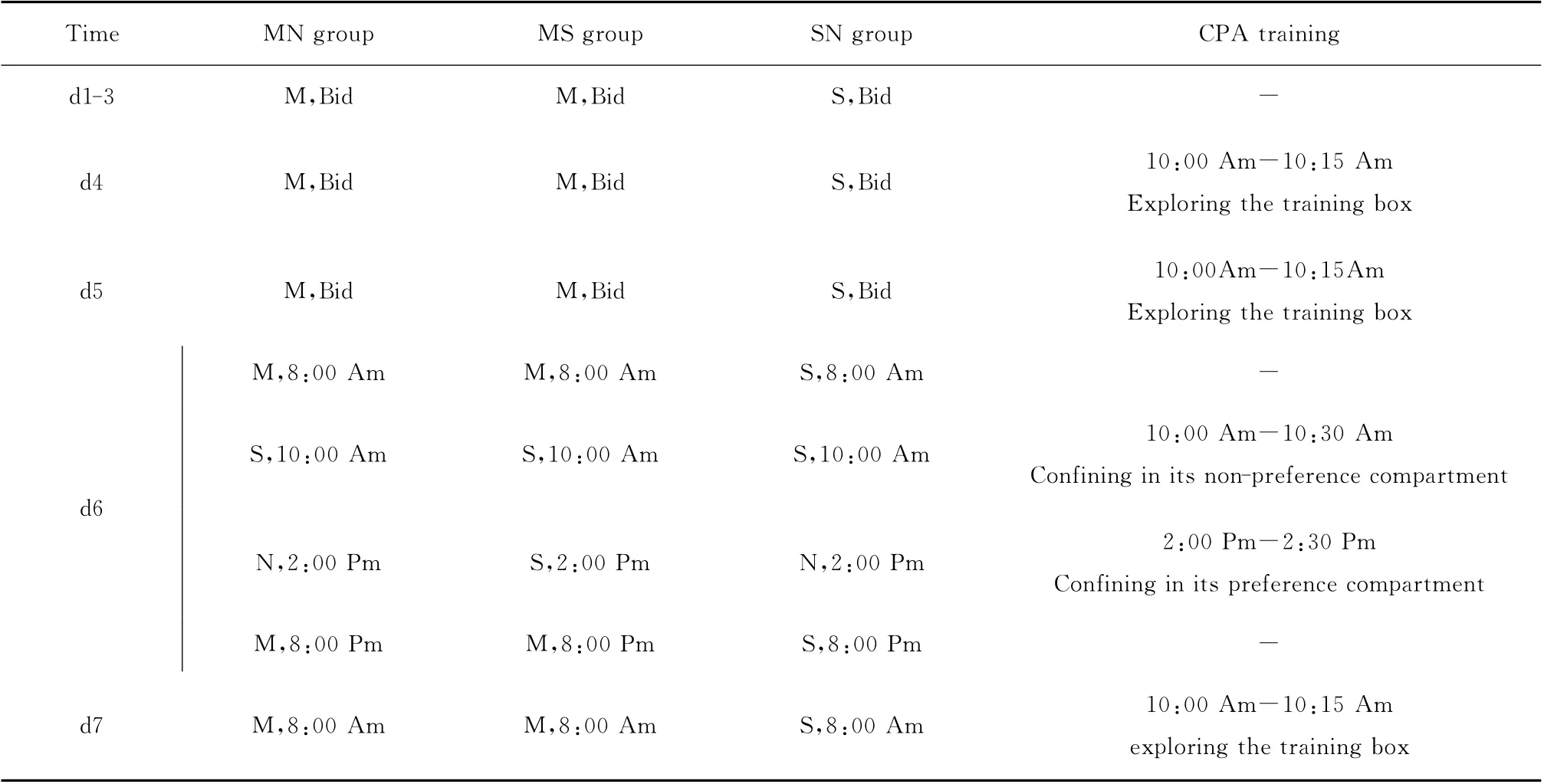
表1 试验处理因素的施加方案Table 1 Experimental design
1.1.2 仪器与试剂 YD-1058B石蜡切片机(浙江金华益迪医疗设备厂),Motic病理图像分析系统(厦门麦克奥迪实业集团有限公司),盐酸吗啡注射液(Morphine Hydrochloride Injection,东北制药集团公司沈阳第一制药厂生产,批号为100305-1),盐酸纳洛酮注射液(Naloxone Hydrochloride Injec-tion,北京四环制药有限公司生产,批号为20100207),兔抗大鼠PKA 多克隆抗体(美国Millipore公司,批号07-1468),山羊抗兔二抗(北京中杉公司,批号SP9001)。
1.1.3 实验装置 条件性位置反射训练箱:体积为60cm×30cm×30cm,被中间的可抽动隔板(30cm×30cm)等分为2 个小室。一侧内侧各面均为黑色,底面光滑,简称黑侧;另一侧内侧各面均为白色底面粗糙,简称白侧。替代隔板(30cm×30cm):一侧底面有10cm×10cm 的缺口,以便在试验鼠适应训练箱和测评时替代原来的隔板。
1.2 方法
1.2.1 慢性吗啡依赖纳洛酮催瘾戒断CPA 的训练和测试 本试验采用的是平衡设计的条件性位置反射训练箱[9]。训练均在受声光控制的环境进行:照明40lux,排气扇白噪音(masking white noise)50 dB。CPA 行为训练分为3 个阶段:条件化前期(preconditioning session,d5),条件化期(conditioning session,d6),CPA 测试期(test session,d7),详见表1。自然偏好侧(纳洛酮催瘾戒断搭配侧,简称伴药侧)的评定:条件化前期实验鼠在该侧的时间大于总时间的一半(450s)。吗啡依赖纳洛酮催瘾戒断的CPA 分数(s):CPA 测试期试验鼠在伴药侧的时间减去条件化前期在同侧的时间。
1.2.2 PKA 的免疫组化检测 每组大鼠于CPA测评后90min,均随机选取6只,灌注取脑,冰冻切片,片厚30μm,参照大鼠解剖图谱,留取腹侧被盖区的切片。免疫组化均是按ABC 法进行。1%H2O2处理切片30 min,0.01 mol/L PBS 漂洗5 min×3次,室温下正常山羊血清封闭1h 并振荡,分别加一抗(磷酸化CREB 一抗的工作液浓度1/1 000),4℃孵育过夜。0.01mol/L PBS 漂洗5min×3次,分别加生物素化的二抗,2h后0.01mol/L PBS漂洗5min×3次。加ABC 复合物,室温下反应2h,0.01mol/L PBS漂洗5min×3次,DAB显色,显微镜下控制反应,显色满意后0.01 mol/L PBS充分漂洗终止反应。贴片,常规脱水透明,中性树胶封片。阴性对照是以正常山羊血清取代一抗,其余步骤不变。每组选取免疫组织化学染色切片各4 张,4 张图片分别来自不同的动物,使用Motic病理图像分析系统测量阳性神经元的平均灰度值,其与PKA 表达强弱呈负相关。
1.3 统计学分析
2 结果
2.1 3组大鼠CPA评定的结果
CPA 测试期(d7),MN 组试验鼠在伴药侧的时间(s)较条件化前期显著减少,说明MN 组大鼠形成了明显的CPA,MS组和SN 组在伴药侧的时间较条件化前期无显著性变化。见表2。
表2 3组实验鼠CPA 条件化前期及测试期在伴药侧时间及厌恶分数(±s,n=24)Table 2 The aversion scores and time in naloxone-paired compartment at preconditioning session and test session(±s,n=24)
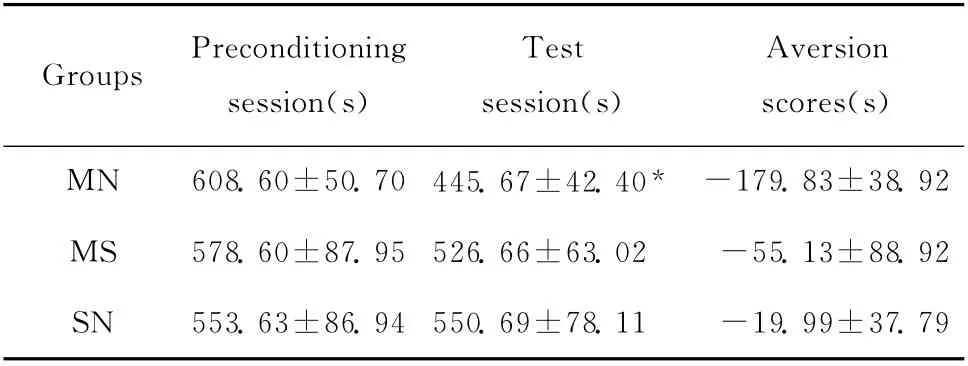
表2 3组实验鼠CPA 条件化前期及测试期在伴药侧时间及厌恶分数(±s,n=24)Table 2 The aversion scores and time in naloxone-paired compartment at preconditioning session and test session(±s,n=24)
*P<0.01 vs.preconditioning session
GroupsPreconditioning session(s)Test session(s)Aversion scores(s)MN 608.60±50.70 445.67±42.40*-179.83±38.92 MS 578.60±87.95 526.66±63.02-55.13±88.92 SN 553.63±86.94 550.69±78.11-19.99±37.79
2.2 大鼠腹侧被盖区PKA蛋白表达水平
CPA 建立前,MN 组实验鼠VTA 内PKA 蛋白表达水平与MS组和SN 组实验鼠差异无统计学意义。CPA 建立后MN 组PKA 蛋白表达水平高于MS组和SN 组,差异有统计学意义。见表3。
表3 CPA 建立前后大鼠腹侧被盖区PKA 的灰度值(±s,n=24)Table 3 Changes of gray intensity of PKA in ventral tegmental area after the formation of CPA(±s,n=24)
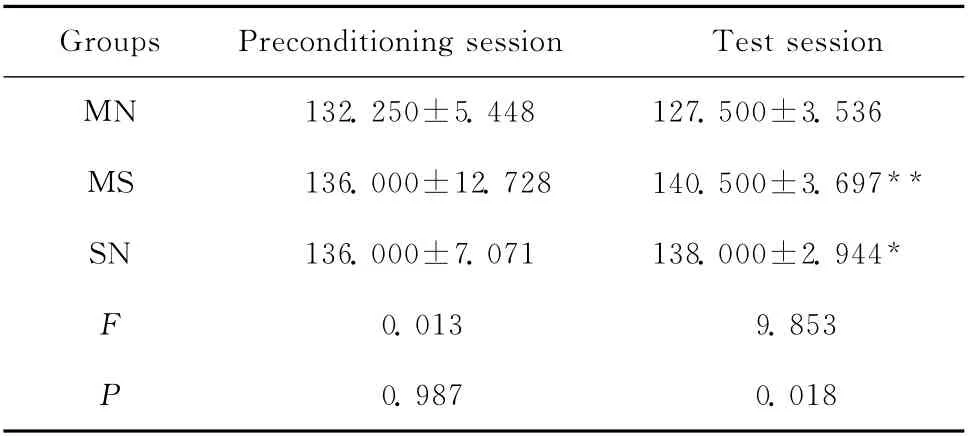
表3 CPA 建立前后大鼠腹侧被盖区PKA 的灰度值(±s,n=24)Table 3 Changes of gray intensity of PKA in ventral tegmental area after the formation of CPA(±s,n=24)
*P<0.05,**P<0.01 vs.MN group
Groups Preconditioning session Test session MN 132.250±5.448 127.500±3.536 MS 136.000±12.728 140.500±3.697**SN 136.000±7.071 138.000±2.944*F 0.013 9.853 P 0.987 0.018
3 讨论
目前对厌恶动机的分子机制的研究主要集中在生物信息转导通路方面,研究较多的途径主要是腺苷酸环化酶(adenylic acid,AC)-环磷酸腺苷(cAMP)-PKA-cAMP 反应元件结合蛋白(cAMP response element binding protein,CREB)途径、鸟苷酸环化酶-环磷酸鸟苷-蛋白激酶G 途径和Ca2+-钙调节蛋白(Calmodulin,CaM)-钙调节蛋白依赖的蛋白激酶(Ca2+/calmodulin-dependent protein kinase,CaMK)-CREB 等途径,其中,PKA 通路的上调是经典途径之一。长期滥用药物造成大脑神经适应性改变,这些改变导致行为变化并成为药物复吸的驱动力[10]。
PKA 是包含调节亚基和催化亚基的一种四聚体,有4种调节亚型(RⅠα,RⅠβ,RⅡα,RⅡβ)和3种催化亚型(Cα,Cβ,Cγ),PKA 属于丝氨酸∕苏氨酸蛋白激酶。PKA 在大脑各处都有表达,尤其在大脑皮层、丘脑和杏仁核中高度表达,在中脑、伏隔核(NAc)和腹侧被盖区(VTA)中度表达[11]。PKA 作为第二信使传导通路的关键分子之一,其功能涉及突触可塑性、基因转录[7,12-13]等方面。
本研究表明:MN 组实验鼠在伴药侧的时间较条件化前期明显减少,MN 组大鼠形成了明显的CPA,CPA 形成过程中,研究组实验鼠脑内VTA的PKA 的蛋白表达明显高于对照组。VTA 是中脑边缘系统多巴胺通路的核心结构,神经纤维联系广泛,是介导物质犒赏效应、渴求与复吸以及药物敏感化的重要结构基础。在CPA 建立的过程中,VTA 内CREB基因的转录和功能性的表达均明显增强,可能是CPA 建立过程中厌恶动机的表达和/或犒赏的降低,以及其他与药物暴露相关的突触可塑性变化[14]等的重要分子基础。
Man等[15]发现PKA 可促进药物诱导的突触可塑性,PKA 通过磷酸化AMPA 受体的GluR1亚基促进AMPA 受体运输到细胞膜,提示PKA 可能通过此机制增强物质依赖戒断后CPA 的神经可塑性。
总之,本实验通过对慢性吗啡成瘾雄性SD 大鼠纳洛酮催瘾戒断后CPA 动物模型的建立,定位于VTA,研究结果提示VTA 内PKA 蛋白的高表达导致的厌恶的中枢状态,可能是CPA 建立关键的神经机制;VTA 内PKA 的适应性变化可能是物质依赖戒断后CPA 相关神经可塑性变化的重要分子基础。
[1] 郝伟.精神活性物质所致精神障碍[M]//郝伟.精神病学.北京:人民卫生出版社,2005:74-78.
[2] Kantak K M.Vaccines against drugs of abuse:a viable treatment option?[J].Drugs,2003,63(4):341-352.
[3] Tang Y L,Zhao D,Zhao C Z,et al.Opiate addiction in China:current situation and treatments[J].Addiction,2006,101(5):657-665.
[4] Sanchis-Segura C,Spanagel R.Behavioural assessment of drug reinforcement and addictive features in rodents:an overview[J].Addict Biol,2006,11(1):2-38.
[5] Azar M R,Jones B C,Schulteis G.Conditioned place aversion is a highly sensitive index of acute opioid dependence and withdrawal[J].Psychopharmacology(Berl),2003,170(1):42-50.
[6] Stinus L,Cador M,Zorrilla E P,et al.Buprenorphine and a CRF1antagonist block the acquisition of opiate withdrawalinduced conditioned place aversion in rats[J].Neuropsychopharmacology,2005,30(1):90-98.
[7] Nguyen P V,Woo N H.Regulation of hippocampal synaptic plasticity by cyclic AMP dependent protein kinases[J].Prog Neurobiol,2003,71(6):401-437.
[8] Sands W A,Palmer T M.Regulating gene transcription in response to cyclic AMP elevation[J].Cell Signal,2008,20(3):460-466.
[9] Li Y,Liu X,Chen H.Development,extinction and reinstatement of morphine withdrawal-induced conditioned place aversion in rats[J].Addict Biol,2007,12(3/4):470-477.
[10] Koob G F,Volkow N D.Neurocircuitry of addiction[J].Neuropsychopharmacology,2010,35(1):217-238.
[11] Lein E S,Hawrylycz M J,Ao N.Genome-wide atlas of gene expression in the adult mouse brain[J].Nature,2007,445(7124):168-176.
[12] Gracy K N,Dankiewicz L A,Koob G F.Opiate withdrawal-induced fos immunoreactivity in the rat extended amygdala parallels the development of conditioned place aversion[J].Neuropsychopharmacology,2001,24(2):152-160.
[13] 阮磊,张存泰,刘念,等.钙调蛋白激酶Ⅱ和蛋白激酶A 信号转导通路在儿茶酚胺敏感性室性心动过速中的作用[J].华中科技大学学报:医学版,2011,40(3):260-263.
[14] Kauer J A.Learning mechanisms in addiction:synaptic plasticity in the ventral tegmental area as a result of exposure to drugs of abuse[J].Annu Rev Physiol,2004,66:447-475.
[15] Man H Y,Sekine-Aizawa Y,Huganir R L.Regulation of{alpha}-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor trafficking through PKA phosphorylation of the Glu receptor 1subunit[J].Proc Natl Acad Sci USA,2007,104(9):3579-3584.
