肾上腺髓质素对鼠成骨细胞IGF-Ⅰ及IGF-ⅠR mRNA 表达的影响
2012-12-23尹德龙田林强李昆朋郭风劲陈安民
尹德龙, 田林强, 叶 媛, 程 鹏, 李昆朋,宫 晨, 林 阳, 郭风劲, 陈安民△
1 华中科技大学同济医学院附属同济医院骨科,武汉 430030
2 武汉市普爱医院ICU,武汉 430070
骨形成是一个复杂的生理生化过程,此过程涉及多种细胞,并受各种细胞因子的调控。近年来发现的一种生物活性多肽——肾上腺髓质素(adrenomedullin,ADM),是成骨细胞增殖分化的强激活剂,对于骨质疏松症的防治,可能具有重要的应用价值[1-2]。已有研究表明,将无血管活性的ADM 肽段注入成年小鼠皮下,其成骨指数明显升高[3]。为进一步研究其促进成骨的作用机制,本实验主要观察ADM 对鼠成骨细胞胰岛素样生长因子Ⅰ(IGF-Ⅰ)及胰岛素样生长因子Ⅰ型受体(IGF-ⅠR)mRNA 表达的影响。
1 材料和方法
1.1 实验材料
新生0~3dSD 大鼠(由华中科技大学同济医学院实验动物学部提供);低糖DMEM 培养液(美国Gibco公司);ADM(美国Phoenix Pharmaceutics Inc);Ⅰ型胶原酶(Sigma公司);青霉素、链霉素双抗(武汉博士德公司);Trizol试剂盒(美国Invitrogen公司);反转录试剂盒、TaqMix DNA 聚合酶(日本TOYOBO 公司);PCR 引物(由上海英骏公司合成)。
1.2 实验分组
将ADM 配制成10-13~10-11mol/L 的终浓度[2],分别对培养细胞作用12h 和24h。分组如下:A 组(对照组,不加ADM),B 组(10-13mol/L ADM,作用12h),C组(10-12mol/L ADM,作用12 h),D 组(10-11mol/L ADM,作用12 h),E 组(10-11mol/L ADM,作用24h)。
1.3 新生SD大鼠成骨细胞培养
在无菌操作下完整取出乳鼠(新生0~3dSD大鼠)颅盖骨,加入0.1% Ⅰ型胶原酶室温静置30 min后,于37℃条件下剪碎振荡消化20min。1 000 r/min离心10min后,将细胞沉淀用少量含20%胎牛血清的DMEM 培养液(含双抗浓度为100 U/mL)重悬,以1×105个/mL 接种于25cm 培养瓶,置37℃、5% CO2条件下培养24h后换液1次,以后每3天换液1次。本实验细胞采用第2代成骨细胞,培养条件同上。待细胞充分贴壁并达80%融合时,用0.25%胰蛋白酶消化并接种于6孔板中,换用含0.1%牛血清白蛋白的无血清低糖DMEM 培养液培养24h,然后按上述实验分组,改用含药物(AMD)培养液,培养时间分别为12h和24h。
1.4 采用RT-PCR的方法进行目的基因表达的检测
1.4.1 总RNA 提取及检测 采用Trizol试剂盒提取总RNA,并用无RNA 酶水溶解,标本稀释后经紫外分光光度计测定其浓度和纯度,另取标本做快速琼脂糖凝胶电泳,以分析RNA 的完整性。根据测定值调整RNA 标本浓度为1μg/μL。
1.4.2 RT-PCR 方法检测IGF-Ⅰ和IGF-ⅠR mRNA 的表达 取2μL RNA 进行逆转录。引物序列如下:IGF-Ⅰ,上游引物5′-CACACCCAGGAGGGGAACAG-3′,下游引物 5′-GTGTTGTTGATGCTCCGTCC-3′;IGF-ⅠR,上游引物5′-TCCACATCCTGCTCATCTCC-3′,下游引物5′-TGCCTTCCCACACACACTTG-3′。于PCR 仪根据不同的产物类型及大小设置变性、退火、延伸温度及时间,循环次数。反应条件:IGF-Ⅰ为94℃变性60s、55℃退火45s、72℃延伸60s,共30个循环。IGF-ⅠR 为94℃变性30s、58℃退火30s、72℃延伸30 s,30 个循环;所有循环最后均72℃延伸7 min。PCR 扩增产物经琼脂糖凝胶电泳后经JS-380自动凝胶图像分析仪照相;计算目的条带的灰度值与对应内参β-actin的灰度值之比,用BandScan软件进行图像分析处理,以此半定量目的基因表达。
1.5 统计学分析
2 结果
2.1 原代大鼠成骨细胞
所取培养3d的原代SD 大鼠成骨细胞,如图1所示细胞体积较大,呈鳞片状,胞质丰富,有伪足。

图1 培养3d的成骨细胞原代细胞(×100)Fig.1 SD rat osteoblast after 3-day culture(×100)
2.2 IGF-Ⅰ、IGF-ⅠR 的扩增产物
IGF-Ⅰ、IGF-ⅠR 的扩增产物分别为321bp和490bp,电泳图见图2。

图2 各组IGF-Ⅰ及IGF-ⅠR 扩增电泳图Fig.2 Agarose gel electrophoresis of IGF-Ⅰand IGF-ⅠR
2.3 ADM 对IGF-ⅠmRNA表达的影响
ADM 能够刺激IGF-ⅠmRNA 的表达,而且这种刺激作用与药物浓度和作用时间有关。在作用12h后,10-11mol/L 的ADM(D 组)可以明显促进IGF-ⅠmRNA 表达(与A 组相比,P<0.05);作用24h(E 组)后IGF-ⅠmRNA 表达即下降(与A 组相比P>0.05)(图3)。

图3 ADM 对大鼠成骨细胞IGF-ⅠmRNA 表达的影响Fig.3 Effects of ADM on IGF-ⅠmRNA expression of rat osteoblasts
2.4 ADM 对IGF-ⅠR mRNA的影响
ADM 可以上调IGF-ⅠR mRNA 表达,呈剂量依赖性(图4),作用12h后D 组的IGF-ⅠR mRNA表达较A 组明显增高(P <0.05),10-11mol/L ADM 在作用24h后(E 组)IGF-ⅠR mRNA 仍高表达(与A 组相比,P <0.05),证明ADM 对IGF-ⅠR mRNA高表达作用时间较对IGF-Ⅰ更长。
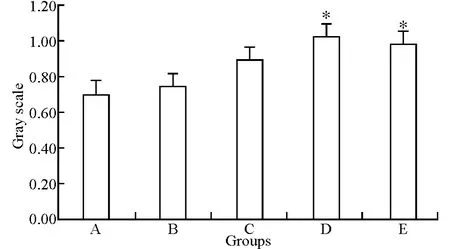
图4 ADM 对大鼠成骨细胞IGF-ⅠR mRNA 表达的影响Fig.4 Effects of ADM on IGF-ⅠR mRNA expression of rat osteoblasts
3 讨论
本实验研究结果显示,ADM(浓度为10-13~10-11mol/L)可促进大鼠成骨细胞IGF-Ⅰ及IGF-ⅠR 基因mRNA 的表达,并呈药物浓度和时间依赖性,ADM 促进成骨细胞增殖可能通过此信号通路发挥其作用。
Cornish等[2]发现,体外培养成骨细胞时,ADM浓度在10-13~10-11mol/L时能有效刺激大鼠成骨细胞增殖,在体内实验中,将ADM 注入成年小鼠的颅骨中,连续注射5d,2周后对其骨形成及吸收指标进行分析,结果显示颅骨成骨活性提高了2~4倍,且成骨作用有剂量依赖性,表明ADM 在体内及体外均可促进骨形成。为了进一步研究ADM 促进骨形成的机制,本实验采用大鼠原代成骨细胞,观察不同浓度的ADM 对成骨细胞的IGF-Ⅰ及IGF-ⅠR基因表达的影响。
本实验结果显示:ADM 能够刺激IGF-ⅠmRNA 表达,而且这种刺激作用与药物浓度和作用时间有关。ADM 可以明显促进IGF-ⅠmRNA 表达,以10-11mol/L的浓度作用12h最为显著,本实验同样亦发现,ADM 同时可以上调IGF-ⅠR mRNA表达,呈剂量依赖性。有研究表明ADM 能够刺激成骨细胞增殖,使成骨细胞cAMP 含量和PKA、PKC、MAPK 活性增加,激活PKC 和MAPK/ERK是其主要的细胞内信号转导途径。而IGF-Ⅰ的产生可以由cAMP 介导的基因表达所诱导[4],因而ADM 可能通过此通路调节IGF-Ⅰ及IGF-ⅠR mRNA 表达,进而达到其促进成骨细胞增殖的作用。在本实验中,ADM 作用24h后,IGF-ⅠmRNA 表达下降,与对照组无明显差异,而IGF-ⅠR mRNA却一直保持较高的表达,可能表明ADM 促进成骨细胞增殖更主要是通过刺激IGF-ⅠR 蛋白表达,从而增强IGF-Ⅰ的自分泌或旁分泌作用发挥其促骨形成效应。
ADM 是Kitamura等[5]于1993年从人嗜铬细胞瘤中分离出的一种具有广泛生物学效应的肽类物质。属于降钙素基因相关肽(calcitonin gene related peptide,CGRP)家族,该家族包括降钙素、CGRP、Amylin和ADM,CGRP家族的成员对骨代谢具有重要的调节作用[2,6]。ADM 广泛分布于心血管系统以及肾、脑、肺等多种组织器官,同时在骨组织也呈高表达[5],可促进成骨细胞增殖,抑制成骨细胞凋亡,在体内促进骨生成[7]。IGF-Ⅰ是一种多功能的细胞生长增殖调控因子,与骨骼中受体结合发生受体自身磷酸化后激活酪氨酸蛋白酶,促使胰岛素受体底物磷酸化,从而调节细胞的生长、增殖和代谢[8]。在体外可刺激成骨细胞DNA 和蛋白质合成,体内能够促进骨及软骨生长,其对参与骨转换的所有细胞均具有刺激有丝分裂和启动分化的活性,尤其增加成骨细胞数目和功能[9]。
有研究发现,骨质疏松和骨量减少患者血浆中ADM 含量显著高于正常骨密度人群。在腰椎和髓部,随骨密度降低,血浆ADM 含量增高,ADM 含量增高可能是机体为对抗骨量丢失而代偿的结果[10]。IGF-Ⅰ水平下降是骨质疏松重要的发病机制之一,老年人血清中IGF-Ⅰ水平降低是引发骨质疏松和骨折的重要原因[11]。以上研究提示我们,ADM 有可能作为一种新的治疗手段在促进骨愈合以及防治骨质疏松上发挥一定的临床应用价值。本实验为ADM 用于临床治疗骨质疏松或骨折提供了一定的实验依据。
ADM 有广泛生物学效应,近期研究显示,ADM促成骨细胞增殖与血管舒张作用的活性区是不同的。在ADM 肽链中有特定的促成骨细胞增殖区,此区存在于ADM 梭基端,这就为ADM 肽段作为治疗用药提供了理论依据。综上所述,ADM 肽段具有的成骨活性为其用于骨质疏松的治疗提供了广阔的前景[12]。但是,ADM 能否用于骨质疏松和骨量减少性疾病的治疗,还需对其影响成骨调控的分子机制进行观察,以及通过动物实验验证其是否具有临床应用价值,这些都有待深入研究。
[1] Lausson S,Cressent M.Signal transduction pathways mediating the effect of adrenomedullin on osteoblast survival[J].J Cell Biochem,2011,112(12):3807-3815.
[2] Cornish J,Callon K E,Coy D H,et al.Adrenomedullin is a potent stimulator of osteoblastic activity in vitro and in vivo[J].Am J Physiol,1997,273(6Pt 1):E1113-E1120.
[3] Kitamura K,Matsui E,Kato J,et al.Adrenomedullin(11-26):a novel endogenous hypertensive peptide isolated from bovine adrenal medulla[J].Peptides,2001,22(11):1713-1718.
[4] McCarthy T L,Thomas M J,Centrella M,et al.Regulation of insulin-like growth factorⅠtranscription by cyclic adenosine 3′,5′-monophosphate(cAMP)in fetal rat bone cells through an element within exon 1:protein kinase A-dependent control without a consensus AMP response element[J].Endocrinology,1995,136(9):3901-3908.
[5] Kitamura K,Kangawa K,Kawamoto M,et al.Adrenomedullin:a novel hypotensive peptide isolated from human pheochromocytoma[J].Biochem Biophys Res Commun,1993,192(2):553-560.
[6] Alam A S,Moonga B S,Bevis P J,et al.Amylin inhibits bone resorption by a direct effect on the motility of rat osteoclasts[J].Exp Physiol,1993,78(2):183-196.
[7] Uzan B,Villemin A,Garel J M,et al.Adrenomedullin is antiapoptotic in osteoblasts through CGRP1receptors and MEKERK pathway[J].J Cell Physiol,2008,215(1):122-128.
[8] Glass D J.PI3kinase regulation of skeletal muscle hypertrophy and atrophy[J].Curr Top Microbiol Immunol,2010,346:267-278.
[9] Hock J M,Centrella M,Canalis E.Insulin-like growth factorⅠhas independent effects on bone matrix formation and cell replication[J].Endocrinology,1988,122(1):254-260.
[10] 林景荣,吕传勇,高连如,等.原发性骨质疏松患者血浆降钙素基因相关肽及肾上腺髓质素含量变化的意义[J].中华医学杂志,2011,81(14):841-843.
[11] Yakar S,Rosen C J,Beamer W G,et al.Circulating levels of IGF-1directly regulate bone growth and density[J].J Clin Invest,2002,110(6):771-781.
[12] Kubo A,Minamino N,Isumi Y,et al.Production of adrenomedullin in macrophage cell line and peritoneal macrophage[J].J Biol Chem,1998,273(27):16730-16738.
