Tenascin-C在人原发性肝细胞癌浸润、转移和血管生成中的作用*
2012-12-23尹传昌廖晓峰郭跃清易继林李兴睿
尹传昌, 廖晓峰, 陈 雯, 郭跃清, 易继林, 李兴睿△
华中科技大学同济医学院附属同济医院 1 普外科,2 妇产科,武汉 430030
肿瘤组织中细胞外基质是一种由胶原蛋白、糖蛋白和蛋白多糖构建成的复杂小梁结构。该结构参与细胞间相互作用,调节细胞粘附、增殖和分化[1]。肿瘤细胞与细胞外基质之间的相互作用对于肿瘤浸润和转移起着很重要的作用。Tenascin(TN)是细胞外基质中具有独特六臂体结构的高分子糖蛋白[2-3],共有3种异构分子,主要由幼稚时期的成纤维细胞合成[4-5]。研究表明Tenascin-C是细胞外基质中调节上皮和间质组织生长的重要成分[6]。尽管Tenascin-C在正常组织中表达很低,但在人体恶性实性肿瘤中,如乳腺癌、胃癌、结肠癌和黑色素瘤中均呈高表达[7-11]。细胞学实验研究结果表明Tenascin-C与肿瘤浸润相关,它可促进肿瘤血管生长、肿瘤细胞繁殖以及抑制肿瘤免疫反应[12]。原发性肝细胞癌(hepatocellular carcinoma,HCC)是全球最常见恶性肿瘤之一[13]。HCC 血供极为丰富,故新生血管的形成可能对该类肿瘤浸润和转移都有很大影响。微血管密度(MVD)是评估肿瘤新生血管的金指标,与各种肿瘤预后密切相关[14-16]。HCC 中MVD 越高,其进展速度就越快,预后就越差。MVD也可以作为生物学标记来区分良恶性肝脏病变[17]。至今为止,人们对Tenascin-C 在HCC 中的表达及其相关作用了解甚微。本研究,我们不仅对HCC、肝硬化以及正常肝组织中Tenascin-C 的表达进行检测评估,同时也对Tenascin-C 表达与临床病理指标和MVD 相关性进行检验与分析,以了解其在HCC浸润、转移和血管生成中的作用。
1 材料与方法
1.1 患者一般情况
所有病例均来自2000年至2005年武汉市同济医院普外科HCC手术患者标本。54例HCC患者,其中女性35例,男性19例;平均年龄(44.6±11.6)岁(24~77岁);其中29例发生转移;3例合并肝硬化。术前检查甲胎蛋白(AFP)阴性患者(<400μg/mL)19例,阳性患者35例。手术后,对54例HCC患者进行为时30个月的随访,收集到46例患者资料,其他8例患者失访。随访期间,46例HCC患者中有37 例(80.4%)死亡。此外,取肝硬化标本32例和肝脏外伤标本17例作为对照,其中包括34例男性标本和15例女性标本,患者平均年龄(43.4±10.4)岁。本研究获同济医院伦理委员会批准。
1.2 组织标本处理
将HCC手术切除标本中一部分储存于-70℃环境,备用于逆转录聚合酶链反应(RT-PCR)。其余的用10%多聚甲醛溶液固定,再用石蜡包埋待用。对HCC 标本进行Edmondson-Steiner标准分期:Ⅰ~Ⅱ期30例,Ⅲ~Ⅳ期24例。并记录标本肿瘤大小及有无包膜侵犯。每一个标本组织块均匀切成4μm 薄片用于苏木精-伊红染色。所有的HCC病理诊断均由2位病理学研究人员独自完成。
1.3 Tenascin-C的免疫组织化学染色
组织切片用二甲苯进行脱蜡,水化。切片经PBS水浴10min再冷却20min行修复抗原,然后浸泡在3%过氧化氢内5min,以阻断内源性过氧化物酶的活性。随后,加一抗即抗Tenascin-C 小鼠单克隆抗体孵育(NeoMarkers公司,美国)4℃过夜。次日用抗鼠生物素二抗(SP试剂盒,晶美公司)孵育30min,然后与亲和素-生物素复合物(SP 试剂盒,晶美公司)反应,并用二氨联苯胺四盐酸盐(DAB,晶美公司)处理。标本玻片通过苏木精染色,无水乙醇脱水,固定于玻片上。以PBS缓冲液取代一抗作为阴性对照;用明确诊断的乳腺癌标本作为阳性对照。Tenascin-C阳性产物为细胞质中的棕黄色颗粒,且在细胞外基质中形成微小的、连续的或不连续的网状结构。随机选择5处阳性区域进行分析。采用HPIAS-1000高精度彩色图像测量系统(同济强平形象工程公司)测定吸光度值,以此反映Tenascin-C免疫反应表达量。.
1.4 血管密度分析
用内皮细胞表面分子(CD34)单克隆抗体(Dako公司,丹麦),根据说明书使用链霉素抗生物素-免疫过氧化物酶技术来进行微血管的鉴别。切片脱蜡和水化,用3%过氧化氢处理10min以阻断内源性过氧化物酶。用PBS洗涤后,在4℃下一抗孵育过夜备用。在PBS洗涤后,采用二抗(试剂C)和链霉素过氧化物酶复合物进一步清洗(试剂A +B),各用时30min。标本玻片通过苏木精染色,无水乙醇脱水,封片。按照Araya等[18]制定的标准来衡量MVD 数值大小。染为棕色的单细胞或细胞团,无论是否具备血管腔结构,均称为微血管。先在100倍光学显微镜下观察玻片,选择HCC 脉管最多的区域,接着在200倍光学显微镜下计数5个高倍镜视野下的脉管平均数记为MVD 值。
1.5 RT-PCR检测
依据说明书用Trizol 试剂(Life Technologies,Grand Island,NY)提取总RNA,通过M-MLV逆转录酶以及Oligo dT引物(晶美公司)逆转录为cDNA[19]。取逆转录产物行PCR 扩增。Tenascin-C 引物序列为:上游5′-GAGATTTAGCCGTGTCTGAGGTTG-3′;下游5′-AGGAGAGATTGA-AGCTCTCG-3′,扩增片段长度为2 237bp;以β-actin为内参照,引物序列为:上游5′-CCTTCCTTCCTGGGCATG-3′,下游5′-GAGCAATGATCTTGATCTTC-3′,扩增片段长度为287bp。将5μL cDNA 产物混入由PCR 缓冲液5 μL,2.5mmol/L的dNTP 2μL,5U/L Taq DNA 聚合酶0.5μL(晶美公司),以及2 种浓度均为10 μmol/L的引物溶液2μL 组成共计50μL 的混合物中。PCR反应条件如下:预变性94℃2min,变性94℃30s,60℃30s和72℃60s,共计35个循环,延伸72℃2min。用含有溴化乙啶的2%琼脂糖凝胶电泳分离PCR产物。以凝胶图像分析系统计算电泳条带的吸光度值,以Tenascin-C/β-actin吸光度比值作为定量分析指标。
1.6 数据分析
所有数据均采用SPSS 12.0统计分析软件进行分析。计数资料组间比较采用卡方检验,计量资料组间比较采用t检验。根据Kaplan-Meier法分析生存资料。使用Log-rank检验法衡量生存组间的差异是否有统计学意义。对MVD 和Tenascin-C 的相关性进行线性回归分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 Tenascin-C在不同肝组织内的表达情况
免疫组化染色结果显示:54例HCC 组织中有34例(约63.0%)Tenascin-C(+),32例肝硬化组织中有6 例(18.8%)Tenascin-C(+),差异有统计学意义(χ2=14.06,P<0.01)。正常肝组织中除少部分管壁交叉反应导致的弱阳性外,尚未发现Tenascin-C表达。Tenascin-C在不同肝脏组织内的表达强度具有明显差异,肝硬化组织内Tenascin-C 的表达强度(149.24±8.25)明显低于 HCC 组织[(162.15±9.77),t=2.192,P<0.05]。HCC 组织内Tenascin-C主要位于癌灶细胞外间质,形成灶性褐色的连续或者不连续的条索及网状结构。在HCC的癌巢内和基底膜新生微小血管内亦可见Tenascin-C(图1)。Tenascin-C 在癌巢边缘含量要远远高于癌巢中心的含量[(165.23± 7.25)vs.(156.02±7.95),t=2.119,P<0.05]。

图1 免疫组织化学方法检测HCC和正常肝组织中的Tenascin-C表达(DAB显色)Fig.1 Immunohistochemical detection of Tenascin-C in HCC and normal hepatic tissues(DAB staining)
2.2 Tenascin-C mRNA的表达
图2为Tenascin-C mRNA 在不同的肝组织内表达情况。HCC内Tenascin-C mRNA 含量远远高于肝硬化组织内的含量[(0.593±0.110)vs.(0.138±0.089),t=2.894,P<0.05]。在正常肝组织中并未检测到Tenascin-C表达。
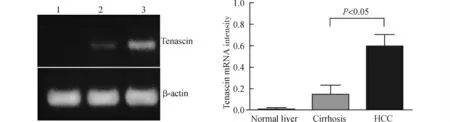
图2 RT-PCR检测不同肝组织中Tenascin-C mRNA 的表达Fig.2 Expression of Tenascin-C mRNA detected by using RT-PCR
2.3 Tenascin-C表达与HCC病理特征的关系
由表1可见,HCC患者中Tenascin-C表达有包膜浸润者明显高于无浸润者(P<0.05),Edmondson-Steiner病理分级Ⅲ~Ⅳ级者明显高于Ⅰ~Ⅱ级者(P<0.05)、肿瘤有转移者明显高于无转移者(P<0.01),而Tenascin-C表达在不同肿瘤大小者、AFP是否阳性者以及是否合并肝硬化者之间差异均无统计学意义(均P>0.05)。随访的46例HCC患者平均随访时间为11.5个月(3~30个月),随访期间Tenascin-C阴性表达患者比Tenascin-C阳性表达患者的中位生存时间长[分别为(22.01±6.95)月vs.(15.08±7.06)月,P<0.05,log-rank test,图3]。
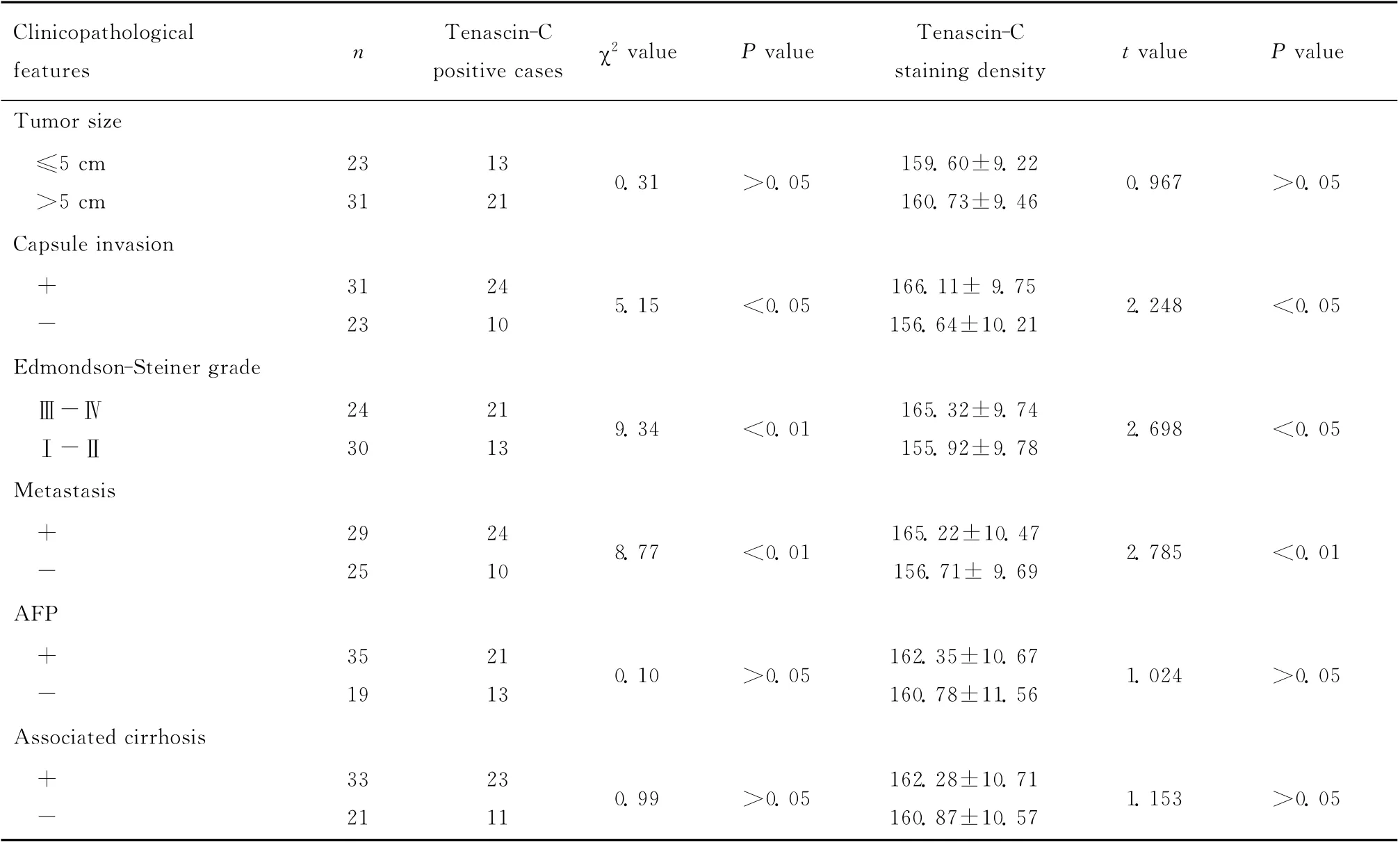
表1 Tenascin-C与HCC临床病理特征之间的关系Table 1 Correlation of Tenascin-C immunostaning with clinicopathological features in HCC
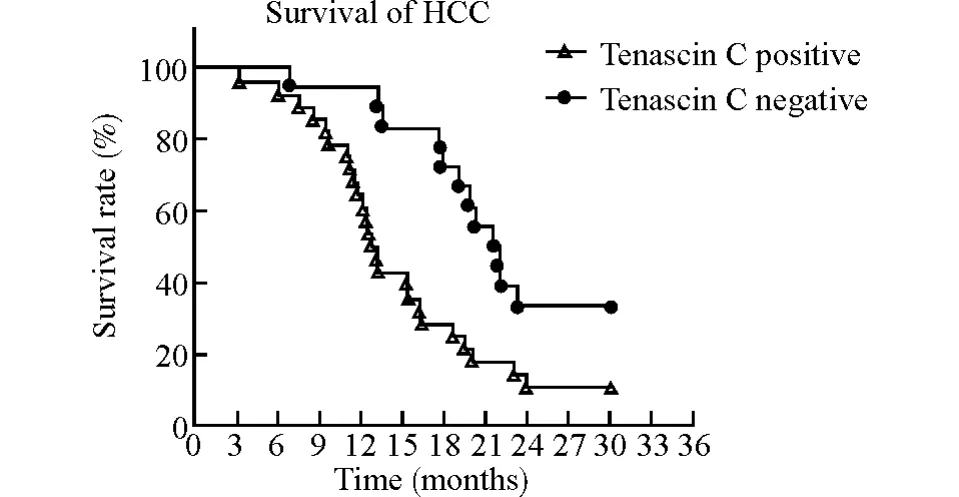
图3 随访的46例HCC患者的Kaplan-Meier生存曲线Fig.3 Kaplan-Meier survival curves of 46patients with HCC
2.4 MVD以及Tenascin-C的表达和HCC病理特征的关系
HCC组织内微血管大量出现在癌旁组织,特别在毗邻的浸润性肿瘤的边缘处(图4)。Tenascin-C表达与MVD 呈正相关(r=0.68,P<0.05)。MVD 和HCC病理特征的关系见表2。HCC中肿瘤直径>5 cm、有包膜浸润、Edmondson-Steiner分级为Ⅲ~Ⅳ、出现转移者,其MVD 均分别大于肿瘤直径≤5cm、无包膜浸润、Edmondson-Steiner分级为Ⅰ~Ⅱ级及无转移者(均P<0.05)。而MVD 在AFP是否阳性者以及是否肝硬化者之间差异无统计学意义(P>0.05)。

图4 内皮细胞内CD34着色示HCC组织微血管(SP法,×200)Fig.4 Immunohistochemical staining of endothelial cells with CD34in HCC(SP,×200)
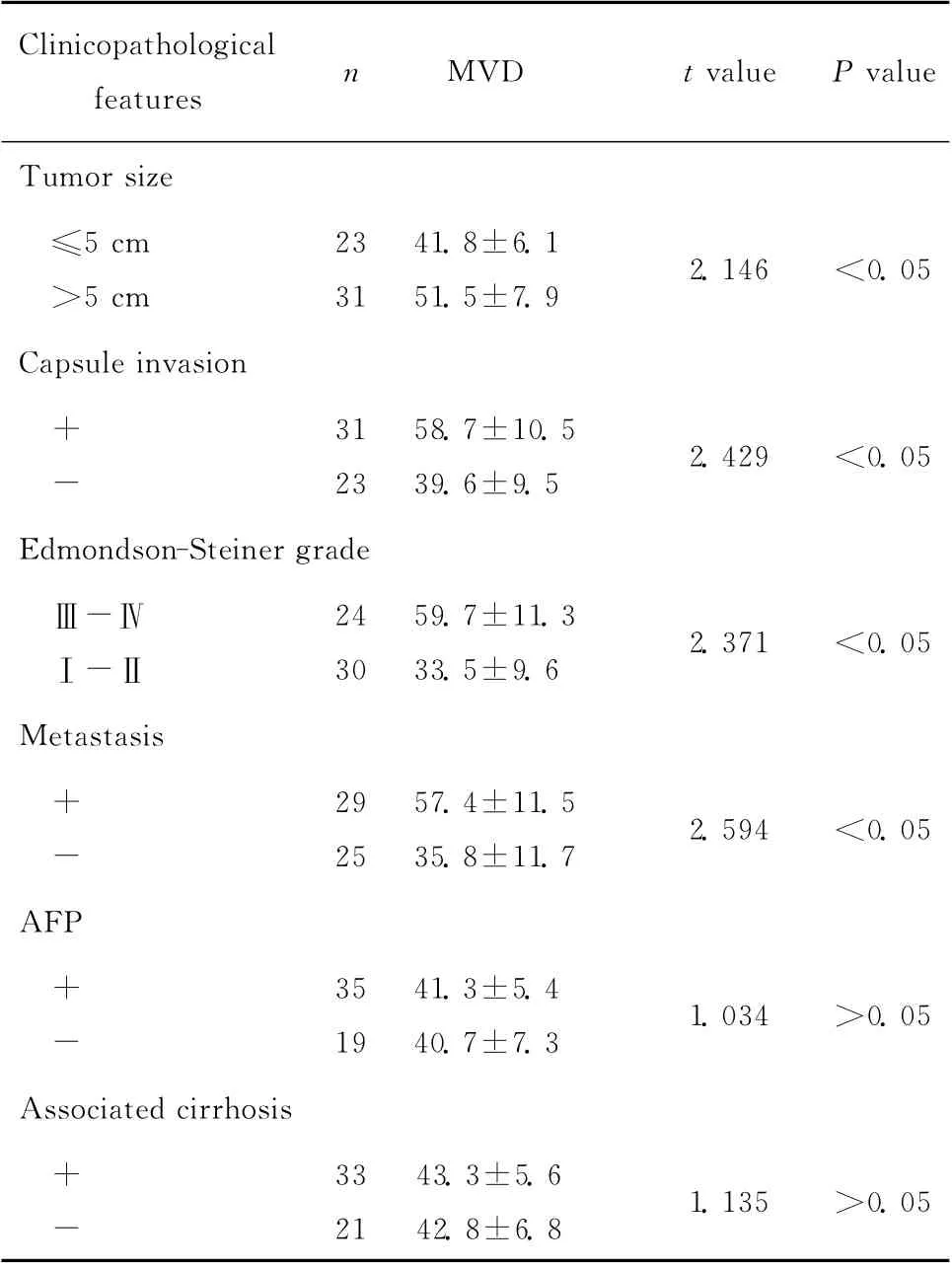
表2 MVD与HCC临床病理特征之间的关系Table 2 Correlation of MVD with clinicopathological features in HCC
3 讨论
一直以来,大家在肿瘤研究中只关注于肿瘤细胞的研究,而忽略了细胞外基质的重要性,而基质细胞及其产物在复杂的肿瘤生物学级联反应中起着重要作用[20]。肿瘤浸润和转移,不仅取决于肿瘤细胞本身,而且与细胞和细胞外基质相互作用而产生的复杂改变有关。肿瘤内部及外周的细胞外基质与正常组织的细胞外基质对关键分子功能的上调、下调影响明显不同[21]。具有上述调节功能的Tenascin-C分子,能够通过影响细胞间的相互作用促进肿瘤浸润和生长[22]。尽管已经证实很多肿瘤表达Tenascin-C[23-25],但是对Tenascin-C 在HCC 内表达,及其对HCC 浸润、转移和血管生成等的影响了解并不多。
如同其他恶性肿瘤内一样[26-27],免疫组织化学和RT-PCR 实验结果均显示Tenascin-C 在HCC内高表达,而正常组织中未见Tenascin-C 表达。在胚胎发育时期时常见到Tenascin-C 高表达,在成熟组织中Tenascin-C表达很少,但是在恶性肿瘤的基质中却发现有大量Tenascin-C 表达。研究表明肿瘤组织中的Tenascin-C由间质成纤维细胞合成,且在局部肿瘤播散和旁分泌作用上起着至关重要作用[3,28]。进一步研究Tenascin-C 和HCC 临床病理特征之间的联系发现,其表达与HCC 病理学分级,肿瘤转移和胞膜浸润之间存在相关性。进展越快的肿瘤,Tenascin-C 的表达越高。我们观察到Tenascin-C表达呈阴性患者较Tenascin-C 表达呈阳性患者的预后明显要好,这提示Tenascin-C 可作为预测HCC患者预后的因素。
在肿瘤中Tenascin-C 的作用仍未得到明确且存在很大争议。细胞学实验表明Tenascin-C 通过增强成纤维细胞生长因子的有丝分裂效应而促使肿瘤细胞生长。其中,成纤维细胞生长因子是诱导表皮生长因子增殖的先决条件[22]。体外实验表明Tenascin-C 能够抑制T 细胞活化,推测Tenascin-C可以促进肿瘤诱导的免疫抑制和助肿瘤逃脱T 细胞作用[29]。然而,其他一些报道认为在肿瘤细胞外基质中Tenascin-C 表达量增加将阻碍肿瘤细胞远处转移和生长[30]。本研究发现在HCC 癌巢边缘Tenascin-C表达较强;癌浸润处Tenascin-C 较癌巢中心明显要高。HCC 边缘高表达的Tenascin-C 是否能诱发或抑制HCC生长仍需要进一步研究。
血管生成是指原血管长出的新生毛细血管,其对于除微小型之外的肿瘤生长至关重要。HCC 是血供丰富的肿瘤。已经证实血管生成对于HCC 转移和浸润具有重要的作用[17]。MVD 目前被认为是肿瘤血管生成程度组织学评估的金标准。MVD 是一个预测肿瘤生长、转移和发展的独立指标。早先进行的一些实验中发现MVD 与肿瘤大小以及分化程度密切相关[31-32]。在本研究中发现MVD 与肿瘤大小和HCC 的Edmondson-Steiner分级有显著的关系。此外,发现MVD 与HCC转移和包膜侵犯相关,并且证实了血管生成对于HCC 进展的重要性。在一些恶性肿瘤中已经发现Tenascin-C 对其血管生成存在影响[33-34]。本研究发现在HCC 中存在Tenascin-C 表达,在癌巢和肿瘤浸润处存在的MVD 最高。在HCC 中Tenascin-C(+)区域微血管数目明显增多,这就意味着血管生成和HCC 中Tenascin-C表达有明显关系存在。已经有实验证实Tenascin-C 能调节基质中内皮生长因子(VEGF)[35-36]。Tanaka等[35]在实行癌细胞移植以及共同培养实验中,发现Tenascin-C 能趋化一些调节因子诱导癌细胞产生VEGF。我们推测在Tenascin-C表达和肿瘤血管生成之间存在起着重要调节作用的因子,因而需要进一步研究。
本实验结果表明:Tenascin-C 与肿瘤HCC 的浸润、转移和血管生成密切相关。Tenascin-C 和MVD 可以作为预测HCC 转移和浸润潜能的生物学指标。
[1] Slater M.Dynamic interactions of the extracellular matrix[J].Histol Histopathol,1996,11(1):175-180.
[2] Chiquet-Ehrismann R,Mackie E J,Pearson C A,et al.Tenascin:an extracellular matrix protein involved in tissue interactions during fetal development and oncogenesis[J].Cell,1986,47(1):131-139.
[3] Degen M,Brellier F,Schenk S,et al.Tenascin-W,a new marker of cancer stroma,is elevated in sera of colon and breast cancer patients[J].Int J Cancer,2008,122(11):2454-2461.
[4] Erikson H P,Bourdon M A.Tenascin:an extracellular matrix protein prominent in specialized embryonic tissues and tumors[J].Annu Rev Cell Biol,1989,5:71-92.
[5] Chiquet M,Fambrough D M.Chick myotendinous antigen:A monoclonal antibody as a marker for tendon and muscle morphogenesis[J].J Cell Biol,1984,98(6):1926-1936.
[6] Moch H,Torhorst J,Dürmüller U,et al.Comparative analysis of the expression of tenascin and established prognostic factors in human breast cancer[J].Path Res Pract,1993,189(5):510-514.
[7] Mackie E J,Chiquet-Ehrismann R,Pearson C A,et al.Tenascin-C is a stromal marker for epithelial malignancy in the mammary gland[J].Proc Natl Acad Sci USA,1987,84(5):4621-4625.
[8] Ikeda Y,Mori M,Kajiyama K,et al.Immunohistochemical expression of tenascin in normal stomach tissue,gastric carcinomas and gastric carcinoma in lymph nodes[J].Br J Cancer,1995,72(1):189-192.
[9] Soini Y,Paako P,Nuorva K,et al.Tenascin immunoreactivity in lung tumors[J].Am J Clin Pathol,1993,100(2):145-150.
[10] Sakai T,Kawakatsu H,Hirota N,et al.Specific expression of Tenascin in human colonic neoplasms[J].Br J Cancer,1993,67(5):1058-1064.
[11] Natali P G,Nicotra M R,Bigotti A,et al.Expression and production of tenascin in benign and malignant lesions of melanocyte lineage[J].Int J Cancer,1990,46(4):586-590.
[12] Chiquet-Ehrismann R,Chiquet M.Tenascins:Regulation and putative functions during pathological stress[J].J Pathol,2003,200(4):488-499.
[13] Blum H E.Liver cancer[J].Eur J Gastroenterol Hepatol,2005,17(5):475-476.
[14] Poon R T,Ng I O,Lau C,et al.Tumor microvessel density as apredictor of recurrence after resection of hepatocellular carcinoma:aprospective study[J].J Clin Oncol,2002,20(7):1775-1785.
[15] Ng I O,Poon R T,Lee J M,et al.Microvessel density,vascular endothelial growth factor and its receptor Flt1and Flk-1/KDR in hepatocellular carcinoma[J].Am J Clin Pathol,2001,116(6):838-845.
[16] Zheng H C,Sun J M,Li X H,et al.Role of PTEN and MMP-7expression in growth,invasion,metastasis and angiogenesis of gastric carcinoma[J].Pathol Int,2003,53(10):659-666.
[17] Lu J P,Wang J,Wang T,et al.Microvessel density of malignant and benign hepatic lesions and MRI evaluation[J].World J Gastroenterol,2004,10(12):1730-1734.
[18] Araya M,Terashima M,Takagane A,et al.Microvessel count predicts metastasis and prognosis in patients with gastric cancer[J].J Surg Oncol,1997,65(4):232-236.
[19] Katenkamp K,Berndt A,Hindermann W,et al.mRNA ex-pression and protein distribution of the unspliced Tenascin-CC isoform in prostatic adenocarcinoma[J].J Pathol,2004,203(3):771-779.
[20] Koochekpour S,Merzak A,Pilkington G J.Extracellular matrix proteins inhibit proliferation,upregulate migration and induce morphological changes in human glioma cell lines[J].Eur J Cancer,1995,31A(3):375-380.
[21] Ioachim E,Charchanti A,Briasoulis E,et al.Immunohistochemical expression of extracellular matrix components tenascin,fibronectin,collagen type Ⅳand laminin in breast cancer:their prognostic value and role in tumor invasion and progression[J].Eur J Cancer,2002,38(18):2362-2370.
[22] Vollmer G.Biologic and oncologic implications of Tenascin-C/hexabracion proteins[J].Crit Rev Oncol Hematol,1997,25(3):187-210.
[23] Kusagawa H,Onoda K,Namikawa S,et al.Expression and degeneration of Tenascin-C in human lung cancers[J].Br J Cancer,1998,77(1):98-102.
[24] Verstraeten A A,Mackie E J,Hageman P C,et al.Tenascin-C expression in basal cell carcinoma[J].Br J Dermatol,1992,127(6):571-574.
[25] Jahkola T,Toivonen T,von Smitten K,et al.Expression of Tenascin in invasion border of early breast cancer correlates with higher risk of distant metastasis[J].Int J Cancer,1996,69(6):445-447.
[26] Zhao M,Laissue J A,Zimmermann A.Tenascin and type Ⅳcollagen expression in liver cell dysplasia and in hepatocellular carcinoma[J].Histol Histopathol,1996,11(2):323-333.
[27] Pilch H,Schaeffer U,Schlenger K,et al.Expression of Tenascin in human cervical cancer-association of Tenascin expression with clinicopathological parameter[J].Gynecol Oncol,1999,73(3):415-421.
[28] Ekblom P,Aufderheide E.Stimulation of Tenascin expression in mesenchyme by epithelial-mesenchymal interactions[J].Int J Dev Biol,1989,33(1):71-79.
[29] Puente Navazo M D,Valmori D,Ruegg C.The alternatively spliced domain TnFnⅢA1A2of the extracellular matrix protein tenascin-C suppresses activation-induced T lymphocyte proliferation and cytokine production[J].J Immunol,2001,167(11):6431-6440.
[30] Buyukbayram H,Arslan A.Value of tenascin-C content and association with clinicopathological parameters in uterine cervical lesions[J].Int J Cancer,2002,100(6):719-722.
[31] Tanigawa N,Lu C,Mitsui T,et al.Quantitation of sinusoidlike vessels in hepatocellular carcinoma:its clinical and prognostic significance[J].Hepatology,1997,26(5):1216-1223.
[32] Nakashima Y,Nakashima O,Hsia C C,et al.Vascularization of small hepatocellular carcinomas:correlation with differentiation[J].Liver,1999,19(1):12-18.
[33] Ishiwata T,Takahashi K,Shimanuki Y,et al.Serum tenascin-C as a potential predictive marker of angiogenesis in non-small cell lung cancer[J].Anticancer Res,2005,25(1B):489-495.
[34] Behrem S,ZarkoviĉK,Eskinja N,et al.Distribution pattern of tenascin-C in glioblastoma:correlation with angiogenesis and tumor cell proliferation[J].Pathol Oncol Res,2005,11(4):229-235.
[35] Tanaka K,Hiraiwa N,Hashimoto H,et al.Tenascin-C regulates angiogenesis in tumor through the regulation of vascular endothelial growth factor expression[J].Int J Cancer,2004,108(1):31-40.
[36] Liu Z,Gao Q,Zhang S,et al.Expression of tenascin and fibronectin in nasal poyps[J].J Huazhong Univ Sci Technol[Med Sci],2002,22(4):371-374.
