被动吸烟诱导的胎儿生长受限大鼠胎盘血管结构异常及其机制*
2012-12-23陈镇燕黄光英
陈镇燕, 李 静, 黄光英
华中科技大学同济医学院附属同济医院中西医结合研究所,武汉 430030
胎盘作为母胎之间的血液交换器官,它的结构与功能直接影响到胎儿的宫内发育,母胎间的营养交换是通过胎盘绒毛母血间隙与绒毛内胎儿血管间血液交换进行的。胎儿生长受限(fetal growth retardation,FGR)的发生与胎盘血管减少及胎盘功能不足有关[1]。调节血管的因子主要为:血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)及其受体VEGFR1、VEGFR2 即VEGF/VEGFR 系统;Angpt1、Angpt2及其共同受体Tie2即Angpt/Tie2系统[2]。VEGF-A 及其受体结合可刺激原始祖细胞向血管内皮细胞分化、增殖、迁移组建成内皮细胞管。Tie2与Angpt1结合可促进血管周细胞聚集、包绕血管内皮细胞管,维持血管的稳定。而Angpt2是Angpt1的拮抗因子,Tie2与Angpt2结合则减弱血管内皮细胞与血管周细胞的连接,导致血管内皮细胞对VEGF等生长因子更加敏感,增殖能力越强,从而使血管处于一种可塑造状态,促进血管的重组[3]。
目前关于胎盘血管调控机制尚不清楚,因鼠类与人类的胎盘相似,故通常用鼠类作研究模型。鼠类胎盘由外到内依次为:基底层、海绵层(spongiotrophoblast,Sp)、迷路层(labyrinth,La)。基底层是胎盘边缘残留的母体子宫肌层组织,海绵层及迷路层是胎盘的功能层,其中迷路层为胎盘的血管交换层。由于迷路层内无母体的内皮细胞,母血由滋养细胞围绕,形成所谓的母体血窦[4],而绒毛内的胎儿血管有内皮细胞包绕,因此本研究通过BS-lectin来标记绒毛内胎儿血管内皮细胞[5]以研究被动吸烟所诱导的FGR 胎盘绒毛血管形态学的异常,阐明FGR 胎盘血管异常及其机制,以期为寻找更好的FGR 治疗方法提供理论依据。
1 材料与方法
1.1 动物模型的建立与标本制备
健康无交配史的SPF级SD 大鼠购于华中科技大学同济医学院实验动物学部(质量许可证号SCXK 2004-0007),按雌雄分笼饲养。每晚将雌鼠和雄鼠合笼(雌雄比为2∶1),次日分笼,观察阴道涂片,如发现精虫,记为妊娠第1天。将已受精雌鼠12只,随机分为正常组和FGR 组。FGR 组大鼠于妊娠第7天起,置于烟雾吸入箱中,每次燃烟4 支(湖北武汉卷烟厂制,烟碱含量1.5mg,CO 含量13 mg),吸烟箱留有通气缝,每次燃烟后不揭盖直至下次熏烟。2次间隔时间为2h,每天熏烟4次。妊娠第21天时,戊巴比妥钠麻醉(麻醉用量为50 mg/kg)后剖腹取胎鼠及胎盘并称重,每只孕鼠取3 个胎盘(1个位于子宫中央,另外2个分别位于两边)。从脐带中央位点将每个胎盘垂直切成两半,将一半胎盘浸于10%中性甲醛固定,常规石蜡包埋切片,另一半再从脐带中央位点处均分成两半即1/4 胎盘,分别用锡箔纸包裹置于-80℃保存以备荧光PCR 检测及Western blot检测。
1.2 胎盘血管密度的检测
BS-lectin为血管凝集素,可凝集红细胞并特异性与血管内皮细胞结合,标记血管内皮细胞,因此可用于胎盘血管染色分析[5]。切片常规脱蜡后置于0.01mol/L PBST(0.01 mol/L 磷酸盐缓冲液含1‰ 吐温20,pH=7.4)洗3 次共15 min,3%的H2O237℃封闭内源性的过氧化氢酶10min(避光),PBST 洗15min,0.1%胰酶(谷歌生物科技公司,含1 mmol/L 的CaCl2及MgCl2)37℃消化10 min,PBST 洗15min,1%的牛血清白蛋白(BSA,谷歌生物科技公司)封闭10min,亲和素-生物素封剂(Vector公司,USA)依次分别封闭15 min,PBST 洗15 min,TBS(Tris-base 60.57 g,NaCl 87.00 g,用H2O 加至1000mL,其中CaCl2及MgCl2各含1.0 mmol/L)孵育10min,PBST 洗10min,100μg/mL的生物素标记的BS-lectin(Sigma,USA)孵育20 min以标记血管,PBST 洗15min,链霉亲和素结合的辣根过氧化氢酶(北京博奥森生物科技有限公司)孵育30 min,PBST 洗15 min,DAB(Dako 公司,Denmark)显色后,苏木精复染,氨水返蓝后常规脱水,中性树脂封片。
1.3 体视学方法分析胎盘血管
胎盘血管用BS-lectin 染色后,组织切片用Canon 影像系统拍照(Canon,Japan,350D)。所有切片的测量由同一个人完成,且未告知其组织切片的分组。采用IPP 6.0 软件分析,运用数点方法计算大鼠胎盘血管密度。首先分析胎盘各组成部分所占胎盘的总体积百分比,放大倍数为4,系统选择胎盘切片不重复部位视野并拍照,同时涵盖切片的各部位。运行IPP 6.0的网格程序后选择111点网格即111个点均匀覆盖显微镜下拍摄的视野相片,分别数落在迷路层的点数及胎盘组织的总点数,两者间的比值即为胎盘迷路层的体积百分比。然后在40倍显微镜下进一步分析迷路层内胎儿血管的体积密度,数落在胎儿血管的点数及迷路层的点数从而计算迷路层的胎儿血管体积密度。胎盘血管体积密度即为胎盘迷路层体积百分比与迷路层胎儿血管体积密度的乘积。假设胎盘的密度为1g/cm3,依据其质量估算胎盘的总体积,通过胎盘总体积与体积分数的乘积计算胎盘各成分的体积[6]。用1mm的标尺在不同倍数显微镜下拍照后导入IPP软件,测量血液交换屏障的厚度。
1.4 实时荧光PCR 检测胎盘组织的VEGF-A、VEGFR1、VEGFR2、Tie2、Angpt1、Angpt2的mRNA表达
Trizol试剂盒(TaKaRa公司)提取胎盘RNA,取1μg的RNA,用逆转录试剂盒(TaKaRa公司)进行逆转录。取2μL 逆转录的cDNA,0.4μL 正向引物(10μmol/L),0.4μL 反向引物(10μmol/L),0.4μL的passive reference dye,7.8μL ddH2O及10μL 2×SYBR Premix Ex Taq(TaKaRa公司)混合,进行扩增。每个样本设3 个复孔。ABI StepOne Real-Time PCR System(Applied Biosystems公司,USA)检测基因的表达量。引物由TaKaRa公司设计合成(引物序列见表1)。基因扩增条件均为95℃30s,95℃5s,60℃30s,扩增完后依据目的基因与内参基因β-actin的CT 值差值即ΔCT 确定目的基因表达。将一个样本的cDNA作为标准品,将标准品稀释2 倍、4 倍、8 倍、16 倍,检测5种稀释倍数下荧光PCR 扩增的CT 值,将标准品1倍的CT 设为参照,计算其它稀释倍数的CT与参照CT 的差值即ΔCT,标准品1倍的基因表达量为20=1,其它稀释倍数的基因表达量即为2-ΔCT,计算基因稀释倍数与基因表达量间的相关系数r2即可得到基因的扩增效率,经检测各引物扩增效率接近100%。将正常组一个胎盘的VEGF-A的表达量设为1,其它的表达量均以此为参照,计算公式为2-ΔΔCT。

表1 基因引物序列Table 1 Primers used for real-time PCR
1.5 免疫组化法检测胎盘组织的VEGF-A、VEGFR2、Tie2、Angpt2蛋白的表达
VEGF-A、VEGFR2(Thermo 公司,USA)、Tie2(Santa Cruz公司,USA)、Angpt2(Abcham 公司,USA)均为兔抗大鼠多克隆抗体,抗体稀释浓度分别为1∶300、1∶50、1∶50、1∶100。切片常规脱水后,微波90~100℃抗原修复10min,VEGF-A 修复液为1mmol/L EDTA,pH=8.0,其它抗体修复液均为枸橼酸盐,pH=6.0,PBST 洗3 次,共15 min,3%的H2O237℃封闭内源性的过氧化氢酶10 min(避光),PBST 洗15min,一抗4℃孵育过夜(一抗用一抗稀释液稀释,稀释液含1%BSA)。次日,室温复温30min,PBST 洗15min,二抗(中杉金桥兔二步法非生物素检测试剂盒)37℃孵育1h,PBST 洗15min,DAB显色后,苏木精复染,氨水返蓝后常规脱水,中性树脂封片。依据抗体表达部位特点来判断免疫组化切片的可靠性,如VEGF-A 主要表达于海绵滋养层及迷路滋养层,胎盘边缘的基底层子宫肌层细胞阴性,则将肌层为阴性的免疫组化切片纳入VEGF-A 蛋白表达的统计分析;VEGFR2、Tie2、Angpt2均表达于迷路层,海绵滋养层不表达,则将海绵滋养层阴性切片纳入VEGFR2、Tie2、Angpt2蛋白表达的统计分析。免疫组化阳性表达采用半定量方法:“-”表示不着色,阴性表达;“+”表示弱表达,阳性表达可检测到;“⧺”表示中度表达,着色明显;“⧻”表示强表达;“”表示极强表达,非表达部位也强阳性着色。
1.6 Western blot法检测胎盘组织的VEGF-A、VEGFR2、Tie2、Angpt2蛋白的表达
将胎盘于10倍体积组织蛋白裂解液中匀浆,匀浆后用BAC蛋白检测试剂盒测浓度,将100μg蛋白与上样缓冲液混合后,高温变性10min,于SDSPAGE凝胶电泳后转移酸纤维素膜;膜用含有5%的脱脂奶粉的PBST 闭封1h后,PBST 洗3次,加入一抗4℃过夜(VEGF-A 1∶200,VEGFR2 1∶100,Angpt2 1∶200,Tie2 1∶100),洗后加入辣根过氧化物酶标记的二抗37℃温育,化学发光法定影显影,扫描胶片,用凝胶图像处理系统分析目标条带的分子量和吸光度值。
1.7 统计学处理
采用SPSS 12.0软件统计分析数据,数据首先进行正态性检验,符合正态分布的则用±s表示。采用独立样本t检验进行数据分析,以P<0.05为差异有统计学意义。
2 结果
2.1 正常组与FGR 组胎鼠体重、胎盘重量的比较
正常组(n=73)胎鼠体重、胎盘重量分别为(4.101±0.418)g,(0.702±0.253)g;FGR 组(n=70)胎鼠体重、胎盘重量分别为(3.690±0.354)g,(0.595±0.103)g,n=70。与正常组相比,FGR 组胎鼠体重、胎盘重量明显减轻(均P<0.01)。
2.2 正常组与FGR 组胎盘形状及胎盘血管形态学的比较
和正常组胎盘相比,FGR 组胎盘较为扁平,迷路层滋养细胞的细胞核及细胞质性状不规则,其所含嗜碱性染色质增多,某些细胞胞核与胞质边界不清;血液交换屏障由于嗜碱性物质沉积而厚度显著增加(P<0.05),迷路层、海绵层总体积及胎盘胎儿血管总体积均显著减少(均P<0.05)。与正常胎盘相比,FGR 组胎盘血管密度超出正常组范围上下限,但差异无统计学意义。见表2,图1、图2。
2.3 各组胎盘VEGF-A、VEGFR1、VEGFR2、Tie2、Angpt1、Angpt2mRNA的表达
妊娠第21天胎盘VEGF-A mRNA 丰度最高,约为VEGFR1的3倍,VEGFR2的500倍,Tie2的20倍,Angpt1的50倍,Angpt2的100倍。和正常组相比,FGR 组的VEGF-A mRNA、VEGF-A mRNA 与VEGFR1 mRNA 的比值显著降低(均P<0.05)。VEGFR1、VEGFR2、Tie2、Angpt1、Angpt2均在FGR 组有升高趋势,但差异无统计学意义(均P>0.05)。见表3。
表2 胎盘血管形态学的比较[n=18,±s,(min~max)]Table 2 Comparison of placental morphological parameters[n=18,±s,(min-max)]

表2 胎盘血管形态学的比较[n=18,±s,(min~max)]Table 2 Comparison of placental morphological parameters[n=18,±s,(min-max)]
*P<0.05 vs.normal group
Morphological parameters Normal groupFGR group Proportion of spongiotrophoblast 0.209±0.066(0.140-0.300)0.201±0.042(0.110-0.240)Proportion of labyrinth 0.789±0.065(0.700-0.860)0.798±0.004(0.760-0.890)Total volume of labyrinth(mm3)611±133(479-838)438±72*(280-511)Total volume of spongiotrophoblast(mm3)241±167(110-569)113±38*(56-158)Fetal capillaries volume density in labyrinth 0.113±0.018(0.086-0.135)0.100±0.450(0.032-0.158)Total volume of fetal capillaries(mm3)70±19(49-94)45±21*(13-81)Exchange barrier(μm)1.967±0.543(1.157-2.284)5.839±0.205*(5.623-6.031)
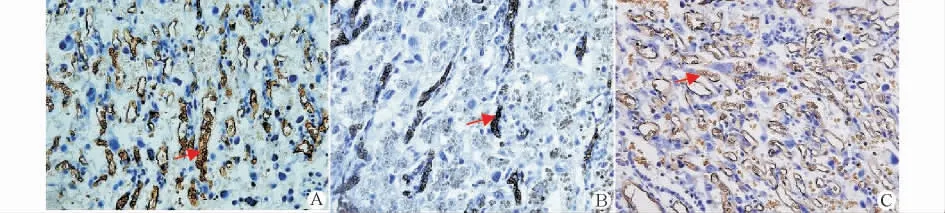
图1 BS-lectin组织化学染色显示大鼠胎盘迷路层胎儿血管(DAB显色,×40)Fig.1 Histochemical analysis with BS-lectin to identify fetal capillaries in the placental labyrinth(DAB,×40)
2.4 各组胎盘VEGF-A、VEGFR2、Tie2、Angpt2蛋白的表达

图2 BS-lectin组织化学染色显示大鼠胎盘母胎血液交换屏障(DAB显色,×100)Fig.2 Histochemical analysis with BS-lectin to identify the exchange barrier between fetal circulation and mother circulation(DAB,×100)
表3 胎盘VEGF-A、VEGFR1、VEGFR2、Tie2、Angpt1、Angpt2mRNA 的表达(n=18,±s)Table 3 Placental VEGF-A,VEGFR1,VEGFR2,Tie2,Angpt1and Angpt2mRNA expression(n=18,±s)

表3 胎盘VEGF-A、VEGFR1、VEGFR2、Tie2、Angpt1、Angpt2mRNA 的表达(n=18,±s)Table 3 Placental VEGF-A,VEGFR1,VEGFR2,Tie2,Angpt1and Angpt2mRNA expression(n=18,±s)
*P<0.05 vs.normal group
Genes Normal group FGR group VEGF-A 1.52±0.59 1.06±0.48*VEGFR1 0.39±0.15 0.46±0.22 VEGF-A/VEGFR1 3.96±1.16 2.56±1.17*VEGFR2 0.003 3±0.004 2 0.004 3±0.006 7 Angpt1 0.032±0.029 0.046±0.035 Angpt2 0.017±0.013 0.028±0.019 Tie2 0.070±0.084 0.095±0.091
妊娠第21天胎盘VEGF-A 蛋白表达丰富,强表达于海绵层滋养细胞,其次为迷路层滋养细胞,胎儿血管内皮细胞可有表达,绒毛内的间充质细胞有少量表达,海绵层糖原细胞及胎盘基底层几乎不表达。VEGFR2主要表达于迷路层滋养细胞,胎儿血管内皮细胞可有表达,绒毛内间充质细胞及海绵层滋养细胞不表达。Tie2 的表达空间分布与VEGFR2类似。Angpt2主要表达于迷路层微绒毛滋养层细胞,胎儿血管内皮细胞可有表达,绒毛内间充质细胞及海绵层滋养细胞均不表达。正常组有3个胎盘的VEGF-A 蛋白为极强表达(),FGR 组有6个样本为极强表达(),其余的样本表达强度介于弱阳性(+)至强阳性(⧻)。VEGFR2蛋白在FGR组有2个样本为中等阳性(⧺),FGR 组的其他样本及正常组样本均为弱阳性(+)。Angpt2蛋白在正常组与FGR 组各有6个样本为阴性(-),4个FGR组胎盘为强阳性(⧻)外,其余介于弱阳性(+)至中等阳性(⧺)间。Tie2 蛋白表达两组均介于阴性(-)及弱阳性(+)表达间。与免疫组化分析结果一致,Western blot蛋白检测未发现两组间血管因子的表达差异有统计学意义(图3、4,表4)。
3 讨论
FGR 是常见的产科并发症,不仅是围生期胎儿发病和死亡的主要原因,而且与成人的心血管、内分泌及生殖等系统疾病发病相关,目前尚无针对FGR的特效治疗[7]。由于胎盘内母血间隙与绒毛内胎儿血管间的营养物质交换是胎儿氧气及营养物质供给的关键,因此关于胎盘血管系统生成的分子机制及病理妊娠的胎盘血管改变已开展了大量的研究,寄以寻求一种能改善胎盘血管交换功能的特效方法从而促进胎儿宫内生长发育。

图3 免疫组化染色示胎盘VEGF-A、VEGFR2、Tie2、Angpt2蛋白的表达(DAB显色,×40)Fig.3 Placental VEGF-A,VEGFR2,Tie2and Angpt2mRNA expression detected by using immunohistochemistry(DAB,×40)

图4 Western blot检测胎盘VEGF-A、VEGFR2、Tie2、Angpt2蛋白的表达Fig.4 Placental VEGF-A,VEGFR2,Tie2and Angpt2protein expression detected by using Western blot
表4 Western blot法比较胎盘VEGF-A、VEGFR2、Tie2、Angpt2 蛋白的表达(n=10,±s)Table 4 Comparison of placental VEGF-A,VEGFR2,Tie2and Angpt2protein expression by Western blot(n=10,±s)

表4 Western blot法比较胎盘VEGF-A、VEGFR2、Tie2、Angpt2 蛋白的表达(n=10,±s)Table 4 Comparison of placental VEGF-A,VEGFR2,Tie2and Angpt2protein expression by Western blot(n=10,±s)
Proteins Normal group FGR group P value VEGF-A/actin 1.341±0.391 1.728±0.715 0.186 VEGFR2/actin 0.330±0.087 0.371±0.108 0.665 Tie2/actin 1.286±0.385 1.356±0.534 0.443 Angpt2/actin 0.347±0.116 0.397±0.262 0.803
胎盘绒毛血管形成分子机制复杂,受很多因子调控,是随时空变化的复杂三维动态过程[8]。不同病理条件下,胎盘血管的改变不一致。高原妊娠、妊娠贫血(母血氧含量减少)及妊高症(母血氧含量正常但滋养细胞侵袭不足以致子宫动脉改造不足[9])均可致胎盘绒毛间隙氧分压降低,缺氧诱导因子(HIF)蛋白表达增加[10],HIF 蛋白在正常氧环境下被蛋白酶快速水解,而缺氧时,HIF 蛋白稳定,与特定DNA 序列结合后可激活VEGF-A 等多种基因的转录以刺激血管的生成[10]。许多研究已证实高原妊娠[11]、妊高症[12]等胎盘血管总体积减少,但其血管密度代偿性增加,其血管生长因子VEGF-A 表达升高;重症FGR 胎儿(即舒张末期脐血流消失型FGR 胎儿)由于胎儿生长严重受限,胎儿从绒毛间隙中摄氧量剧减以致胎盘绒毛间隙氧分压增加,HIF蛋白不稳定,VEGF-A 等血管因子表达降低,胎盘血管密度显著降低。
吸烟孕妇母血中CO 含量增加而O2减少,可导致胎盘绒毛间隙氧分压降低,由此推测吸烟孕妇的胎盘血管密度应代偿性增多。然而研究结果存在许多分歧,Larsen 等[13]在2002 年及Bush 等[14]在2000年运用体视学分析吸烟孕妇晚期胎盘的形态学改变,证实FGR 的绒毛血管密度较非吸烟孕妇胎盘显著减低,而Pfarrer等[15]在1999年运用扫描电镜观察比较4名吸烟孕妇晚期胎盘与4名不吸烟正常孕妇晚期胎盘的绒毛血管,发现吸烟孕妇胎盘血管显著增生。Michaud等[16]发现缺氧时,烟草提取物可通过抑制HIF 蛋白的表达来抑制缺氧状态下的血管代偿性增生,当导入高表达HIF 基因病毒载体时可逆转烟草在缺氧条件时抑制血管增生作用。缺氧可刺激胎盘血管密度代偿增生,烟草又可抑制缺氧所诱发的血管代偿增生反应,研究结果的分歧,可能与这两种相反作用机制及孕鼠胎盘血管代偿能力的个体差异有关。
本研究中,FGR 胎盘较正常胎盘扁平,这可能是种代偿反应,胎盘母体面的扩张可增加胎盘着床处的子宫内膜面积,从而增加胎盘着床处血管的数量以增加胎盘血供。体外研究表明烟草可损伤早期胎盘滋养细胞的侵袭能力,导致滋养细胞侵袭不足[17],胎盘母体面的扩张可代偿因滋养细胞侵袭深度不足所致的血供不足。FGR 胎盘厚度变薄可降低胎盘自身代谢需求,有研究发现胎盘厚度异常增加,将导致绒毛间隙血流灌注阻力增加,绒毛血管树枝过于茂密或复杂将导致胎盘灌注不足[18]。本研究FGR 组的胎盘总血管体积较正常组显著减少,而母血交换屏障显著增厚提示FGR 胎盘血液交换功能下降,FGR 组血管密度范围超出正常组的上限及下限,这提示FGR 胎盘血管结构发生了改变,但其改变存在不一致性,一部分FGR 胎儿血管密度增加,这可能是缺氧条件下胎盘血管密度代偿增生所致,一部分FGR 胎儿血管密度减少,可能是在烟草刺激下,孕鼠个体代偿能力低,胎鼠生长严重受限,胎儿从绒毛间隙中摄氧量剧减以致血管密度减少。
总之,本研究并未证实当初假设即吸烟通过降低血管因子的表达从而减少胎盘血管密度。FGR胎盘的血管总体积显著低于正常胎盘,母血交换屏障显著增厚提示FGR 胎盘血液交换下降,从而限制胎儿的发育,然而胎盘血管密度及血管因子的表达并未减少,反而有增高趋势,所以导入外源性血管因子并无治疗FGR 胎儿的功效,反而促使小鼠胎盘迷路层纤维存积、胚胎重量减轻及吸收胚胎增加[19],吸烟所导致的FGR 胎盘血管异常的分子机制仍待今后深入研究。
[1] Jackson M R,Walsh A J,Morrow R J,et al.Reduced placental villous tree elaboration in small-for-gestation-age pregnancies:relationship with umbilical artery Doppler waveforms[J].Am J Obstet Gynecol,1995,172(2Pt 1):518-525.
[2] Dumont D J,Gradwohl G,Fong G H,et al.Dominant-negative and targeted null mutations in the endothelial receptor tyrosine kinase,tek,reveal a critical role in vasculogenesis of the embryo[J].Genes Dev,1994,8(16):1897-1909.
[3] Maisonpierre P C,Suri C,Jones P F,et al.Angiopoietin-2,a natural antagonist for Tie2that disrupts in vivo angiogenesis[J].Science,1997,277(5322):55-60.
[4] Davies J,Glasser S R.Histological and fine structural observations on the placenta of the rat[J].Acta Anat,1968,69(4):542-608.
[5] Laitinen L.Griffonia simplicifolia lectins bind specifically to endothelial cells and some epithelial cells in mouse tissues[J].Histochem J,1987,19(4):225-234.
[6] Doherty C B,Lewis R M,Sharkey A,et al.Placental composition and surface area but not vascularization are altered by maternal protein restriction in the rat[J].Placenta,2003,24(1):34-38.
[7] Wang Q,Zhu J,Zou L,et al.Role of axonal guidance factor netrin-1in human placental vascular growth[J].J Huazhong Univ Sci Technolog[Med Sci],2011,31(2):246-250.
[8] Mayhew T M,Charnock-Jones D S,Kaufmann P.Aspects of human fetoplacental vasculogenesis and angiogenesis.Ⅲ.Changes in complicated pregnancies[J].Placenta,2004,25(2/3):127-139.
[9] 夏俊霞,乔福元,苏放明,等.整合素αvβ3 在子痫前期患者胎盘组织中的表达及意义[J].华中科技大学学报:医学版,2011,40(3):310-314.
[10] Pugh C W,Ratcliffe P J.Regulation of angiogenesis by hypoxia:role of the HIF system[J].Nat Med,2003,9(6):677-684.
[11] Mayhew T M.Changes in fetal capillaries during preplacental hypoxia:growth,shape remodelling and villous capillarization in placentas from high-altitude pregnancies[J].Placenta,2003,24(2/3):191-198.
[12] Teasdale F.Histomorphometry of the human placenta in maternal preeclampsia[J].Am J Obstet Gynecol,1985,152(1):25-31.
[13] Larsen L G,Clausen H V,Jφnsson L.Stereologic examination of placentas from mothers who smoke during pregnancy[J].Am J Obstetrics Gynecol,2002,186(3):531-537.
[14] Bush P G,Mayhew T M,Abramovich D R,et al.Quantitative study on the effects of maternal smoking on placental morphology and cadmium concentration[J].Placenta,2000,21(2/3):247-256.
[15] Pfarrer C,Macara L,Leiser R,et al.Adaptive angiogenesis in placentas of heavy smokers[J].Lancet,1999,354(9175):303.
[16] Michaud S E,Macara L,Guy L G,et al.Inhibition of hypoxiainduced angiogenesis by cigarette smoke exposure:impairment of the HIFα/VEGF pathway[J].FASEB J,2003,17(9):1150-1152.
[17] Genbacev O,McMaster M T,Lazic J,et al.Concordant in situ and in vitro data show that maternal cigarette smoking negatively regulates placental cytotrophoblast passage through the cell cycle[J].Reprod Toxicol,2000,14(6):495-506.
[18] Thompson M O,Vines S K,Aquilina J,et al.Are placental lakes of any clinical significance?[J].Placenta,2002,23(8/9):685-690.
[19] He Y,Smith S K,Day K A,et al.Alternative splicing of vascular endothelial growth factor(VEGF)-R1(FLT-1)pre-mRNA is important for the regulation of VEGF activity[J].Molecular Endocrinol,1999,13(4):537-540.
