苦参碱对肺纤维化大鼠核因子E2相关因子2、血红素氧合酶-1的作用研究影响
2012-12-23罗庆凯何振华张秀峰李炽观郭春芳
罗庆凯 陈 伟 何振华▲ 张秀峰 李炽观 郭春芳
1.湖南省郴州市第一人民医院呼吸内科,湖南郴州 423000;2.南华大学附属第二医院呼吸内科,湖南衡阳 421001;3.中南大学卫生部肝胆肠外科研究中心,湖南长沙 410008
肺纤维化(pulmonary fibrosis,PF)是特发性肺纤维化、结节病、尘肺、过敏性肺炎、药物和放射导致的纤维化以及胶原血管病致纤维化肺泡炎等慢性肺部疾病的终末病理过程。在肺纤维化的形成机制中,氧化应激的作用机制成为主流,指氧化与抗氧化的失平衡状态。氧化应激促进TNF-α、IL-1、IL-8等前炎性介质表达的同时,提高具有保护性的γ-GCS、MnSOD、GST等[1]抗氧化基因的表达。核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)属于Cap-n Collar家族,它在抗氧化剂应激元件(ARE)介导的抗氧化基因表达中起重要的作用。血红素氧合酶-1(heme oxygenase-1,HO-1),谷胱甘肽-S-转移酶族(glutathione S-transferases,GSTs)和NAD(P)H醌氧化还原酶1[NAD(P)H quinoneoxidoreductase1,NQO1]是基Ⅱ相酶主要组成部分。HO-1是催化血红素生成CO、胆红素及铁离子的限速酶,其保护作用通过其催化血红素分解的三种产物进行。HO-1的保护作用还可能与降低Caspase-3活性以对抗细胞凋亡和抑制TNF-α水平有关[2]。前期研究已经表明,Nrf2在COPD和哮喘肺中抗氧化应激中处于核心地位[2-3]。但是,Nrf2及其下游调控的HO-1在大鼠肺纤维化表达还有待于进一步研究。
苦参碱(Matrine)为豆科槐属植物中生物碱的主要成分,属四环的喹诺里西啶生物。近年来苦参碱的药理和临床研究中,抗成纤维细胞增殖作用研究较多:①能降低肝纤维化指标透明质酸(HA)、Ⅳ型胶原(Ⅳ-C)、前Ⅲ型胶原(PCⅢ)、层黏连蛋白(LN)[4]。②抑制膜细胞增殖和细胞外基质的合成,延缓肾小球硬化和肾间质纤维模型大鼠的病理进程。③对兔耳腹侧面增生性瘢痕有明显的治疗作用[5]。④苦参碱能抑制血管紧张素Ⅱ(AngⅡ)[6]诱导的心肌成纤维细胞增殖。本文通过博来霉素(BLM)诱导建立大鼠肺纤维化经典模型,探讨Nrf2、HO-1在肺纤维化中的表达,苦参碱对肺纤维化的作用及Nrf2、HO-1表达的影响,为临床肺纤维化防治提供理论依据。
1 材料与方法
1.1 主要试剂
苦参碱干粉(吉林玉皇药业有限公司);博来霉素15 mg/支(日本化药株式会社);醋酸泼尼松(天津力生制药股份有限公司);总RNA提取试剂盒(北京百泰克生物技术有限公司);2×PCR试剂DNA MARKER 100 bp(北京全式金生物技术有限公司);RT试剂盒(北京全式金生物技术有限公司);Nrf2抗体即用型3ML(北京博奥森生物技术有限公司);5×TBE EB溶液(北京索莱宝生物技术有限公司);DEPC TRIS(进口原装,AMERSCO);琼脂糖(西班牙原装);SP免疫组化试剂盒,Nrf2、HO-1多克隆抗体(北京博奥森生物技术有限公司);引物设计:Nrf2、HO-1、β-actin(上海生物技术有限公司);引物产品合成:Nrf2、HO-1、β-actin(上海生物技术有限公司),其余试剂自配。
1.2 主要仪器
ZT-12K生物组织自动脱水机(湖北孝感亚光医用电子技术研所)、显微镜(杭州光学仪器厂)、轮转式切片机(德国莱卡公司)、BMJ-3型病理组织包埋机(常州中威电子仪器厂)、PHY-型组织漂烘机(常州中威电子仪器厂)、高压蒸汽消毒柜(SANYO公司)、光学显微镜和光学照像系统(日本OLYPUS公司)、倒置显微镜(日本OlYPUS公司)、震荡混合仪(德国莱卡公司)、恒温烤箱(上海跃进医疗器械厂)、高速台式冷冻离心机(德国SIGMA公司)、luzex-F图像分析仪(日本)、RNA浓度测定仪PCR仪(德国Eppendorf公司);软NIKON&Spot彩色病理图文分析系统(重庆天海公司)。
1.3 实验动物及处理
成年健康雄性SD大鼠120只,随机分为五组,分别为正常对照组(C)、模型组(M)、泼尼松处理组(P)、苦参碱50处理组(M50)、苦参碱100处理组(M100),每组24只。M、P、M50、M100均一次性给予博来霉素(5 mg/kg)进行肺纤维化造模,C组注入等体积的生理盐水。自气管内灌注博来霉素后第1天起,M组和C组每天以1%羧甲基纤维素钠10 mL/kg灌胃1次,M50、M100组分别每天以50、100 mg/kg苦参碱羧甲基纤维素钠溶液灌胃1次,P组以5 mg/kg泼尼松生理盐水每日灌胃1次,至第28天。造模后第7、14、28天将大鼠处死,每组8只每次。取右肺,液氮保存。取左肺固定,包埋,切片。
1.4 观察指标及方法
采用免疫组化法(SP法)检测蛋白表达,步骤按照北京博奥森生物技术有限公司说明书操作。用采图软NIKON &Spot彩色病理图文分析系统进行图像采集。细支气管、肺泡区,各随机取3个视野作图象分析。luzex-F图像分析仪分析,作A值测定(即阳性信号与所选择总面积之比值),A值越大,表达水平越高。
采用RT-PCR检测mRNA表达,步骤按试剂盒说明书操作。引物及扩增产物长度见表1。结果用UVP凝胶图像扫描系统扫描,Quantity One软件分析,算出各电泳条带的面积积分灰度值,并将Nrf2、HO-1表达量进行线性相关分析。

表1 各基因引物序列及扩增产物长度
1.5 统计学方法
采用SPSS 16.0统计软件处理,重复测量的计量资料采用方差分析,两两比较采用SNK法,相关关系分析用Pearson积差相关系数表示,以P<0.05为差异有统计学意义。
2 结果
2.1 病理观察
C组大鼠肺泡无炎性细胞浸润,结构正常。M组第7天为肺泡腔、肺间质内有大量的多核及单核细胞浸润,炎性肉芽组织破坏了正常结构。第14天时,胶原沉积,斑片状纤维化;第28天肺泡炎症稍有减轻,但病变范围弥散,肺泡结构破坏。M50组、M100组、P组与M组病理变化规律相似,但程度都较M组轻微。
2.2 大鼠肺组织蛋白表达
大鼠肺组织Nrf2、HO-1表达结果见图1、2。定量分析显示在M、P、M50、M100组造模后的几次取材中,Nrf2、HO-1表达均高于C组(P<0.05)。第7、14天P组、M50组、M100组的Nrf2、HO-1表达比M组高(P<0.05);P组与M50组比较差异无统计学意义(P>0.05);第28天Nrf2、HO-1表达在M、P、M50、M100组明显低于第7天(P<0.05)。
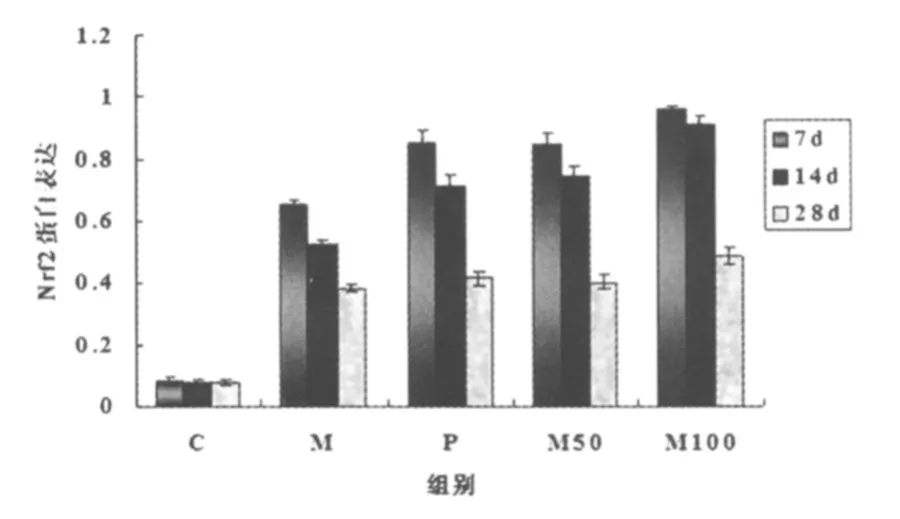
图1 各组大鼠肺组织Nrf2蛋白表达的动态变化
2.3 大鼠肺组织匀浆mRNA表达
M、P、M50、M100组造模后Nrf2、HO-1 mRNA表达均显著强于C组(P<0.05)。第7、14天时P组、M50组、M100组表达强于M组(P<0.05);M100组表达量高于P、M50组(P<0.05)。第28天时M组、P组、M50组、M100组组间比较差异无统计学意义(P>0.05);但较第7天表达显著变弱(P<0.05)。见表2、3。
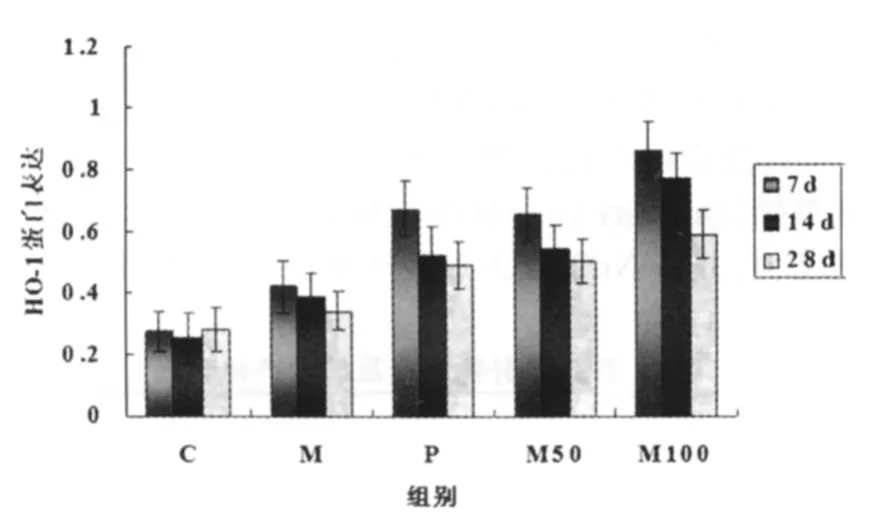
图2 各组大鼠肺组织HO-1蛋白表达的动态变化
表2 各组大鼠肺组织Nrf2mRNA表达的动态变化(±s)

表2 各组大鼠肺组织Nrf2mRNA表达的动态变化(±s)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与泼尼松处理组比较,cP<0.05;与苦参碱100处理组比较,dP<0.05;与本组第7天比较,eP<0.05
组别 第7天 第14天 第28天正常对照组(C)模型组(M)泼尼松处理组(P)苦参碱50处理组(M50)苦参碱100处理组(M100)1.212±0.403 1.601±0.213a 1.510±0.405abd 1.404±0.321abd 1.821±0.411abc 1.403±0.321 1.005±0.403a 1.313±0.414abd 1.320±0.201abd 1.412±0.502abc 1.215±0.205 0.807±0.443ae 0.932±0.306abde 0.819±0.422abde 0.954±0.403abce
表3 各组大鼠肺组织HO-1mRNA表达的动态变化(±s)

表3 各组大鼠肺组织HO-1mRNA表达的动态变化(±s)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与泼尼松处理组比较,cP<0.05;与苦参碱100处理组比较,dP<0.05;与本组第7天比较,eP<0.05
组别 第7天 第14天 第28天正常对照组(C)模型组(M)泼尼松处理组(P)苦参碱50处理组(M50)苦参碱100处理组(M100)0.425±0.035 0.601±0.051a 1.083±0.058abd 1.004±0.321abd 1.234±0.073abc 0.372±0.028 0.585±0.042a 0.821±0.059abd 0.815±0.201abd 0.995±0.060abc 0.285±0.031 0.591±0.045ae 0.772±0.056abde 0.752±0.422abde 0.781±0.072abce
经直线相关分析,结果显示Nrf2蛋白/mRNA表达与HO-1蛋白/mRNA表达均呈正相关(P<0.05)。
3 讨论
3.1 大鼠肺纤维化动物模型的评价
博来霉素是一组多肽类抗肿瘤抗生素,可引起肺纤维化,其公认机制为在氧分子和亚铁离子存在下,博来霉素产生活性氧(ROS),引起肺纤维化,目前已用作研究肺纤维化的经典模型[7]。实验结果HE染色示模型组第28天大量肺泡结构萎陷,肺泡间隔及部分肺泡腔被胶原和纤维蛋白占据,证明肺纤维化造模成功。
3.2 大鼠肺组织中Nrf2、HO-1基因表达的动态变化
Nrf2在抗氧化剂应激元件(ARE)介导的抗氧化基因表达中起重要的作用,在细胞氧化应激时,Nrf2可能进入细胞核与ARE结合,导致下游GSTs、谷氨酸-半胱氨酸连接酶、HO-1和硫氧还蛋白基因的转录活化。HO-1为一种热休克蛋白,为诱导型血红素氧合酶,对大鼠肺组织纤维化有保护性作用[8],其机制是多种因素容易将HO-1时HO的诱导形式影响,诱导肺HO-1 mRNA的转录,引起肺HO-1蛋白合成和活性增加,肺组织HO-1合成增加并释放,使得外周HO-1活性增强。另外还可能激活了缺氧诱导因子(HIF-1),HO-1基因163-pb片段上的位点与HIF-1结合,调节HO-1mRNA基因转录[9];氧化反应导致的体内氧自由基增多,炎性细胞因子的分泌增加,酸中毒导致的游离钙增加均可直接诱导HO-1的表达[10]。
本文结果显示,博来霉素诱导的肺纤维化模型中,Nrf2、HO-1在模型组表达较正常对照组增高(P<0.05),且表达量从第7天后就逐步减低,第28天表达最低峰,但仍高于正常对照组。这是由于博来霉素气管内注入后大鼠肺组织第7天处于炎症及氧化应激高峰期,机体产生应激反应,诱导Nrf2的表达,产生下游HO-1等抗氧化物质来对抗炎症反应,从而保护机体免受损伤。在28天时,肺纤维化已经基本形成,氧化应激因素已经比较轻,因此表达最低。干预组与模型组变化趋势一致,但Nrf2、HO-1表达显著高于模型组和正常对照组。这表明通过提高抗氧化转录因子Nrf2及其靶基因之一的HO-1表达可以保护肺组织,减轻肺纤维化程度。而模型组中抗氧化基因Nrf2及HO-1表达增加,却仍然无法阻止肺纤维化的进展,考虑可能因素肺纤维化形成过程早期主要是启动炎症及免疫反应,同时启动了氧化应激反应,使机体处于氧化和抗氧化失平衡状态。
3.3 苦参碱对大鼠肺纤维化的干预作用
本文结果显示苦参碱[100 mg/(kg·d)]能显著减轻大鼠肺组织肺泡炎的程度,但仍较正常对照组重。苦参碱有一定的抗炎作用,但低剂量[50 mg/(kg·d)]苦参碱在减轻肺泡炎程度上与泼尼松处理组比较统计学差异不明显;苦参碱在剂量较大时[100 mg/(kg·d)],其抗炎作用较泼尼松处理组强。推测苦参碱可能主要通过抑制炎性细胞(如巨噬细胞等)、减少炎性介质的产生来减轻炎症程度。苦参碱100处理组肺组织中Nrf2、HO-1表达明显较其他组在第7、14天增多,具体机制可能与氧化应激时抗氧化有关,如通过Nrf2的高表达来调控HO-1等下游抗氧化物质。泼尼松龙的干预作用与低剂量苦参碱作用相似,二者之间无统计学差异,这表明苦参碱100处理组可能是通过诱导Nrf2的高表达来促使下游抗氧化物质如HO-1的大量生成,从而在纤维化早期及炎症期抑制肺纤维化的发展。
苦参碱有抑制博来霉素诱导的大鼠肺纤维化作用,其机制可能与早期上调Nrf2、HO-1表达调节抗氧化应激有关。苦参碱有望成为临床治疗肺间质性疾病的一类新药。
[1]Eric SW,Michael H,Victor J.Thannickal pathogenetic mechanisms in usual interstitial pneumonia/idiopathic pulmonaryfibrosis[J].J Pathol,2003,201:343-354.
[2]Xuchen Zhang,Peiying Shan,Ge Jiang,et al.Endothelial STAT3 is essential for the protective effects of HO-1 in oxidant-induced lung injury[J].FASEB J,2006,20:2156-2158.
[3]Zuo F,Kaminski N,Eugui E,et al.Gene expression analysis reveals matrilysin as a key regulator of pulmonary fibrosis in mice and humans[J].Proc Natl Acad Sci USA,2002,99:6292-6297.
[4]刘梅,刘雪英,程建锋.苦参碱的药理研究进展[J].中国中药杂志,2003,28:801-804.
[5]Zhang JP,Zhang M,Zhou JP,et al.Antifibrotic effects of matrine on in vitro and in vivo models of liver fibrosis in rats[J].Acta Pharmacol Sin,2001,22:183-186.
[6]胡迎春,欧阳静萍,李艳琴,等.苦参碱对醛固酮诱导大鼠心肌成纤维细胞细胞周期和增殖细胞核抗原表达的影响[J].武汉大学学报:医学版,2004,25:224-227.
[7]Hanniakal VJ,Horowitz JC.Evolving concepts of apoptosis in idiopathic pulmonary fibrosis[J].Proc Am Thorac Soc,2006,3(4):350-356.
[8]Fredenburgh E,Perrella MA,Mitsialis AS.The role of heme oxygenase-1 in pulmonary disease laura[J].Am J Respir Cell Mol Biol,2007,36:158-165.
[9]Ningjun LI,Fan YI,Christina M,et al.Expression and actions of HIF prolyl-4-hydroxylase in the rat kidneys[J].Am J Physiol Renal Physiol,2007,292:207-216.
[10]Massimo Bolognesi,David Sacerdoti,Anna Piva,et al.Monoxide-mediated activation of large-conductance calcium-activated potassium channels contributes to mesenteric vasodilatation in cirrhotic rats[J].Pharmacol Exp Ther,2007,321:187-194.
