继发性骨质疏松症治疗
2012-12-23北京协和医院内分泌科姜艳孔晶邢小平
北京协和医院内分泌科 姜艳 孔晶 邢小平
继发性骨质疏松症是指由于某些疾病、药物或其他原因造成骨量降低,骨骼的微结构发生改变,易发生脆性骨折的疾病[1]。常见的继发性原因见表1[2,3],诊断原发性骨质疏松症必须先排除继发性骨质疏松的可能。尤其是男性以及绝经前女性发生脆性骨折, 或者脆性骨折发生于抗骨质疏松治疗时,应该警惕继发性骨质疏松症的可能。一些绝经后女性有继发性骨质疏松的高危险因素时也应进行相关评价。
这些继发性因素通过影响成骨细胞和破骨细胞功能,使骨吸收增加和/或骨形成减低而导致骨质疏松,其中OPG/RANK/RANKL是重要的调节破骨细胞活性的通路,OPG与RANKL的比值是维持正常骨转化的关键因素,许多激素、生长因子(肿瘤生长因子-β、IGF-1、BMP2),细胞因子(白介素-1、白介素-6、肿瘤坏死因子-α、前列腺素E2),某些药物也能影响该通路(表2)[4-7]。其他致骨质疏松机制有待进一步研究。
继发性骨质疏松常见于男性以及绝经前妇女,据国外文献报道有接近三分之一的女性骨质疏松患者可找到继发性因素,而男性此比例高达50%~80%[8]。由于这些人群通常不进行骨质疏松筛查,加上原发病的多样性及少见性,所以给继发性骨质疏松的诊断带来挑战。如果漏诊原发病,常规的抗骨质疏松治疗效果并不理想。
目前,对于继发性骨质疏松的诊断依赖于详细的病史,包括骨质疏松性骨折危险因素、相关疾病史、药物使用史、完整的体格检查,以及辅助检查。
国外一项对664名绝经后骨质疏松妇女调查[9],结果显示仅从病史可以筛选出173/664名(26%)存在继发性骨质疏松的危险。进行血常规、血钙、血磷、肝功能、肌酐、白蛋白、PTH、25-OHD,24h尿钙/肌酐值以及TSH后,发现56/173名(32%)女性有病因明确并可治疗的继发性骨质疏松。最常见的原发病为高尿钙(10%)、吸收障碍(8%)、甲状旁腺功能亢进(7%)、维生素D缺乏(4%),以及甲状腺功能亢进。因此,在诊断原发性骨质疏松时,必须先排除继发性骨质疏松的可能。
双能X线吸收测定法(DEXA)测骨密度可以初步诊断有无骨质疏松。脊柱X线平片判断有无脊柱骨折、溶骨性破坏,以及肿瘤性改变。先行初步实验室检查,包括血常规、尿常规、肝肾功能、血电解质(血钙、血磷、血镁)、C反应蛋白、碱性磷酸酶、血糖。用于初步筛选血液系统疾病、肝肾疾病、慢性炎症或感染、原发性甲状旁腺功能亢进、骨髓瘤、Paget病,以及骨软化症。然后,根据需要选择的实验室检查,如血沉判断有无慢性炎症反应以筛选炎症性肠病、风湿性疾病,类风湿因子等免疫指标可进一步诊断风湿性疾病,性激素(睾酮、雌激素、卵泡刺激素、黄体生成素)判断有无性腺功能减低,泌乳素以排除泌乳素瘤,血或尿皮质醇及地塞米松抑制试验以诊断库欣综合征,甲状旁腺激素(PTH)判断甲状旁腺功能亢进,促甲状腺激素(TSH)判断有无甲状腺功能亢进以及甲状腺素过量替代治疗,25羟维生素D判断体内维生素D水平,24h尿钙判断高尿钙,血/尿蛋白电泳以排除骨髓瘤,必要时还可以进行骨活检。
继发性骨质疏松的治疗原则,首先要治疗原发病,其次为抗骨质疏松治疗并防止骨折发生,注重以患者为中心的个体化疗法。由于继发性因素的多样性,在这一领域进行的随机对照试验很少,所以治疗意见多是来源于临床经验,循证医学证据略显不足。
在抗骨质疏松的药物治疗上,主要有以下几种药物:
1. 维生素D和钙剂
在除外高钙血症等情况后应酌情保证充足的维生素D以及钙剂摄入。成人钙剂推荐摄入元素钙800mg/d,绝经后妇女和老年人1000mg/d[10]。如果饮食中的钙摄入不足,可选择药物补充。维生素D推荐剂量成年人400IU/d,老年人为400~800IU/d。目标为维持正常的钙平衡和25羟维生素D水平。在肾功能正常情况下,血PTH水平恢复至正常水平,表示维生素D缺乏状态被纠正。
2. 双膦酸盐
在继发性骨质疏松的治疗中应用广泛,可以抑制骨吸收,增加骨密度,在糖皮质激素、男性性腺功能低下引起的骨质疏松治疗中能够减少骨折发生。除口服双膦酸盐以外,一些依从性差、吸收不良或胃肠道耐受性差的患者可以选用静脉用药(伊班膦酸钠、唑来膦酸)。
3. 甲状旁腺激素
特立帕肽适用于严重的糖皮质激素引起的骨质疏松(GIOP)、严重男性骨质疏松伴发骨折的患者,能够增加骨密度,减少骨折发生。
4. 锶盐、RANKL拮抗剂地诺塞麦、第三代雌激素受体调节剂、组织蛋白酶K抑制剂
这些药物逐渐应用于继发性骨质疏松症的治疗,尚有待进一步验证。
下面着重对常见的内分泌疾病、风湿性疾病、胃肠道疾病,以及某些药物引起的骨质疏松的机制和治疗方法作一论述。
糖皮质激素引起的骨质疏松(GIOP)
内分泌腺体分泌过量(如库欣综合征)或者外源性应用(如治疗风湿性疾病时)超过生理量的糖皮质激素是继发性骨质疏松的常见原因[11]。通过抑制Wnt信号通路,抑制成骨细胞生成、促进其凋亡而降低骨形成,通过降低OPG/RANKL比值,促进破骨细胞生成,抑制其凋亡,最终使骨吸收增加、骨形成下降形成骨质疏松[12]。糖皮质激素还能作用于神经内分泌系统,使性激素分泌下降,以及通过减低肠钙吸收、增加尿钙排出使血钙下降继发甲状旁腺功能亢进,促进骨吸收导致骨质疏松。对于肌肉,糖皮质激素可促使肌原纤维中的蛋白水解使肌力下降,增加跌倒风险,最终导致骨折风险增加。在使用糖皮质激素替代治疗患者中,持续使用3~6个月骨折风险增加明显[13],每日使用量与骨折风险呈正相关,而停止治疗后风险下降[14]。
治疗中,保证充足的维生素D和钙剂的摄入,还要预防跌倒,双膦酸盐对GIOP治疗效果明显,口服阿仑膦酸盐(10mg/d)以及利塞膦酸盐(5mg/d)能够增加BMD以及减低脊柱骨折的发生率[14,15]。在一项12个月的研究中,静脉用唑来膦酸较口服利塞膦酸盐对于防止GIOP患者骨量丢失的效果更明显[16]。由于GIOP较其他骨质疏松患者更易骨折,推荐BMD的T值<-1.5或者有骨质疏松性骨折史的GIOP患者开始使用双膦酸盐治疗。甲状旁腺激素能明显提高GIOP患者的骨密度,减少骨折[17]。
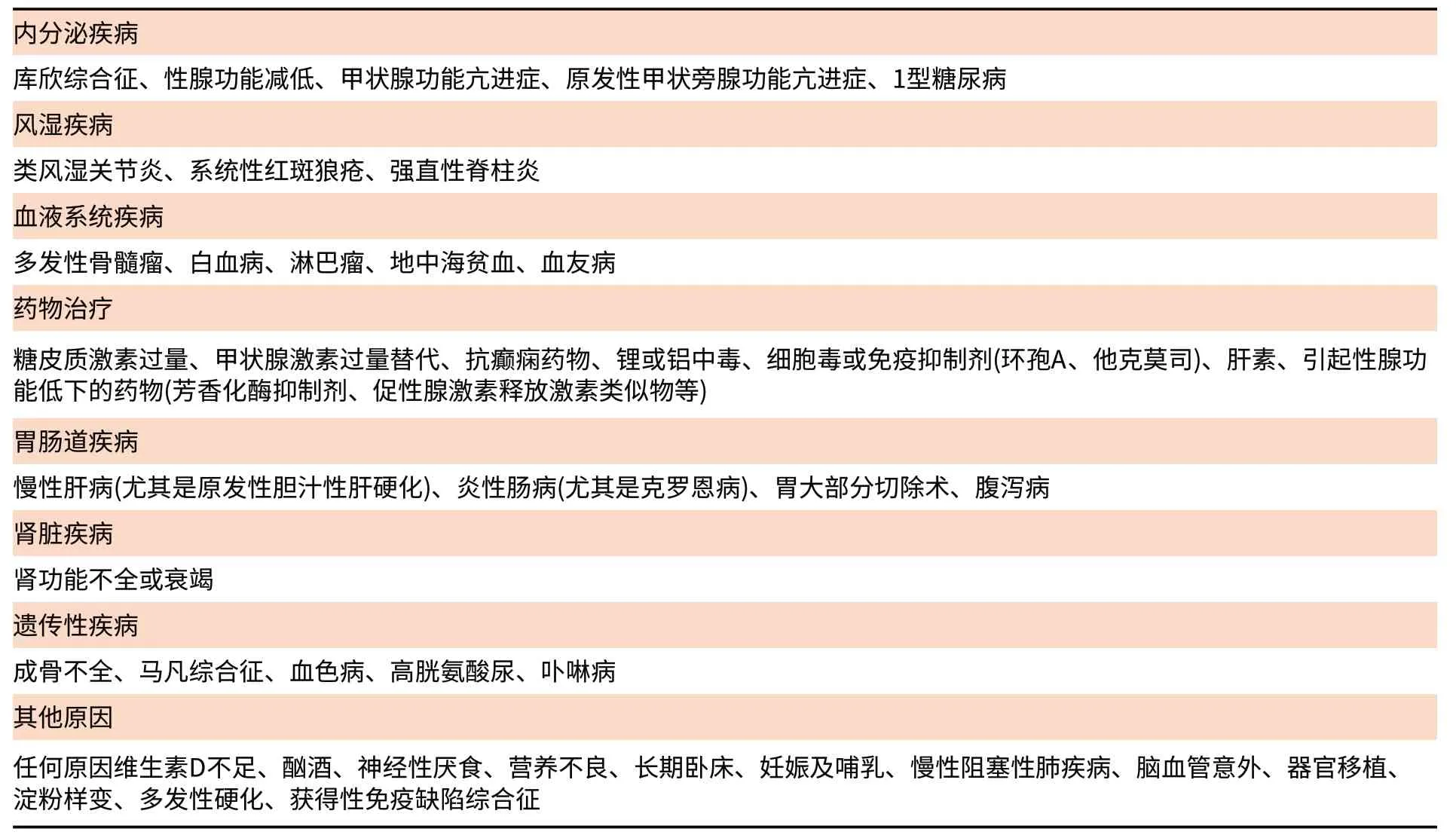
表1 常见的继发性骨质疏松的原因
原发性甲状旁腺功能亢进引起的骨质疏松
原发性甲状旁腺功能亢进是指甲状旁腺增生、腺瘤或腺癌自主性分泌过多的PTH,引起钙、磷和骨代谢紊乱的一种全身性疾病。血中PTH过多,会造成破骨细胞功能增强,骨吸收增加,骨钙大量释放入血;同时肠钙吸收和尿钙重吸收都增加,引起高钙血症,出现骨质疏松,同时可以有骨质软化的表现。
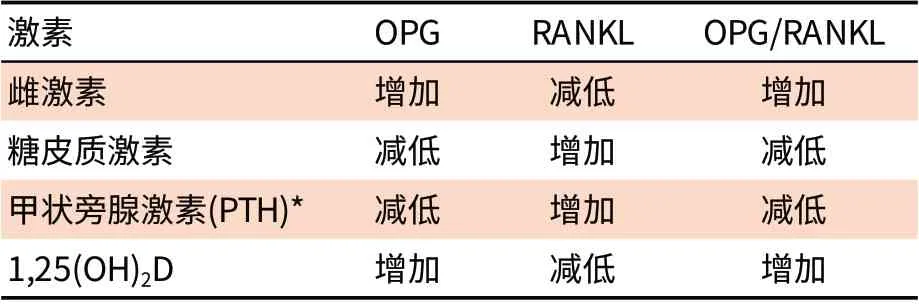
表2 激素对OPG/RANKL比值的影响
原发性甲状旁腺功能亢进引起的骨质疏松的治疗目标是提高骨密度以及维持钙平衡,方式以手术切除增生、腺瘤或腺癌组织为主,术后辅以维生素D和钙剂促进骨骼修复,术后骨转换的生化指标和BMD可逐渐恢复正常。没有手术条件的患者或者术后高血钙不能缓解的患者,可选择雌激素替代疗法。雷洛昔芬作为选择性雌激素受体调节剂(SERMs),少数患者以每天60mg或者120mg的剂量接受1年治疗后,血钙下降,骨转换指标下降,但对PTH水平没有影响[18]。不同的双膦酸盐类药物对于原发性甲旁亢治疗效果不同,口服阿仑膦酸钠的疗效最好,在对包括119名绝经后妇女和24名男性患者的2年研究中发现腰椎及股骨颈的骨密度得到明显提高,桡骨骨密度没有明显改变。在其他研究中也发现阿仑膦酸钠能明显降低血钙水平,不过没有长期效果[19]。另外,由于钙是通过作用于甲状旁腺细胞上的钙敏感受体(CaSR),调节PTH释放,拟钙剂如西那卡塞,能够与CaSR结合提高其对细胞外钙的敏感性,抑制PTH释放。一项持续1年的治疗性研究提示,较之于安慰剂,西那卡塞能明显降低原发性甲旁亢患者的血钙、PTH,但是骨转换指标和骨密度没有明显的改变[20]。
甲状腺激素相关的骨质疏松
甲状腺激素对骨骼作用十分重要,儿童时期,分泌缺乏会导致生长延迟,过多分泌则会加速骨生长,骨骺闭合提早,降低终身高。在成人中,三碘甲腺原氨酸(T3)可以调节骨转换,对于维持理想骨强度必不可少。目前研究表明,甲状腺功能亢进会使骨密度下降并增加骨折风险,在包含686名绝经后妇女的研究提TSH<0.1mIU/L的绝经后妇女较TSH正常者骨折风险增加4~5倍[21]。亚临床甲亢也可能使骨密度下降,但并未增加骨折风险[22]。
T3在骨代谢中的作用机制尚未完全阐述清楚。目前研究表明,T3在生长期主要促进合成代谢,在成人促进分解代谢,均通过破骨细胞及成骨细胞上的甲状腺激素受体α(TRα)实现,但其机制是直接还是间接通过其他骨代谢因素还有待明确[23]。甲亢所致的骨质疏松,由于高骨转化率,骨吸收相对骨形成更快,导致的每个骨重塑周期丢失10%的骨量[24]。亚临床的骨折风险不高,推测TSH能独立作用于骨骼,但由于下丘脑-垂体-甲状腺轴的作用,TSH的变化与甲状腺素变化相偶联,对单独研究TSH 带来困难。
在治疗甲状腺激素相关的骨质疏松时,首先,甲亢患者应尽早地治疗甲亢,某些分化型甲状腺癌情况下用甲状腺素抑制TSH时,原则为用尽量低剂量药物使TSH达到需要进行甲状腺素补充治疗的高限水平,因为有研究提示TSH抑制到0.1mIU/L以下时,甲状腺球蛋白浓度不会继续下降,而其他不良反应包括骨质疏松的发生概率却会上升[25]。其次,骨质疏松治疗方面,适当地补充钙剂也是必要的。雌激素替代疗法也能降低甲状腺素相关性骨质疏松带来的骨量丢失。双膦酸盐的应用前景良好[23],但需要进一步的临床试验验证。
原发性胆汁性肝硬化(PBC)导致的骨质疏松
慢性肝脏疾病,包括PBC和原发性硬化性胆管炎等,可以引起代谢性骨病,以骨质疏松为主,骨软化少见。PBC患者中骨质疏松的患病率显著高于其他慢性肝脏疾病。WHO统计的PBC中骨质疏松的患病率为14.2%~51.1%[26]。不同研究结果的差异可能与研究对象的选择、肝硬化程度、肝脏疾病的严重程度,以及性腺功能水平有关。最近的一项对PBC患者大规模对照研究提示,PBC患者腰椎的平均Z值为-0.66,并且与基于年龄、胆红素水平、凝血时间、血清蛋白水平与水肿程度的危险评分是密切相关的[27]。
PBC致骨质疏松机制不明,可能与疾病状态下胰岛素样生长因子(IGF-1) 缺乏、高胆红素血症、性腺功能低下、过量酒精摄入有关,另外,近年来研究提示低维生素D水平、维生素D受体的基因型、OPG缺乏以及肝移植前后使用免疫抑制剂也起了一定作用[28]。
由于骨质疏松性骨折明显降低患者的生活质量,增加患者的死亡率,加之骨骼并发症可以为PBC的首发症状,所以推荐所有的患者尽早接受骨密度测定,早发现早治疗。但由于已有的研究都是基于绝经后女性的小规模试验,而且疗效的评价是骨密度的提高而非临床上骨质疏松性骨折发生率,因此,结果有待进一步的研究。在治疗上,首先,基础治疗必不可少,包括戒烟、戒酒、减少咖啡因摄入,增加负重训练以提高肌肉与骨骼质量,同时,合理使用类固醇激素。其次,补充维生素D和钙剂。推荐所有的PBC患者每天补充1000~1200mg的元素钙,以及至少400~800IU的维生素D,当合并有吸收障碍时需要提高两者的用量[29]。最后,抗骨吸收治疗,双膦酸盐中阿仑膦酸盐较依替膦酸盐提高PBC患者的骨量更明显,进一步研究显示阿仑膦酸钠每周1次的频次较每天1次有更好的耐受性[30]。激素替代疗法由于激素的不良反应而作为二线选择,在PBC患者中研究也较少,疗效不明确。睾酮可用于伴有性腺功能低下的男性患者。除此之外,锶盐、甲状旁腺激素的应用有待研究。
风湿性疾病引起的骨质疏松
风湿性疾病是引起继发性骨质疏松的重要原因,由于疾病引起的全身和局部炎症反应,慢性炎症导致骨量丢失已得到证实,炎性因子、生长因子引起骨质疏松的机制也被广泛研究。他们能引起破骨细胞分化,激活RANK/RANKL通路,引起破骨细胞介导的骨量丢失[30],动物实验中发现缺乏RANKL或者破骨细胞者[3]不会引起侵蚀性关节炎也证实了这一机制。使用糖皮质激素治疗也是造成骨质疏松的原因。另外,系统性红斑狼疮对光敏感使光照减少,造成皮肤合成维生素D缺乏;类风湿关节炎、银屑病关节炎致局部关节疼痛、活动受限等等也促进了骨质疏松的发生[31]。
风湿性疾病引起的骨质疏松有以下治疗原则:首先,对原发病治疗以减轻炎症反应,合理使用糖皮质激素。其次,对于全身/局部骨质疏松,抑制骨吸收治疗双膦酸盐类的应用疗效有待进一步的研究。最后,所有的患者应该补充维生素D和钙剂,同时辅以运动治疗。
其他药物引起的骨质疏松
除了糖皮质激素外,抗癫痫药也能引起骨质疏松和骨软化症,机制为引起肝脏细胞色素P450酶系统介导药物氧化反应和加强类固醇激素在肝脏的转换,血25羟维生素D水平下降。使用抗癫痫药物的患者要鼓励适当的运动锻炼,保证良好营养、注意药物对矿盐和骨的影响,检测骨代谢指标,需要时补充维生素D和钙剂,由于药物引起的维生素D代谢加快,其剂量应高于正常应用剂量。
随着乳腺癌和前列腺癌的高发,对这些肿瘤的抗性腺激素内分泌治疗所引起的骨质疏松引起了重视,加上这类肿瘤本身好发的老年人群就是骨质疏松的危险人群。最近的研究发现,前列腺癌患者进行雄激素剥夺治疗(androgen deprivation therapy,ADT)较于未进行ADT治疗的患者骨吸收增加、骨密度下降、骨折危险性增加。一些研究[32,33]表明在老年未发生骨转移的前列腺癌男性患者,在使用后的6~12月BMD快速下降3%~7%,同时,发生骨折的危险性也较未使用者上升(19.6% vs 12.6%,P<0.001),而且与治疗持续时间相关[34]。乳腺癌患者应用芳香化酶抑制剂以及来曲唑、阿纳托唑、依西美坦这类芳香化酶抑制剂后,较之未使用此类药物的病例对照组,骨吸收指标上升,发生骨折危险性增加[35]。鉴于此,使用以上几类药物时,需要监测BMD以及相关的骨代谢实验室指标,补充足量的维生素D和钙剂。在一些小规模的实验中,有研究者将雌激素以及SERM应用于前列腺癌患者中取得保护骨量的效果,但对于其安全性和疗效有待证实[36]。双膦酸盐已被广泛用于乳腺癌骨转移的治疗中,有研究表明,氯膦酸盐和唑来膦酸盐对于维持接受化疗或者芳香化酶抑制剂乳腺癌患者的BMD有作用[37,38],但其对于骨折风险的改变有待进一步研究。
其他可引起骨质疏松类药物有肝素、环孢A、氨甲喋呤等化疗类药物、酪氨酸激酶抑制剂、噻唑烷二酮类药物、质子泵抑制剂、脂肪酶抑制剂、抗逆转录病毒类药物等。应用时应权衡利弊,出现骨质疏松时可考虑换用其他药物,如用其他糖尿病药物替代噻唑烷二酮类药物。
结 论
发生于男性或者绝经前女性的脆性骨折, BMD极低,骨折发生于抗骨质疏松治疗时应该警惕继发性骨质疏松的可能。应进行髋部和腰椎的BMD测定,有新发脊柱骨折的应另拍摄胸腰椎正侧位片。详细的病史以及体格检查结合初步实验室检查能够筛选病因,然后进一步进行针对性的实验室检查以确诊。治疗方面,原发病的治疗是核心,然后在除外高钙血症等情况后应酌情保证充足的维生素D以及钙剂摄入,使血PTH、25羟维生素D维持在正常水平。口服双膦酸盐能够抑制骨吸收,防止骨量丢失。一些依从性差、吸收不良或胃肠道耐受性差的患者可以选用静脉用药(伊班膦酸钠、唑来膦酸)。特立帕肽适用于严重的GIOP、严重男性骨质疏松伴发骨折的患者。新的治疗方法正在探索中,包括RANKL抑制剂地诺塞麦(denosumab)、第三代雌激素受体调节剂、组织蛋白酶K抑制剂。
[1] Painter SE, Kleerekoper M, Camacho PM. Secondary osteoporosis: a review of the recent evidence[J]. Endocr Pract, 2006, 12: 436-445.
[2] Hofbauer LC, Hamann C, Ebeling PR. Approach to the patient with secondary osteoporosis[J]. Eur J Endocrinol , 2010, 162: 1009-1020.
[3] Kelman A, Lane NE. The management of secondary osteoporosis. Best Pract Res Clin Rheumatol[J]. 2005, 19: 1021-1037.
[4] Kearns AE, Khosla S, Kosteniuk PJ. Receptor activator of nuclear factor kappaB ligand and osteoprotegerin regulation of bone remodeling in health and disease[J]. Endocr Rev, 2008, 29: 155-192.
[5] Pacifici R. Estrogen, cytokines, and pathogenesis of postmenopausal osteoporosis[J]. J Bone Miner Res, 1996, 11: 1043-1051.
[6] Khosla S, Peterson JM, Egan K, et al. Circulating cytokine levels in osteoporotic and normal women[J]. J Clin Endocrinol Metab, 1994, 79: 707-711.
[7] Rosen CJ, Donahue LR, Hunter SJ. Insulin-like growth factors and bone: the osteoporosis connection[J]. Proc Soc Exp Biol Med, 1994, 206: 83-102.
[8] Stein E, Shane E. Secondary osteoporosis [J]. Endocrinol Metab Clin North Am, 2003, 1: 115-134.
[9] Tannenbaum C, Clark J, Schwartzman K, et al. Yield of laboratory testing to identify secondary contributors to osteoporosis in otherwise healthy women[J]. J Clin Endocrinol Metab, 2002, 10: 4431-4437.
[10] 中华医学会骨质疏松和骨矿盐疾病分会.原发性骨质疏松症诊治指南2011年[J]. 中华骨质疏松和骨矿盐疾病杂志, 2011, 4: 2-16.
[11] Canalis E, Mazziotti G, Giustina A, et al. Glucocorticoid-induced osteoporosis: pathophysiology and therapy[J]. Osteoporos Int, 2007, 18: 1319-1328.
[12] Sewerynek E. Current indications for prevention and therapy of steroid-iduced osteoporosis in men and women[J]. Endokrynol Pol, 2011, 62: 38-44.
[13] van Staa TP, Leufkens HG, Cooper C. Does a fracture at one site predict later fractures at other sites? A British cohort study[J]. Osteoporos Int, 2002, 13: 624-629.
[14] Reid DM, Hughes RA, Laan RF, et al. Efficacy and safety of daily risedronate in the treatment of corticosteroid-induced osteoporosis in men and women: a randomized trial. European Corticosteroid-Induced Osteoporosis Treatment Study [J]. J Bone Miner Res, 2000, 15: 1006-1013.
[15] Reid DM, Devogelaer JP, Saag K, et al. Zoledronic acid and rise dronatein the prevention and treatment of glucocorticoid-induced osteoporosis(HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial[J]. Lancet, 2009, 373: 1253-1263.
[16] Saag KG, Emkey R, Schnitzer TJ, et al. Alendronate for the prevention and treatment of glucocorticoid-induced osteoporosis. Glucocorticoid-Induced Osteoporosis Intervention Study Group[J]. N Engl J Med, 1998, 339: 292-299.
[17] Rehman Q, Lang TF, Arnaud CD, et al. Daily treatment with parathyroid hormone is associated with an increase in vertebral crosssectional area in post menopausal women with glucocorticoid-induced osteoporosis[J]. Osteoporos Int, 2003, 14(1): 77-81.
[18] Udell JA, Fischer MA, Brookhart MA, et al. Effect of the Women's Health Initiative on osteoporosis therapy and expenditure in Medicaid[J]. J Bone Miner Res, 2006, 21(5): 765-771.
[19] Fraser WD. Hyperparathyroidism[J]. Lancet, 2009, 374: 145-158.
[20] Peacock M, Bilezikian JP, Klassen PS, et al. Cinacalcet hydrochloride maintains long-term normocalcemia in patients with primary hyperparathyroidism[J]. J Clin Endocrinol Metab, 2005, 90: 135-141.
[21] Bauer DC, Ettinger B, Nevitt MC, et al. Risk for fracture in women with low serum levels of thyroid-stimulating hormone[J]. Ann Intern Med, 2001, 134: 561-568.
[22] Lakatos P. Thyroid hormones: beneficial or deleterious for Bone? [J].Calcif Tissue Int, 2003, 73: 205-209.
[23] Williams GR. Actions of thyroid hormones in bone [J]. Endokrynol Pol, 2009, 60: 380-388.
[24] Mosekilde L, Eriksen EF, Charles P. Effects of thyroid hormones on bone and mineral metabolism[J]. Endocrinol Metab Clin North Am, 1990, 19: 35-63.
[25] Muller CG, Bayley TA, Harrison JE, et al. Possible limited bone loss with suppressive thyroxine therapy is unlikely to have clinical relevance[J]. Thyroid, 1995, 5: 81-87.
[26] Kanis JA. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis: synopsis of a WHO report. WHO Study Group[J]. Osteoporos Int, 1994, 4: 368-381.
[27] Eastell R, Dickson ER, Hodgson SF, et al. Rates of vertebral bone loss before and after liver transplantation in women with primary biliary cirrhosis[J]. Hepatology, 1991, 14: 296-300.
[28] Wariaghli G, Allali F, El Maghraoui A, et al. Osteoporosis in patients with primary biliary cirrhosis[J]. Eur J Gastroenterol Hepatol, 2010, 22: 1397-1401.
[29] Walsh NC, Gravallese EM. Bone loss in inflamatory arthritis: mechanisms and treatment strategies[J]. Curr Opin in Rheumatol, 2004, 16: 419-427.
[30] Guañabens N, Pares A. Management of osteoporosis in liver disease [J]. Clin Res Hepatol Gastroenterol, 2011, 35: 438-445.
[31] Orstavik RE, Haugeberg G, Uhlig T, et al. Self reported non-vertebral fractures in rheumatoid arthritis and population based controls: incidence and relationship with bone mineral density and clinical variables[J]. Ann Rheum Dis, 2004, 63: 177-182.
[32] Mittan D, Lee S, Miller E, et al. Bone loss following hypogonadismin men with prostate cancer treated with GnRH analogs[J]. J Clin Endocrinol Metab, 2002, 87: 3656-3661.
[33] Daniell HW, Dunn SR, Ferguson DW, et al. Progressive osteoporosis during androgen deprivation therapy for prostate cancer[J]. J Urol, 2000, 163: 181-186.
[34] Shaninian VB, Kuo YF, Freeman JL, et al. Risk of fracture after androgen deprivation for prostate cancer[J]. N Eng J Med, 2005, 352: 154-164.
[35] Howell A, Cuzick J, Baum M, et al. Results of the ATAC(Arimidex, Tamoxifen, Alone, or in Combination) trial after completion of 5 years’ adjuvant treatment for breast cancer[J]. Lancet, 2005, 365: 60-62.
[36] Ockrim JL, Lalani EN, Banks LM, et al. Transdermal estradiol improves bone density when used as single agent therapy for prostate cancer[J]. J Urol, 2004, 172: 2203-2207.
[37] Powles TJ, McCloskey E, Paterson AH, et al. Oral clodronate and reduction in loss of bone mineral density in women with operable primary breast cancer[J]. J Natl Cancer Inst, 1998, 90: 704-708.
[38] Saarto T, Blomqvist C, Valimaki M, et al. Chemical castration by adjuvant cyclophosphamide, methotrexate, and fluorouracil chemotherapy causes rapid bone loss that is reduced by clodronate: a randomized study in premenopausal breast cancer patients[J]. J Clin Onco, 1997, 15: 1341-1347.