Gli-1基因的RNAi对前列腺癌DU145细胞的影响
2012-12-19孙晓青
何 斌 孙晓青
1)徐州医学院肿瘤生物治疗实验室 徐州 221002 2)徐州医学院附属医院泌尿外科 徐州 221002
Gli-1基因的RNAi对前列腺癌DU145细胞的影响
何 斌1)孙晓青2)
1)徐州医学院肿瘤生物治疗实验室 徐州 221002 2)徐州医学院附属医院泌尿外科 徐州 221002
目的 研究胶质瘤相关癌基因1(Gli-1)对前列腺癌DU145细胞的生物学影响。方法 通过脂质体介导的方法将Gli-1 SiRNA转染前列腺癌DU145细胞,RT-PCR检测Gli-1 mRNA变化,Western Blot法检测其蛋白的表达,CCK-8法检测转染后细胞增殖,运用Transwell小室法检测细胞侵袭能力的变化。结果 转染Gli-1SiRNA的细胞Gli-1的表达明显低于阴性对照组(NC)与空白组(P﹤0.05),Gli-1SiRNA抑制细胞增殖并降低细胞的侵袭能力。结论 Gli-1 SiRNA可抑制前列腺癌DU145细胞中Gli-1的表达,降低细胞增殖率和侵袭能力,提示Gli-1可能在前列腺癌的恶性进展中起着重要作用。
前列腺癌;Gli-1;SiRNA;侵袭
前列腺癌是生殖系最常见的恶性肿瘤之一,晚期易进展为非激素依赖性前列腺癌。近年来发现Hh(Hedgehog)-Gli信号通路在前列腺癌发生发展中其关键作用,而Gli-1作为该通路下游转录激活子在肿瘤研究中受到广泛关注[1],DU145为雄激素非依赖性细胞,侵袭力强且高表达Gli-1[2],鉴于此本研究构建针对Gli-1基因的小分子干扰RNA(small interfering RNA,SiRNA)序列,转染入DU145细胞,观察SiRNA对DU145细胞增殖和侵袭能力的影响,有望为非雄激素依赖性前列腺癌治疗提供新的思路和方法。
1 材料和方法
1.1 材料根据Genbank报道的homo Gli-1(Gene ID 2735)由上海吉玛制药技术有限公司合成Gli-1SiRNA双链,序列见表1。人前列腺癌 DU145细胞株购自中科院上海细胞研究所,Ham’s F12培养基、胎牛血清(Fatal bovine serum,FBS)为Hyclone公司产品,LipofectamineTM2000为Invitrogen公司产品,RNA提取试剂盒购自北京TIANGEN公司,RT-PCR试剂盒购自宝生物工程(大连)有限公司,引物由上海生工合成,RIPA裂解液和BCA蛋白浓度测定试剂盒(增强型)购自碧云天公司,Gli-1多克隆抗体为武汉博士德公司产品,CCK-8购自日本株式会社同仁化学研究所,Matrigel基质胶为BD公司产品,纤维粘连蛋白(fibibronectin,FN)为Sigma公司产品,Transwell小室为Corning公司产品。
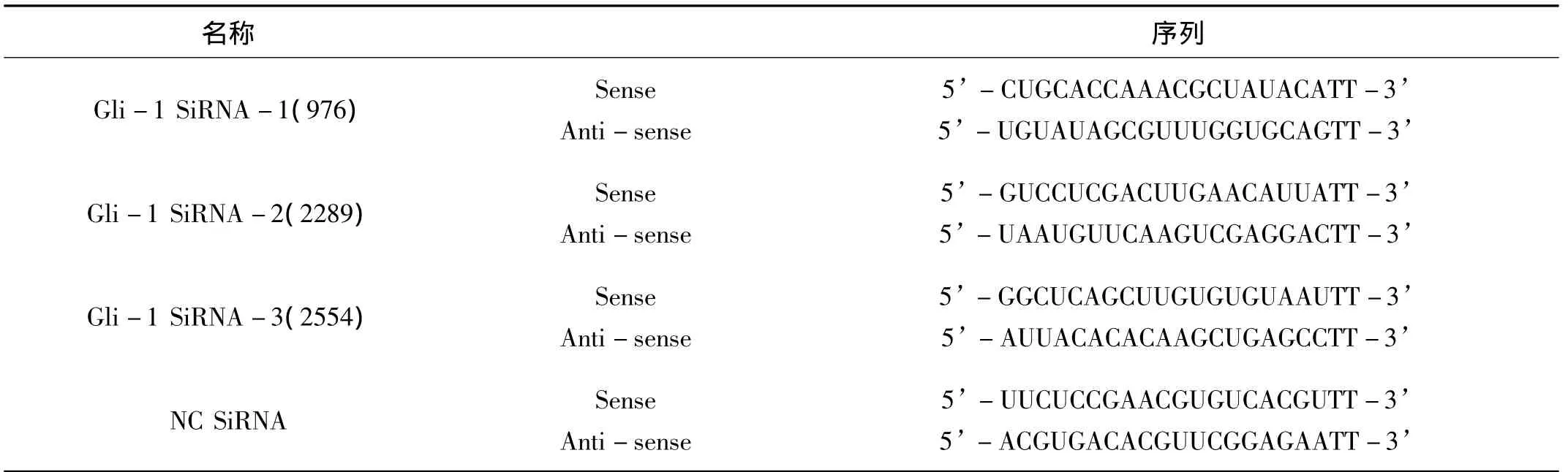
表1 Gli-1 SiRNA序列
1.2 DU-145细胞的培养及转染DU-145细胞用含10%FBS的Ham’sF12的培养液置于37℃、5%CO2、饱和湿度的培养箱中培养,取生长良好且处于对数生长期的细胞以2.5×105个/孔的密度接种于6孔板,待细胞融合达50%,参照吉玛公司SiRNA使用指南配制脂质体与SiRNA复合物转染DU145细胞。实验分为3组:(1)未转染SiRNA的空白组。(2)转染NC SiRNA的阴性对照组⑶转染Gli-1 SiRNA的实验组。
1.3 RT-PCR检测RNAi后Gli-1 mRNA变化DU145转染后48 h,加入Trizol 1mL按照其说明书总提RNA,将RNA浓度调至0.5μg/μL。取 RNA 4μL逆转录合成 cDNA,用 dNTP(10 mmol/L)1μL,Mgcl2(25 mmol/L)4μL,10×B μffer 5 μL,上下游引物(10 μM)2 μL,DNA聚合酶0.3μL,cDNA 5μL,无核酶水32.7μL的反应体系进行PCR。Gli-1上游引物:GGACAACCGCCATCCAGACT,下游引物:GCCAGGGACACCTCCATCTC,产物长度363bp;β-actin上游引物GTTGCTATCCAGGCTGTGC,下游引物GCATCCTGTCGGCAATGC,产物长度248 bp。扩展条件如下:95℃预变性5 min,94℃变性45 s,56℃退火30 s,72℃延伸60 s,共35个循环,再72℃延伸5 min。将RT-PCR产物进行琼脂糖凝胶电泳,数字成像系统拍照分析。
1.4 Western Blot法检测RNAi后Gli-1蛋白的表达取转染48 h后各组细胞,收集细胞提取蛋白,取BCA法蛋白定量后每个泳道加50 μL蛋白样品,10%聚丙烯酰胺凝胶电泳分离,将蛋白转移到硝酸纤维素膜(NC)上,5%脱脂牛奶封闭1 h,一抗4℃孵育过夜,TBST洗涤,二抗室温孵育2 h,NBT/BCIP显色。蛋白条带以β-actin为参照,测定数据以各组条带的吸光度/对照组条带吸光度表示,筛选最优干扰组。
1.5 CCK-8检测RNAi后DU145细胞增殖情况将DU145以胰酶消化计数后接种于96孔板上,每孔约1000个细胞,进行转染并分为3组:空白组,NC组与Gli-1 SiRNA最优干扰组。置入培养箱中24 h,每隔24 h在各组待测孔中加入10μL CCK-8,置于培养箱中培养2 h,在酶标仪上以波长450 nm检测待测孔光密度值,每组每次6复孔,计算平均值与标准差,连测3 d,绘制细胞生长曲线,重复3次。
1.6 细胞侵袭实验检测RNAi后侵袭能力Transwell小室上室加入50μL稀释的Matrigel基质胶,下室加入的10μg/mL的FN 50μL,超净台风干过夜。用前以无血清培养基水化基底膜置入37℃培养箱孵育1 h。取转染24 h各组细胞,无血清培养基制备成2×105/mL的细胞悬液,取200 μL细胞悬液,接种至Transwell上室铺匀,在下室内加入含10%FBS的培养基600 μL,每组设3个复孔,常规培养36 h。取出Transwell小室,棉签擦去上室细胞,95%甲醇固定30min,结晶紫染色30min,PBS冲洗,镜下随机选取4个视野,计数穿膜细胞数。
1.7 统计学处理计量资料以均数±标准差表示,应用SPSS 13.0统计分析软件对实验数据进行统计学处理,采用单因素方差分析进行数据分析,P<0.05为差异有统计学意义。
2 结果
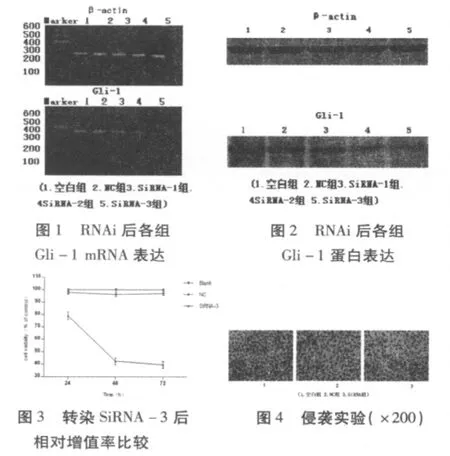
2.1 Gli-1 SiRNA下调DU145细胞中Gli-1的Mrna结果显示,实验组Gli-1 mRNA表达均低于阴性对照组和空白对照组,差异有统计学意义(P<0.05),mRNA表达量(%)分别为阴性对照组98.2±6.6,SiRNA-1为63.3±3.2,SiRNA-2为53.8±4.6,SiRNA-3为38.4±4.0,以SiRNA-3沉默效果最佳。见图1
2.2 Gli-1 SiRNA抑制DU145细胞中Gli-1的蛋白表达结果显示,实验组Gli-1蛋白表达均低于阴性对照组和空白对照组,差异有统计学意义(P<0.05),蛋白表达量(%)分别为阴性对照组94.9±7.9,SiRNA-1组55.7±5.6,SiRNA-2组42.6±3.2,SiRNA-3组31.9±5.1,SiRNA-3确为最佳干扰组。见图2
2.3 Gli-1 SiRNA抑制DU145细胞的增殖结果显示,实验组增殖低于阴性对照组和空白对照组,差异有统计学意义(P<0.05),72 h相对增值率(%)分别为阴性对照组(97.1±1.8)%,SiRNA-3组39.6±2.6。见图3
2.4 Gli-1 SiRNA减弱DU145细胞的侵袭力在沉默Gli-1基因表达后,DU145细胞在Transwell小室内的穿膜细胞数(个)分别为空白对照组269±15,阴性对照组263±21,SiRNA-3组165±24,差异有统计学意义(P<0.05)。表明SiRNA-3可降低细胞侵袭能力。见图4
3 讨论
Hh-Gli信号通路的异常激活在人类恶性肿瘤的发生发展中起着重要作用,其中包括前列腺癌[3],通路在调控前列腺发育与前列腺癌的发生、发展与激素抵抗等方面发挥的重要作用已被多数研究证实[2,4-5],2005年美国国家癌症研究所将该通路列为前列腺癌靶向治疗的靶标,雄激素受体排次要地位[6]。该信号通路由Hh基因,跨膜受体smo与ptch,转录因子Gli家族(Gli-1、Gli-2、Gli-3)与下游目的基因构成,Hh基因编码一系列糖蛋白,当没有Hh信号分子时,Smo被Ptch所抑制,阻碍信号转导;当Hh信号分子存在时,Ptch与Hh蛋白结合,解除了对Smo的抑制,Smo活化后向胞内传递信号给Gli,Gli进入细胞核以后激活目的基因转录[7]。Gli家族作为该通路最后一环,各成员的功能并不完全相同,多数情况下Gli-2与Gli-1功能一致,为Hh-Gli通路下游转录激活子,而Gli-3则起抑制作用[1]。
Gli-1作为Hh-Gli通路下游被广泛承认的转录激活因子,并可作为Shh-Gli通路活化的标记,这一点已为大众认知[8]。Gli-1通过以下机制诱导肿瘤产生:上调细胞周期调节分子Cyclin D2表达量促进细胞有丝分裂,不断增殖[9];激活抗凋亡因子bcl-2转录活性来抑制凋亡;激活VEGF、Cyclin D等提高细胞侵袭转移能力,且参与肿瘤细胞增殖或扩散的效应分子(如BMP、Cyclin D等)已被证实为Hh-Gli通路的下游分子[10]。Sanchez等使用RT-PCR对肿瘤标本进行检测,发现标本中Gli-1高度表达[11]。Karhadkar等发现在前列腺癌细胞系(PC-3、DU-145、LnCAP及CWR22RV1)均有Gli-1高表达,增加Gli的异位表达则可促使低转移前列腺癌细胞向高转移性癌细胞转化[2]。目前针对Hh信号通路的环靶明等药物只能针对Hh通路上游基因突变导致的肿瘤有效,在Smo级联反应以下的一些参与Hh通路调控的分子变化则没有意义且毒性较大限制了在临床上的应用。作为Hh通路的最终效应蛋白,针对Gli直接对Hh通路下游目的基因的激活进行阻断,可以更好的抑制前列腺癌细胞的增殖、分化及侵袭。
在本实验中,通过使用Gli-1 SiRNA阻断Hh-Gli-1通路,发现可以明显减少前列腺癌 DU145细胞中Gli-1基因mRNA及其蛋白的表达,明显抑制该细胞生长、侵袭能力,表明了Gli-1 SiRNA可以特异性抑制内源基因表达,抑制DU145细胞增殖和体外侵袭能力,为前列腺癌的基因治疗提供了新的思路。
[1]Buttitta L,Mo R,Hui CC,et al.Interplays of Gli2 and Gli3 and their requirement in mediating Shh-dependent sclerotome induction[J].Development,2003,130:6 233-6 243.
[2]Karhadkar SS,Bova GS,Abdallah N,et al.Hedgehog signalling in prostate regeneration,neoplasia and metastasis[J].Nature,2004,431:707-712.
[3] Vassiliki Tzelepi,Maria Karlou,Sijin,et al.Expression of hedgehog pathway compo-nents in prostate carcinoma microenvironment:shifting the balance towards autocrine signaling[J].Histopathology,2011,58(7):1 037-1 047.
[4]Zhu G,Zhua HE,He H,et al.Sonic and desert hedgehog signaling in human fetal prostate development[J].Prostate,2007,67(6):674-684.
[5]Shaw G,Price AM,Ktori E,et al.Hedgehog signaling in androgen independent prostate cancer[J].Eur Urol,2008,54 (6):1 333-1 343.
[6]Vanchieri C.Scientists hopeful as they uncover molecular clues to prostate cancer[J].JNCI,2005,97:168-169.
[7]Kayed H,Kleeff J,Osman T,Keleg S,Buchler MW,Friess H.Hedgehog signaling in the normal and diseased pancreas[J].Pancreas,2006,32(2):119-129.
[8]Mao J,Maye P,Kogerman P,et al.Regulation of Gli1 transcriptional activity in the nucleus by Dyrk1[J].Biol Chem,2002,277(38):35 156-35 161.
[9]Duman-Scheel M,Weng L,Xin S,Du W.Hedgehog regulates cell growth and pro-liferation by inducing Cyclin D and Cy-cline[J].Nature,2002,417(6886):299-304.
[10]Keping Xie,James L Abbruzzese.Developmental biology informs cancers[J].Cancer Cell,2003,4(4):245-247.
[11] Sanchez P,Hernandez AM,Stecca B,et al.Inhibition of prostate cancer proliferation by interference with sonic hedgehog-gli1 signaling[J].Proc Natl Acad Sci,2004,101 (34):12 561-12 566.
R737.25
A
1007-8991(2012)05-0018-04
(收稿 2012-03-27)
