自噬抑制剂3-MA对乳胞素抑制胃癌BGC-823细胞增殖的影响及其机制
2012-12-17金镇勋兰汝春董长松吉林医药学院附属医院消化科吉林吉林3203
金镇勋 兰汝春 王 菲 董长松 徐 冶 (吉林医药学院附属医院消化科,吉林 吉林 3203)
细胞内存在两种主要的蛋白质降解途径,泛素-蛋白酶体途径和自噬途径,自噬途径主要降解长寿命蛋白,而泛素-蛋白酶体途径则主要降解短寿命蛋白,这些蛋白包括一些细胞周期蛋白、转录因子、抗肿瘤蛋白和促凋亡蛋白。蛋白酶体广泛存在于真核细胞中,泛素-蛋白酶体系统是生物体内进行蛋白质选择性降解的重要途径之一,泛素-蛋白酶体系统的异常可以导致多种疾病的发生,其中在肿瘤发展中的作用越来越受到人们的重视。乳胞素(Lactacystin,LAC)是链霉菌属的代谢产物,可以通过细胞膜,引起不可逆的蛋白酶体抑制〔1〕,被广泛应用于蛋白酶体的研究中〔2~4〕。本研究通过体外培养BGC-823,观察自噬抑制剂3-MA对蛋白酶体抑制剂LAC抑制BGC-823细胞增殖的影响。
1 材料与方法
1.1 材料和试剂 噻唑蓝(MTT)购自美国Sigma公司;胎牛血清(BSA)、IMEM培养基购自美国Gibco公司;十二烷基硫酸钠(SDS)、四甲基乙二胺(TEMED)、丙烯酰胺、N,N-二甲基双丙烯酰胺、过氧化物酶标记二抗购自北京鼎国生物技术有限公司;β-肌动蛋白(β-actin)、细胞色素 C(Cytochrome C)、半胱氨酸蛋白酶-4(caspase-4)抗体购自美国SANTA CRUZ公司。
1.2 实验分组 分为对照组、3-MA 5 mmol/L组、LAC 5 μmol/L组和 LAC 5 μmol/L+3-MA 5 mmol/L 组。
1.3 MTT法检测细胞存活率 取处于对数生长期的BGC-823细胞,胰酶消化后800 r/min离心,按每孔含1×104BGC-823细胞加入96孔细胞培养板,37℃,5%CO2培养箱中培养过夜使BGC-823细胞完全贴壁。设立对照组以及不同浓度LAC组,每个LAC浓度9个重复孔,LAC作用12 h后每孔加入20 μl MTT,CO2培养箱中继续孵育4 h,吸掉96孔板中的培养液,加入150 μl二甲基亚砜(DMSO),振荡器振荡10 min。BIO-TEK酶标仪上,选择490 nm波长,测定每孔中吸收值,计算细胞增殖率。对照组细胞存活率为100%,加药各组存活率=(各浓度组A值/对照组A值)×100%。
1.4 Western印迹法检测各组细胞 β-actin、Cytochrome C、caspase-4蛋白表达水平 (1)蛋白的提取:处于对数生长期的BGC-823细胞,待细胞生长到培养瓶70%时,随即将4瓶细胞分为4组,作用12 h后,胰酶消化离心,每瓶加入120 μl预先冷却的细胞裂解液(RIPA),混匀,细胞粉碎仪超声粉碎2次,每次5 s,4℃作用60 min,3 000 r/min离心收集上清。(2)蛋白浓度测定:根据说明书,利用BSA测定各组蛋白浓度。(3)蛋白质的变性:每管加入30 μl 5×上样缓冲液,煮沸变性。(4)丙烯酰胺凝胶电泳:将每组蛋白缓慢加入加样孔中,加入电泳液,浓缩胶80 V,25 min;分离胶160 V,45 min。电泳结束后,根据目的蛋白分子量的不同剪切分离胶。转膜,首先放置1层海绵2层滤纸,然后放入分离胶,聚偏氟乙烯(PVDF)膜,最后上面再放置2层滤纸和1层海绵,放入冰盒,倒入足够的转膜液,100 V,55 min。转膜结束后取出PVDF膜,放入5%脱脂奶粉封闭2 h。封闭结束后用磷酸盐缓冲液(PBS)洗膜3次,每次5 min,然后加入相应一抗 (β-actin、Cytochrome C、caspase-4;1∶200稀释),4℃冰箱过夜,次日回收一抗,PBS洗膜3次,时间分别为1×15 min、2×5 min,加入过氧化物酶标记的相应二抗(1∶1 000稀释)摇床摇2 h,二氮基联苯胺(DAB)显色。
1.5 统计学分析 采用SPSS12.0统计学软件,各组之间各项检测指标比较采用t检验。
2 结果
2.1 单独应用LAC以及联合应用3-MA对各组胃癌BGC-823细胞增殖率的影响 MTT结果显示,与Control组(100%)相比,LAC 5 μmol/L可以引起细胞增殖下降,差异具有统计学意义(P<0.05)。同时联合应用 LAC 5 μmol/L和 3-MA 5 mmol/L可以进一步引起细胞增殖率的下降,差异具有统计学意义(P<0.05)。
2.2 各组BGC-823细胞Cytochrome C表达水平 单独应用蛋白酶体抑制剂LAC可以引起线粒体凋亡相关蛋白Cytochrome C表达水平升高,而联合应用LAC和3-MA时,Cytochrome C表达水平进一步升高,差异具有统计学意义(P<0.05)。提示3-MA可以增加LAC引起的线粒体凋亡。见图1。
2.3 各组BGC-823细胞caspase-4表达水平 单独应用蛋白酶体抑制剂LAC可以引起caspase-4表达水平的升高,而联合应用LAC和3-MA时,caspase-4表达水平进一步升高,差异具有统计学意义(P<0.05)。提示3-MA可以增加LAC引起的内质网介导的凋亡。见图2。
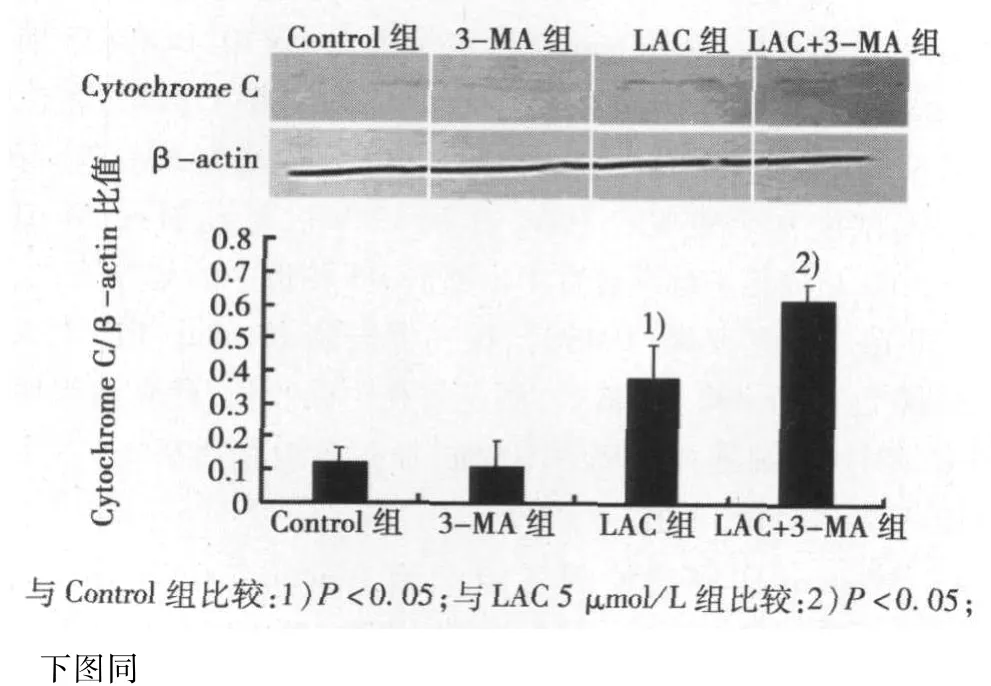
图1 各组BGC-823细胞Cytochrome C蛋白表达比较
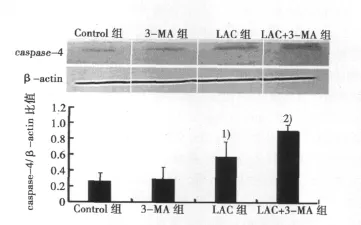
图2 各组BGC-823细胞caspase-4蛋白表达比较
3 讨论
蛋白质的新陈代谢对于维持正常的细胞功能,促进细胞存活极其重要。泛素-蛋白酶体途径在降解陈旧蛋白质从而促进蛋白质的新陈代谢中发挥重要的作用。细胞内蛋白质降解必须由精确的时间和空间来调节。泛素-蛋白酶体途径由泛素(Ub)、泛素活化酶(E1)、泛素结合酶(E2)、泛素-蛋白连接酶(E3)、26S蛋白酶体和泛素解离酶(DUBs)等组成。泛素蛋白酶体对蛋白质的降解是一个连续的过程〔5〕。E1首先催化泛素使其C-末端甘氨酸残基与E1的半胱氨酸残基间形成高能硫酯键而活化。活化的E1-泛素结合的中间体再将泛素转移给泛素结合酶E2,从而形成E2-泛素中间体。最后一步,泛素-蛋白连接酶E3与靶蛋白结合,促使泛素分子相继连接到靶蛋白上,形成一条多泛素链〔6〕。如果蛋白质降解出现了异常,将会导致严重的细胞生长障碍,包括增殖和分化的障碍,同时,泛素蛋白酶体的异常还可以诱导多种疾病的发生。蛋白酶体抑制剂LAC通过阻止细胞内20 S蛋白酶体与蛋白起接触反应的β亚单位,从而有效专一抑制 20S蛋白酶体活性〔7~9〕。
本研究通过体外培养胃癌BGC-823细胞,利用蛋白酶体抑制剂LAC可以明显地引起BGC-823细胞增殖率的下降,联合应用自噬抑制剂3-MA可以增加LAC引起的细胞增殖率的下降。本文进一步利用Western印迹方法检测了线粒体凋亡相关蛋白Cytochrome C以及内质网凋亡相关蛋白caspase-4变化,LAC可以引起线粒体凋亡相关蛋白Cytochrome C以及内质网凋亡相关蛋白caspase-4表达水平升高,当联合应用自噬抑制剂3-MA时,可以进一步引起Cytochrome C和caspase-4升高,提示3-MA可以增加LAC引起的细胞凋亡。以上结果表明,同时抑制蛋白酶体降解途径和自噬降解途径,能更加有效地抑制BGC-823细胞增殖,这一机制为胃癌治疗提供了新的思路。
1 Omura S,Fujimoto T,Dtoguro K,et al.Lactacystin,a novel microbial metabolite,induces neuritogenesis of neuroblastoma cells〔J〕.J Antibiot,1991;44(1):113-6.
2 Adams J,Stein R.Novel inhibitors of the proteasome and their therapeutic use in inflammation〔J〕.Ann Rep Med Chem,1996;279-88.
3 Lee DH,Goldberg AL.Proteasome inhibitors:valuable new tools for cell biologists〔J〕.Trends Cell Biol,1998;8(10):397-403.
4 Tomoda H,Omura S.Lactacystin,a proteasome inhibitor:discovery and its application in cell biology〔J〕.Yakugaku Zasshi,2000;120(10):935-49.
5 倪晓光,赵 平.泛素-蛋白酶体途径的组成和功能〔J〕.生理科学进展,2006;37(3):255-8.
6 Moberg KH,Bell DW,Wahrer DC,et al.Archipelago regulates Cyclin E levels in Drosophila and is mutated in human cancer cell lines〔J〕.Nature,2001;413(6853):311-6.
7 Mukhopadhyay D,Riezman H.Proteasome-independent functions of ubiquitin in endocytosis and signaling〔J〕.Science,2007;315(5809):201-5.
8 Hao B,Zheng N,Schulman BA,et al.Structural basis of the Cks1-dependent recognition of p27(Kip1)by the SCF(Skp2)ubiquitin ligase〔J〕.Mol Cell,2005;20(1):9-19.
9 Yamasaki L,Pagano M.Cell cycle,proteolysis and cancer〔J〕.Curr Opin Cell Biol,2004;16(6):623-8.
