聚甲基丙烯酸甲酯-牛血清白蛋白核壳纳米粒子在金表面的吸附过程及在传感器中的应用
2012-12-12何传新袁安朋张黔玲任祥忠李翠华刘剑洪
何传新 袁安朋 张黔玲 任祥忠 李翠华 刘剑洪
(深圳大学化学与化工学院,深圳市功能高分子重点实验室,广东深圳518060)
1 引言
生物传感器作为一种新型的分析手段,具有选择性好、灵敏度高、分析速度快、成本低,能在复杂体系中进行在线连续监测等优点,在临床诊断、食品工业和环境监测等方面都有着重要的应用,并已成为现代分析化学和生命科学的一个重要分支.1-4在生物传感器中,电化学生物传感器是十分重要的一类,它是由生物识别分子(如酶、抗体、抗原和核酸等)作为敏感基元,电极作为转换元件,以电流、电势或电导等作为特征检测信号的传感器,其制备的一个关键步骤是生物活性分子的固定化.5-7如何利用载体有效地固定生物识别分子并保留其活性,对制备性能优异的电化学生物传感器至关重要.因此,性能优良载体材料的合成,是高灵敏度、高选择性生物传感器成功研制的核心问题,已成为传感技术研究领域的热点和难点.8-10
酶是具有催化活性的一类蛋白质,能在常温常压的温和条件下高效地催化反应,并且具有很强的选择性.由于具备催化效率高和选择性好的特点,酶常被作为生物识别分子,广泛用于生物传感器的制备.在生物传感器的研究应用中,基于葡萄糖氧化酶的生物传感器占到了80%以上.1主要是因为糖尿病患者日益增多,导致对葡萄糖传感器的需求量大大增加,迫切需要开发出检测精度高、响应速度快、性能稳定和使用寿命长的葡萄糖传感器;另外,在食品加工和发酵等领域,葡萄糖传感器也有着重要的应用.葡萄糖氧化酶是广泛存在于黑曲菌和青霉菌中的一种需氧脱氢酶,对β-D葡萄糖具有高度专一的催化氧化作用.11葡萄糖氧化酶是分子量为150至180 kDa的二聚体,结构包括580个氨基酸残基,2个黄素腺嘌呤二核苷酸(FAD)辅因子,6个N-乙酰氨基葡萄糖残基,3个甘露糖残基.12-15在葡萄糖氧化酶进行催化作用的过程中,辅酶FAD起到电子和质子中间体的重要作用,即辅酶FAD通过它的氧化态和还原态的不断循环而实现其功能.
由于纳米粒子具有大的比表面积、表面反应活性高、催化效率高、吸附能力强等特点,基于纳米粒子固定葡萄糖氧化酶构建传感表面,是葡萄糖酶传感器的一个重要发展方向.16-19纳米粒子作为固定葡萄糖氧化酶的载体一方面可以提高酶的负载量,另一方面许多纳米粒子尤其是金属纳米粒子具有良好的催化性能,能加快酶与电极表面之间的电子转移,在葡萄糖酶传感器中引入具有催化性能的纳米粒子,可以提高传感器的灵敏度、选择性和响应速度.20-22虽然纳米粒子在生物传感器中得到广泛应用,但也存在一些问题,例如许多纳米粒子与生物识别分子相容性差,不能与生物识别分子直接作用,限制了其在生物传感器中的应用.另外,用于人体实时监测的生物传感器,要求载体具有无毒且生物相容性好的特点.因此,设计合成具有良好生物相容性并能有效地负载生物活性分子的纳米粒子,对生物传感器的发展及在临床医学的应用起着十分关键的作用.BSA具有良好的生物相容性和血液相容性,它是由582个氨基酸残基组成的单肽链蛋白质,分子量约为68000,其氨基酸序列与人血清白蛋白的氨基酸序列非常相似.23本文中我们利用铜离子引发体系,制备出核层为PMMA,壳层为BSA的PMMA-BSA核壳纳米粒子.通过QCM-D实验研究了PMMA-BSA纳米粒子在金片表面的吸附.利用这种壳层为蛋白的纳米粒子作为载体固定葡萄糖氧化酶,从而改善载体与葡萄糖氧化酶的相容性,制备出性能优良的电流型葡萄糖传感器.
2 实验部分
2.1 试剂与仪器
试剂:葡萄糖氧化酶(GOx,来源于Aspergillus niger,25°C Specific acitivity>100 units·mg-1)和牛血清白蛋白(BSA,纯度>98%)购于美国Amresco公司,直接使用;戊二醛水溶液(GA,50%)购于上海生工生物工程技术有限公司,稀释后直接使用.甲基丙烯酸甲酯从国药集团化学试剂有限公司购买,使用前通过碱洗除掉阻聚剂,干燥后减压蒸馏;二茂铁羧酸(FMCA)、氯化铜、磷酸二氢钠、磷酸氢二钠、磷钨酸均为国药集团化学试剂有限公司分析纯试剂,使用前未经进一步处理.
仪器:日本电子JEM-1230透射电镜电子显微镜(TEM);德国ALV/DLS/SLS-5022F激光光散射(LLS);英国VG科学仪器公司ESCALAB MK-11型X射线电子能谱仪(XPS);瑞典Q-senseAB带耗散的石英晶体微天平(QCM-D);美国Nanoscope IIIa型原子力显微镜(AFM);上海辰华仪器公司生产的CHI660A型电化学工作站.
2.2 PMMA-BSA核壳纳米粒子的制备与表征
取0.9156 g BSA加到反应器中,再加入29 mL去离子水,室温搅拌30 min,使BSA充分溶解.移取1.5×10-4mol·L-1氯化铜水溶液1 mL,在搅拌下滴加到BSA水溶液中.通氮气搅拌30 min后,加入5 mL甲基丙烯酸甲酯单体,搅拌15 min后,通循环水加热.反应3 h获得PMMA-BSA乳液.先采用离心再分散的方法粗略除掉乳液样品中未反应的BSA和MMA,再用去离子水透析一周进一步除掉样品中残留的BSA和MMA.采用日本电子JEM-1230型透射电子显微镜来观测PMMA-BSA粒子的结构,电子束的加速电压是80 kV.取PMMA-BSA溶液滴加到镀碳膜的铜网上,10 min后滴加1%(w)磷钨酸,室温染色2 min后,用滤纸从铜网边缘吸走剩下的溶液,样品经室温真空干燥后测试.
2.3 基于PMMA-BSA纳米粒子的电流型葡萄糖酶传感器的制备
将金电极依次用1.0、0.3和0.05 μm的Al2O3打磨抛光,用去离子水清洗干净后,分别在丙酮和去离子水中超声5 min,反复三次,然后在0.5 mol·L-1H2SO4中于-0.2-1.5 V电位范围内进行循环伏安扫描,直到得到稳定循环伏安曲线,再用去离子水超声清洗5 min,高纯氮气吹干后使用.
将处理过的金电极浸入到PMMA-BSA分散液(0.05 mol·L-1,pH 4.5的磷酸盐缓冲液)中60 min;再浸入到磷酸盐缓冲液浸洗;然后将电极浸入含GA的水溶液20 min,用去离子水洗净后,再浸入0.5 mg·mL-1的GOx溶液(0.05 mol·L-1,pH 4.5磷酸盐缓冲液)中60 min,最后再用磷酸盐缓冲液浸洗,制备的电极用Au/PMMA-BSA-GA/GOx表示.
3 结果与讨论
3.1 表征结果
图1是PMMA-BSA粒子的TEM照片.从图中可以观察到,PMMA-BSA粒子具有明显的核壳结构,核层和壳层具有清晰的分界,并且粒子分散良好,尺寸较为均一.通过TEM软件分析,粒子半径在55 nm左右,其中核层半径约为20 nm,壳层厚度约为35 nm.从PMMA和BSA在水溶液中的溶解性质来分析,粒子应该形成了以PMMA为核,BSA为壳的结构.因为PMMA在水中不能溶解,而蛋白具有良好的水溶性.聚合时随着PMMA链的增长, PMMA链通过疏水作用聚集形成粒子的核层,BSA分布在粒子的壳层,使得粒子在水溶液中稳定分散.通过动态光散射(DLS)测得PMMA-BSA纳米粒子的流体力学半径为76 nm,粒子的分布较窄.DLS测得粒子半径为比TEM测得半径值大,这是因为TEM是在粒子干燥失去水分,壳层塌缩时测得的半径,而DLS是在粒子充分溶胀时测得的结果.
由于氮元素是BSA的基本组成元素之一,而PMMA中不含有氮元素,所以可通过XPS分析PMMA-BSA粒子表面组成,为BSA是否位于PMMABSA粒子的壳层提供直接证据.图2是PMMA-BSA在结合能为0-1200 eV范围内的XPS全扫描图谱.从图中可以看出,PMMA-BSA的三个峰位分别出现在286、399和531 eV附近,对应于C、N、O的1s结合能.对于蛋白质和聚合物,XPS的测试深度为5-10 nm,所以PMMA-BSA中的N 1s峰说明BSA位于粒子的壳层.为了进一步证明BSA位于PMMABSA纳米粒子的壳层,对上述氮元素进行了高分辨率XPS分谱扫描.图3是BSA和PMMA-BSA的高分辨N 1s谱,可以看出二者N 1s谱基本吻合,结合能399.45 eV处的峰,是由BSA中的肽键(-CONH-)的氮产生,这充分说明PMMA-BSA粒子中位于壳层的是BSA.

图1 PMMA-BSA纳米粒子经1%的磷钨酸染色后的TEM照片Fig.1 TEM image of PMMA-BSAnanoparticles stained with 1%phosphotungstic acid
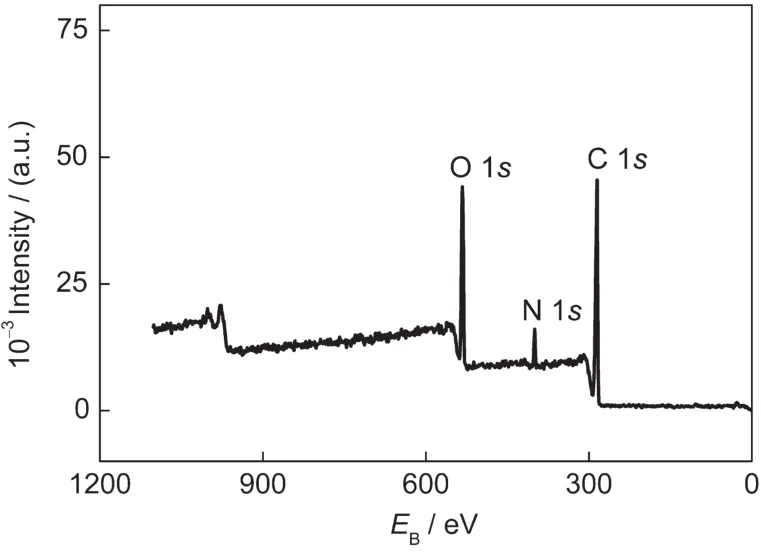
图2 PMMA-BSA粒子的全扫描X射线光电子能谱图Fig.2 Respective XPS survey scans of PMMA-BSA particles
3.2 PMMA-BSA纳米粒子在金表面的吸附过程
采用带耗散的石英晶体微天平研究PMMABSA纳米粒子在金表面的吸附过程.使用QCM-D 300型石英晶体微天平(Q-sense AB,瑞典),配有共振基频为5 MHz,直径为14 mm的AT-cut石英振子金片.测试过程中,先用磷酸盐缓冲液为基准物测量获得基线,基线稳定后,将相应的样品溶液替换QCM-D腔中的磷酸盐缓冲液,实验在(25.00± 0.02)°C下进行.
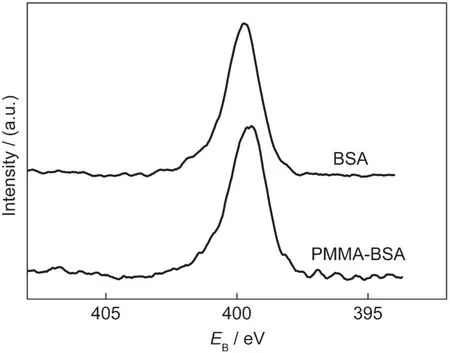
图3 BSA和PMMA-BSA粒子的高分辨N 1s X射线光电子能谱图Fig.3 Respective high resolution N 1s XPS spectra of pure BSAand PMMA-BSAparticles
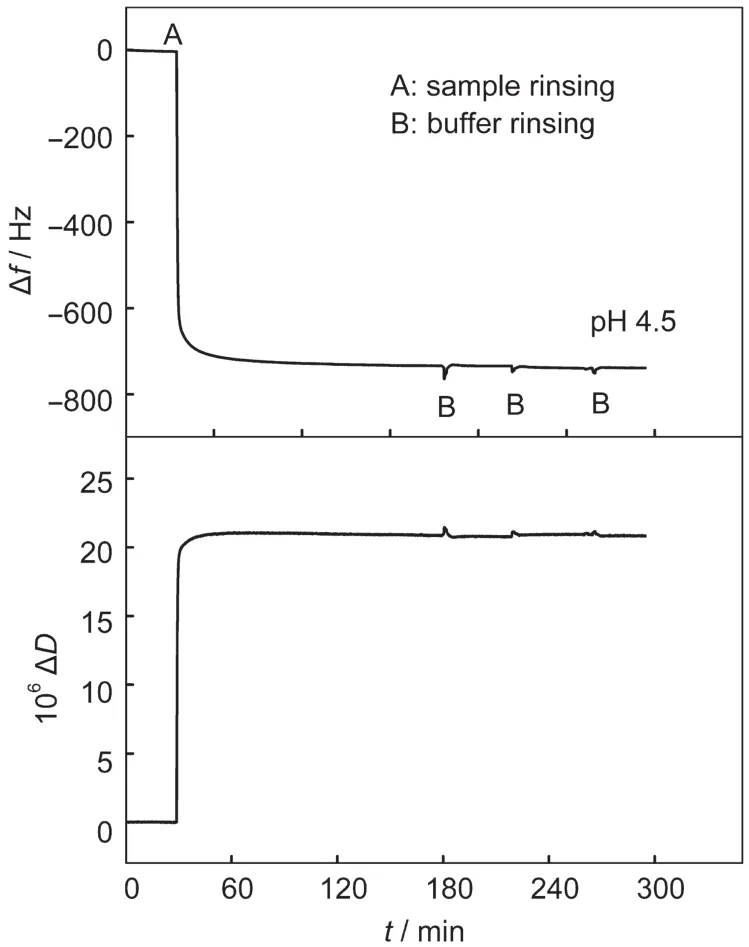
图4 石英振子金片浸入PMMA-BSA分散液时Δf和ΔD随时间的变化Fig.4 Changes of frequency(Δf)and dissipation(ΔD) after gold-coated quartz resonator is immersed in a PMMA-BSAdispersion
图4是PMMA-BSA纳米粒子在石英振子金片表面吸附时,频率和耗散因子随时间的变化.根据QCM-D原理可知,QCM-D频率的变化Δf直接与吸附层的质量有关,而其耗散因子的变化(ΔD)则与吸附层的厚度和结构的松散程度有关.24,25从图中可以看出,当向QCM-D反应腔体中加入PMMA-BSA分散液时,频率迅速下降,耗散因子快速上升,说明PMMA-BSA粒子快速地吸附到金片表面.吸附平衡时,Δf值下降达到-732 Hz,表明金片上吸附的PMMA-BSA量较多.利用磷酸盐缓冲液反复冲洗时,Δf和ΔD没有变化,说明PMMA-BSA纳米粒子在金片上吸附较牢固.PMMA-BSA纳米粒子与金片之间的较强相互作用一方面是由于粒子壳层的BSA蛋白含有氨基,另一方面BSA结构中有35个半胱氨酸残基,其中形成了17对二硫键,第34位是以巯基形式存在的,26-28Maynard29,30和Bulmus31-32等的研究表明,第34位的巯基在磷酸盐缓冲液中位于BSA蛋白外层,具有反应活性,由于巯基和二硫键与金都具有较强的相互作用,所以PMMA-BSA粒子可以牢固地吸附到金片表面.
从前面的讨论可知,Δf反映了PMMA-BSA粒子在金片上的吸附量,而ΔD反映了吸附层的厚度和结构的松散程度.因此,通过Δf和ΔD之间的关系,我们可以更好地理解PMMA-BSA纳米粒子在金片上的吸附过程.图5是PMMA-BSA粒子在振子表面吸附时ΔD与Δf的关系.从图中可以看出, PMMA-BSA粒子在金片表面吸附时,只包含一个动力学过程,也说明PMMA-BSA粒子在金片上的快速吸附是由粒子壳层蛋白中巯基和二硫键与金的强相互作用所致.从图中还可以得出,在吸附过程的后半部分,随着-Δf的增加,ΔD的增加变缓,使得曲线略向下弯曲,这可能是由于吸附到金片表面的PMMA-BSA粒子结构发生调整,使粒子排列更加紧密,导致吸附层结构变得更加致密.因为,对于一个被PMMA-BSA粒子覆盖的振子来说,ΔD主要由吸附层的结构所决定.一个致密的刚性的吸附层会导致比较小的ΔD,而一个松散柔软的吸附层会产生较大的ΔD.24
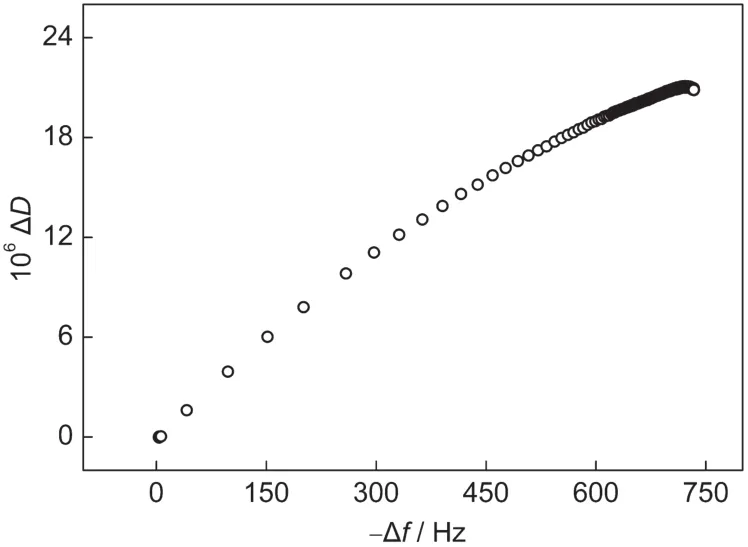
图5 PMMA-BSA纳米粒子在石英振子金片上吸附时ΔD与Δf的关系Fig.5 Relationship between ΔD and Δf after gold-coated quartz resonator adsorbed by PMMA-BSAnanoparticles

表1 pH值对PMMA-BSA粒子在石英振子金片上吸附的影响Table 1 Effect of pH values on the adsorption of PMMA-BSAparticles on gold-coated quartz resonator

图6 PMMA-BSA纳米粒子在石英振子金片表面吸附的AFM高度图(A和B)和相图(Aʹ和Bʹ)Fig.6 AFMheight(AandB)andphase(AʹandBʹ)imagesofPMMA-BSAnanoparticlesadsorbedongold-coatedcrystalsurface(A)pH 3.6;(B)pH 7.4
表1是不同pH值下,PMMA-BSA纳米粒子在金片表面吸附达到平衡时,Δf和ΔD的变化值.可以看出,改变pH值对PMMA-BSA纳米粒子在金片表面的吸附量影响较大.由于频率下降值与吸附在金片上PMMA-BSA纳米粒子的质量成正比,从表中数据可以得出pH 5.5时吸附量较多,pH 7.4时吸附量稍微有所下降,而pH 3.6时吸附量较少.由于PMMA-BSA纳米粒子的等电点为5.1,pH 7.4或3.6时粒子间静电排斥力比pH 5.5时强,所以当金片上吸附一层粒子后,继续吸附的PMMA-BSA纳米粒子需要克服较强的静电排斥力,从而导致pH 7.4时吸附量有所下降.为了更直观反映粒子的吸附情况,我们将吸附粒子后的金片进行原子力显微镜(AFM)扫描,结果如图6所示.其中图6(A,B)对应的QCM-D实验中吸附平衡时的Δf值分别为-119、-943 Hz.可以看出,QCM-D与AFM的实验结果吻合较好.pH 3.6吸附平衡时频率下降值较小,对应的粒子吸附的量较少,只覆盖了部分石英振子金片表面; pH 7.4时石英振子金片表面吸附了多层粒子,金片表面完全被粒子覆盖.这种吸附的差异一方面是由于粒子间静电排斥力不同,另一方面是由于不同pH值时粒子壳层的BSA结构发生变化.BSA是一种“软蛋白”,在不同的pH值体系里,其构象变化较大,而分子构象的改变必然导致表面一些功能基团的重新排列,使得BSA分子表面的巯基和二硫键发生变化,导致在不同pH值下粒子在金片上的吸附量有所不同.Radke等33对BSA结构的pH值依赖性进行了详细的研究,结果表明pH 7.0时BSA中螺旋结构占48%;pH 5.0时螺旋结构增加到55%;当pH值降至2.7时螺旋结构仅有35%;说明在低的pH值下BSA构象变化较大,这可能导致表面的巯基和二硫键被包埋到分子内部,所以在pH 3.6时PMMA-BSA纳米粒子在金片上的吸附量大大减少.

图7 (A)0.3 V电位下往含5 mmol·L-1二茂铁羧酸的磷酸盐缓冲溶液(0.05 mol·L-1,pH 7.4)中连续滴加葡萄糖时电极的响应电流随时间的变化;(B)连续滴加葡萄糖时响应电流随葡萄糖浓度的变化Fig.7 (A)Current response of GOx electrode after a successive addition of glucose in pH 7.4,0.05 mol·L-1PBS containing 5 mmol·L-1FMCAunder an applied potential of 0.3 V;(B)current response as a function of glucose concentration as glucose addition successivelyThe insert in(A)is the partial enlarged graph.
3.3 在电流型葡萄糖传感器中的应用
利用恒电位安培法,我们研究了Au/PMMABSA~GA/GOx电极对葡萄糖的响应性能.在0.3 V的工作电位下,向磷酸盐缓冲溶液中连续加入葡萄糖,检测催化电流与葡萄糖浓度的关系,结果如图7所示.从图中可以看出,每次加入葡萄糖后,响应电流会出现相应的跳跃性增加.通过放大的插图可以得出,电极的响应速度较快,达到95%稳态电流的时间仅为11 s.快速的电流响应说明PMMA-BSA纳米粒子形成的修饰层对葡萄糖扩散阻力较小.随着葡萄糖浓度的增加,电极的响应电流逐渐增大.响应电流与葡萄糖浓度在0.20-5.85 mmol·L-1范围内呈现出良好的线性关系,相关系数为0.989,如图7 (B)所示.通过响应电流与浓度的关系可计算出Au/ PMMA-BSA~GA/GOx电极的灵敏度为28.6 μA·L· mmol-1·cm-2,高于文献中常报道的5-20 μA·L· mmol-1·cm-2的范围.34-37高的灵敏度可使Au/PMMABSA~GA/GOx电极用于微量葡萄糖溶液的检测,这对电极的实际应用也非常有利,可以降低测试需要的血液量,减轻取血给病人带来的不适.传感器还具有较低的检测限为0.11 mmol·L-1.通过Lineweaver-Burk方程的电化学形式求得表观的米氏常数为6.03 mmol·L-1,表明固定到电极上的GOx具有较高的活性和对底物葡萄糖有较大的亲和性.38,39
传感器的储存稳定性对其实际应用非常重要,而文献中一般将制备的传感器储存在4°C的低温下,考察传感器可以使用的时间,很少有报道在接近室温的条件下研究传感器的使用时间.这主要是因为较高温度下,GOx容易失去活性.这里我们在较高的温度25°C下,考察了传感器的储存稳定性,结果如图8所示.从图中可以看出,在22 d的时间内,传感器的响应电流几乎没有发生变化.在25°C下储存30 d时间时,响应电流仅下降了16%,说明传感器具有良好的储存稳定性.传感器在较高温度下表现出的储存稳定性一方面归因于GOx和PMMA-BSA纳米粒子之间结合牢固;另一方面, PMMA-BSA纳米粒子壳层的BSA蛋白为GOx提供了与其组成相似的生物微环境,有利于GOx结构的稳定和活性的保持.

图8 电极在25°C下的储存稳定性随时间的变化Fig.8 Stability of GOx electrode stored at 25°Ci0is the steady-state current of the enzyme electrode freshly fabricated and i is the current after a given storage time.
4 结论
利用铜离子引发体系,制备出核层为PMMA,壳层为BSA的PMMA-BSA核壳型纳米粒子. QCM-D实验表明PMMA-BSA纳米粒子可以吸附到金片表面.通过Δf和ΔD之间的关系,可以得出PMMA-BSA粒子在金片表面吸附时,只包含一个动力学过程.改变溶液的pH值对PMMA-BSA纳米粒子在金片表面的吸附量影响较大,这是由于粒子间静电排斥力和壳层BSA蛋白构象变化所致,所以可通过改变pH来调节粒子在金片表面的吸附量.利用恒电位安培法表征了Au/PMMA-BSA~GA/ GOx电极对葡萄糖的响应性能,结果表明通过粒子在金电极表面吸附制备的葡萄糖传感器具有响应速度快和储存稳定性好的特点.
(1) Wang,J.Chem.Rev.2008,108,814.doi:10.1021/cr068123a
(2) Koschwanez,H.E.;Reichert,W.M.Biomaterials 2007,28, 3687.doi:10.1016/j.biomaterials.2007.03.034
(3) Hu,J.Biosens.Bioelectron.2009,24,1083.doi:10.1016/ j.bios.2008.08.051
(4) Ge,F.;Cao,R.G.;Zhu,B.;Li,J.J.;Xu,D.S.Acta Phys.-Chim. Sin.2010,26,1779.[戈 芳,曹瑞国,朱 斌,李经建,徐东升.物理化学学报,2010,26,1779.]doi:10.3866/PKU. WHXB20100736
(5) Willner,I.;Baron,R.;Willner,B.Biosens.Bioelectron.2007, 22,1841.doi:10.1016/j.bios.2006.09.018
(6) Zargoosh,K.;Chaichi,M.J.;Shamsipur,M.;Hossienkhani,S.; Asghari,S.;Qandalee,M.Talanta 2012,93,37.doi:10.1016/ j.talanta.2011.11.029
(7) Xiao,X.;Zhou,B.;Zhu,L.;Xu,L.;Tan,L.;Tang,H.;Zhang, Y.;Xie,Q.;Yao,S.Sens.Actuators B 2012,165,126.doi: 10.1016/j.snb.2012.02.029
(8) Willner,I.;Willner,B.;Katz,E.Bioelectrochemistry 2007,70, 2.doi:10.1016/j.bioelechem.2006.03.013
(9) Heller,A.;Feldman,B.Chem.Rev.2008,108,2482.doi: 10.1021/cr068069y
(10)Guo,X.L.;Guo,M.;Wang,X.D.Acta Phys.-Chim.Sin.2007, 23,585.[郭小丽,郭 敏,王新东.物理化学学报,2007,23, 585.]doi:10.3866/PKU.WHXB20070426
(11) Cui,G.;Kim,S.J.;Choi,S.H.;Nam,H.;Cha,G.S.;Paeng,K. J.Anal.Chem.2000,72,1925.doi:10.1021/ac991213d
(12) Weibel,M.K.;Bright,H.J.J.Biol.Chem.1971,246,2743.
(13) Wrighton,M.S.Science 1986,231,32.doi:10.1126/ science.231.4733.32
(14) Frederick,K.R.;Tung,J.;Emerick,R.S.;Masiarz,F.R.; Chamberlain,S.H.;Vasavada,A.;Rosenberg,S.;Chakraborty, S.;Schopter,L.M.;Massey,V.J.Biol.Chem.1990,265,3793.
(15) Hecht,H.J.;Schomburg,D.;Kalisz,H.;Schmid,R.D.Biosens. Bioelectron.1993,8,197.doi:10.1016/0956-5663(93)85033-K
(16) Yu,J.;Yu,D.;Zhao,T.;Zeng,B.Talanta 2008,74,1586.doi: 10.1016/j.talanta.2007.10.005
(17) Deng,S.;Jian,G.;Lei,J.;Hu,Z.;Ju,H.Biosens.Bioelectron. 2009,25,373.doi:10.1016/j.bios.2009.07.016
(18) Wei,Y.;Li,Y.;Liu,X.;Xian,Y.;Shi,G.;Jin,L.Biosens. Bioelectron.2010,26,275.doi:10.1016/j.bios.2010.06.006
(19) Zhang,G.L.;Pan,X.H.;Kan,J.Q.;Zhang,J.H.;Li,Y.F.Acta Phys.-Chim.Sin.2003,19,533. [张国林,潘献华,阚锦晴,张景辉,李永舫.物理化学学报,2003,19,533.]doi:10.3866/ PKU.WHXB20030611
(20) Qiu,J.D.;Huang,J.;Liang,R.P.Sens.Actuators B 2011,160, 287.doi:10.1016/j.snb.2011.07.049
(21) Chen,X.;Zhu,J.;Chen,Z.;Xu,C.;Wang,Y.;Yao,C.Sens. Actuators B 2011,159,220.doi:10.1016/j.snb.2011.06.076
(22) Che,X.;Yuan,R.;Chai,Y.;Li,J.;Song,Z.;Li,W.;Zhong,X. Colloids Surf.B 2011,84,454.doi:10.1016/j.colsurfb. 2011.01.041
(23) Valstar,A.;Vasilescu,M.;Vigouroux,C.;Stilbs,P.;Almgren, M.Langmuir 2001,17,3208.doi:10.1021/la0016221
(24) Rodahl,M.;Höök,F.;Krozer,A.;Kasemo,B.;Breszinsky,P. Rev.Sci.Instrum.1995,66,3924.doi:10.1063/1.1145396
(25)Voinova,M.V.;Rodahl,M.;Jonson,M.;Kasemo,B.Phys. Scrip.1999,59,31.
(26) Bloomfield,V.Biochemistry 1965,5,684.
(27) Hirayama,K.;Akashi,S.;Furuya,M.;Fukuhara,K.L. Biochem.Biophys.Res.Commun.1990,173,639.doi:10.1016/ S0006-291X(05)80083-X
(28) Bos,O.J.M.;Labro,J.F.A.;Fischer,M.J.E.;Wilting,J.; Janssen,L.H.M.J.Biol.Chem.1989,264,953.
(29)Bontempo,D.;Heredia,K.L.;Fish,B.A.;Maynard,H.D. J.Am.Chem.Soc.2004,126,15372.doi:10.1021/ja045063m
(30) Heredia,K.L.;Bontempo,D.;Ly,T.;Byers,J.T.;Halstenberg, S.;Maynard,H.D.J.Am.Chem.Soc.2005,127,16955.doi: 10.1021/ja054482w
(31) Liu,J.;Bulmus,V.;Herlambang,D.L.;Barner-Kowollik,C.; Stenzel,M.H.;Davis,T.P.Angew.Chem.Int.Edit.2007,46, 3099.
(32) Boyer,C.;Bulmus,V.;Liu,J.;Davis,T.P.;Stenzel,M.H.; Barner-Kowollik,C.J.Am.Chem.Soc.2007,129,7145.doi: 10.1021/ja070956a
(33) Cascâo Pereira,L.G.;Théodoly,O.;Blanch,H.W.;Radke,C.J. Langmuir 2003,19,2349.doi:10.1021/la020720e
(34) Zhu,W.;Kapteijn,F.;Moulijn,J.A.;den Exter,M.C.;Jansen, J.C.Langmuir 2000,16,3322.doi:10.1021/la9914007
(35) Wassell,D.T.;Hall,R.C.;Embery,G.Biomaterials 1995,16, 697.doi:10.1016/0142-9612(95)99697-K
(36) Rabe,M.;Verdes,D.;Zimmermann,J.;Seeger,S.J.Phys. Chem.B 2008,112,13971.doi:10.1021/jp804532v
(37) Zhu,H.;Srivastava,R.;Brown,J.Q.;McShane,M.J. Bioconjugate Chem.2005,16,1451.doi:10.1021/bc050171z
(38) Shu,F.R.;Wilson,G.S.Anal.Chem.1976,48,1679.doi: 10.1021/ac50006a014
(39) Kamin,R.A.;Wilson,G.S.Anal.Chem.1980,52,1198.doi: 10.1021/ac50058a010