水杨酸浸种对玉米种子萌发及幼苗生长的影响
2012-12-12胡春红李淑梅杨永乾
胡春红,郭 婕,李淑梅,杨永乾
(周口师范学院生命科学系,河南周口466001)
水杨酸广泛存在于植物界,是一种小分子的酚类化合物,化学名称为邻羟基苯甲酸,微溶于水,易溶于有机溶剂。大量研究证明,外源施用水杨酸不仅可以调节植物的某些生长发育过程,诱导某些植物开花和产热,延缓植物器官衰老[1,2],抑制顶端分生组织的生长,矮化植株,改进株型[3],还能诱导植物产生抗逆性,抵制不良因素造成的危害[4-6]。
玉米是我国主要的高产粮食和饲料作物之一,有很高的经济价值。以玉米为实验材料,采用水杨酸对玉米种子浸种,并进一步培养、观察,研究不同浓度的水杨酸对玉米种子萌发及幼苗生长的影响,为深入研究其作用机理奠定基础。
1 材料和方法
1.1 材料
玉米种子:郑单958,购于北京德农种业有限公司。
1.2 主要试剂和仪器
水杨酸、H2O2、无水乙醇、80%丙酮、愈创木酚、核黄素、蛋氨酸、氮蓝四唑(NBT)、低温高速离心机、UV-752分光光度计、恒温光照培养箱等。
1.3 方法
1.3.1 浸种
挑选胚完好、无霉变、有生活力、饱满一致的玉米种子240粒。用3%的H2O2在烧杯中浸泡消毒30min后用蒸馏水冲洗3~4次。然后将上述玉米种子分8个组,每组30粒分别放入一定浓度(mmol/L)SA(0.0,0.01,0.05,0.1,0.5,1.0,5.0, 10.0)中浸种24h。将浸泡好的种子,分别放入标有相应编号的盛有一定培养液的8个培养皿中(培养皿直径12.5cm,皿底铺有两层浸润的滤纸。培养皿编号:0(1)、0.01(1)、0.05(1)、0.1(1)、0.5 (1)、1(1)、5(1)、10(1),同浓度下做三个平行实验,每个培养皿中放10粒种子,置25℃光照培养箱中培养,光照10h/d,喷洒等量的营养水,观察并记录发芽情况。
1.3.2 测定方法
种子萌发情况测定:种子胚根突破种皮计为发芽种子,第3天统计发芽势,第7天统计发芽率。
形态指标的测定:根长指从根基部到根尖生长点之间的长度;株高指从最上根基部到生长点之间的高度;鲜重指除去根部剩余部分的鲜重;茎粗为离根基部1cm处的平均直径。
生理指标的测定:总叶绿素的测定采用分光光度法[7];过氧化物酶(POD)活性的测定采用愈创木酚法[8];超氧化物歧化酶(SOD)活性的测定采用NBT光还原法[9]。
1.3.3 数据处理方法
运用SPSS16.0统计分析软件对发芽率和发芽势实验数据进行χ2检验;对生理指标和形态指标采用one-way ANOVA方法进行差异显著性统计分析。
2 结果与分析
2.1 SA对玉米发芽率、发芽势的影响
由表1可以看出:与对照组相比,玉米种子用较低浓度(0.01~0.50mmol/L)的水杨酸处理,则促进种子萌发;用较高浓度(1~5mmol/L)的水杨酸处理,则表现出显著的抑制作用;当浓度达到10.0mmol/L时,种子不发芽。总体上呈现出低促高抑现象。
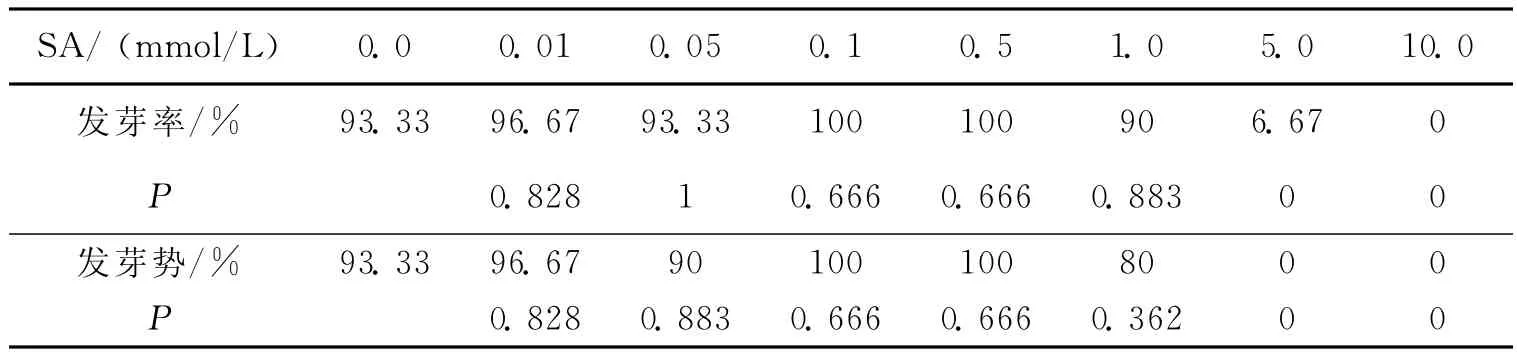
表1 SA对玉米发芽率、发芽势的影响

表2 SA对玉米幼苗株高、根长及鲜重的影响(长度单位:cm;重量单位:g;浓度:mmol/L;株数:棵)
2.2 SA对玉米幼苗株高、根长及鲜重的影响
求各组实验数据的平均值,分别以株高、茎粗、鲜重、根长为纵坐标,SA浓度为横坐标,作图(见图1~4)。

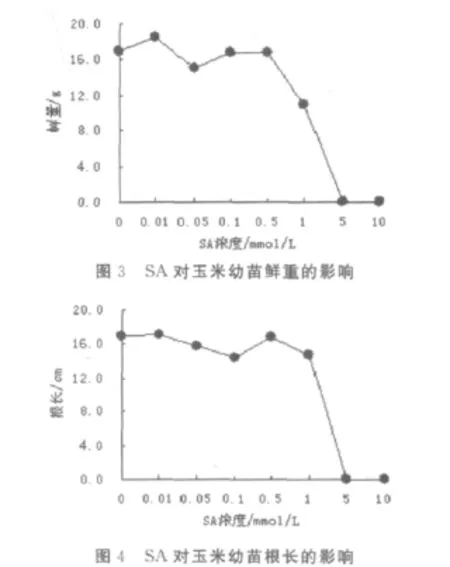
由表2及图1~4可知:与对照组相比,低浓度下SA对玉米幼苗的株高、茎粗、鲜重及根长并没有显著的影响,但当浓度达1.0mmol/L以上时, SA对玉米幼苗的株高、茎粗、鲜重及根长有明显的抑制作用。
2.3 SA对玉米幼苗生理指标的影响
因为当SA浓度达5.0mmol/L以上时,玉米种子的萌发几乎完全被抑制,没有幼苗供测定相关生理指标,所以以下生理指标仅涉及到0.0~1.0 mmol/L 5个浓度。
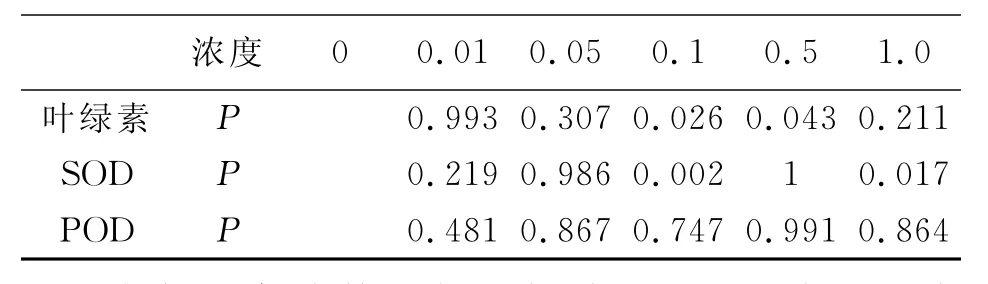
表3 SA对玉米幼苗生理指标的影响(单位:叶绿素:mg/g;SOD:U/g FW;POD:0.01ΔA/min)
求各组实验数据的平均值,分别以叶绿素含量、POD活性、SOD活性为纵坐标,SA浓度为横坐标,作图(见图5~7)。
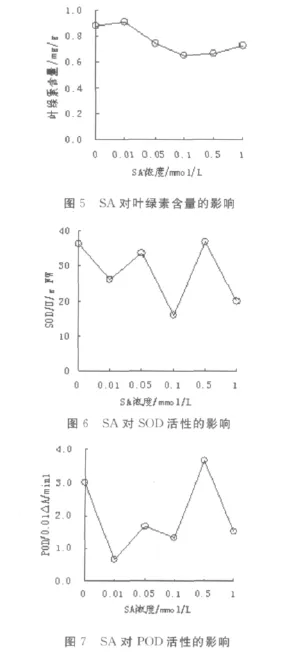
由表3及图5~7可以看出:随着SA浓度的增加,玉米幼苗的叶绿素含量呈现出先升后降的趋势,当SA浓度为0.1mmol/L和0.5mmol/L时,叶绿素含量均低于对照组,且具统计学意义;当SA浓度为0.1mmol/L和1.0mmol/L时,SOD含量均低于对照组,且具统计学意义;SOD、POD活性大致随SA浓度增加而降低。
3 讨论
由实验结果可知,不同浓度的SA浸种对玉米种子萌发以及幼苗生长呈现出不同的生物学效应,无论从生理指标还是形态指标上都大致呈现出低浓度促进,高浓度抑制现象。从玉米种子的发芽率和发芽势及幼苗形态指标看,当SA浓度≤0.5 mmol/L时,对玉米种子的萌发以及幼苗的生长都有一定的促进作用,但与对照组相比并没有统计学意义。这与相关研究结果并不尽一致,可能是实验方法不同所致。低浓度的SA处理,可以提高种子淀粉酶的活性、可溶性糖和可溶性蛋白含量,从而促进种子的萌发和幼苗生长。一些学者为了验证这一实验结果,在幼苗生长的过程中每天喷洒SA。这不符合农作物的大田实际耕作情况,操作起来过于繁琐。结合大田实际耕作情况,本实验采用SA浸种,苗期不喷洒SA的实验方法。因此,就可能出现种子用低浓度SA浸泡后,置营养液中萌发时一部分SA从其中浸出,减弱了SA对种子萌发的促进作用。在幼苗生长过程中,一直喷洒的是营养液,没有再喷洒相应浓度的SA,SA对幼苗生长的促进作用有部分逆转。因此整体上低浓度的SA对玉米种子萌发和幼苗生长的促进作用尚未达到显著水平。当SA浓度达1.0mmol/L以上时,对玉米的萌发及幼苗的生长表现出显著的抑制作用,与相关实验研究结果一致。这可能是因为较高浓度的SA,降低了种皮的渗透调节能力或者影响种子中物质的代谢及某些酶的活性,从而抑制了种子的萌发及后期幼苗的生长[10,11]。
从本实验所测的生理指标来看,叶绿素含量随着SA浓度的增加大致呈现出先升后降的趋势,这与相关研究结果基本一致[12]。而SOD、POD的测定结果表明,各浓度下的SA有降低SOD、POD活性的作用,并且随浓度增加SOD、POD活性大致呈逐渐下降趋势。这与相关报道:SA有提高幼苗体内SOD、POD活性的功能[13]不一致。可能是因为实验中所用SA浓度不同及实验方法不同所致。
[1]樊国华,金芳.壳聚糖和水杨酸对低温胁迫下草莓抗寒性的影响[J].甘肃农业大学学报,2008,43(2):83-86.
[2]张素勤,耿广东,程智慧.外源水杨酸对茄子抗寒性的影响[J].湖南农业大学学报,2007,33(6):687-789.
[3]关洪斌,王晓兰.海水胁迫下水杨酸对玉米幼苗抗性的影响[J].广州农业科学,2007,35(5):18-19.
[4]余文英,王伟英,邱永祥,等.水杨酸对甘薯抗薯瘟病和抗氧化酶系统的影响[J].福建农林大学学报,2008,37 (1):23-26.
[5]张荣萍,麻利豪,王鹏,等.水杨酸对番木瓜环斑病的防治效果[J].热带农业科学,2007,27(6):20-22.
[6]杨玲,陈婴芳.水杨酸浸种对水稻种子萌发及幼苗某些生理特征的影响[J].种子,2000,112(6):3-4.
[7]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:8.
[8]刘燕云,曹洪法.酸雨和SO2作用下SOD酶活性与菠菜叶片损伤相关性研究[J].应用生态学报,1993,16(5): 971-976.
[9]张志良.植物生理学实验指导[M].3版.北京:高等教育出版社,2003:258-276.
[10]赵雨云,田玉峰,尹剑华.水杨酸对芫荽种子萌发及幼苗生长的影响[J].现代农业科学,2009,16(8):12-13.
[11]朱霞,王晓丽,陈诗.水杨酸对云南松种子萌发及幼苗生长的影响[J].山东林业科技,2009,4(3):15.
[12]向华,饶力群,肖立锋.水杨酸对水稻种子萌发及生理生化的影响[J].湖南农业大学学报,2003,29(1):12-14.
[13]张春光,荆红梅,郑海雷,等.水杨酸诱导植物抗性的研究进展[J].生命科学研究,2001,5(3):185-189.
