海南毛薯干粉中总还原糖含量的测定
2012-12-07黄广民
何 娇, 黄广民
(海南大学食品学院,海南海口 570228)
海南毛薯干粉中总还原糖含量的测定
何 娇, 黄广民
(海南大学食品学院,海南海口 570228)
以葡萄糖为标准溶液,以3,5-二硝基水杨酸为显色剂,用分光光度法测定海南毛薯干粉中总还原糖含量.结果表明:在波长480 nm处有最大吸收峰,测定回收率最大为101.9%,最小为99.7%,相对误差为±1.9%.实测得毛薯干粉中总还原糖含量为71.08%,毛薯中淀粉含量为63.97%.
海南毛薯;还原糖;分光光度法
毛薯(Dioscorea esculenta(Lour.)brukill)又名甜薯、蒂薯、蔓眉(黎语)等,为薯蓣科薯蓣属藤本植物.海南毛薯有甜薯和蒂薯两个品种,有人工种植,也有野生品种.蒂薯属革质攀援藤本,蔓长130~150 cm,蔓细而硬,每节生刺,叶片厚,绿色,呈心脏形,结薯集中且多露于土壤表面,每株结薯约10~12个,最多可高达二十多个.蒂薯薯块呈椭圆形或长圆形,根毛少而短,表皮赤褐色,薯肉白色细软,带黏性,富含淀粉,味稍淡且甜,煮熟后不易脱皮.甜薯属攀绕藤本,茎蔓青紫色,蔓长100~130 cm,结薯比蒂薯少,每株结薯约8~10个,最多可结薯十多个.甜薯结薯较深,薯块大,呈长圆形,表皮赤褐色,根毛多而长,薯皮革质,肉质细软,富含淀粉,含糖分高,煮熟后易脱皮,味甜可口.
海南毛薯适应性广,各种旱地土壤均可种植,但火山灰土壤种植,淀粉含量最高.每年2~3月播种,9~10月收获,不需要特别进行田间管理,亩产鲜薯可达1 000~2 500 kg,适当的田间管理,产量可突破3 000 kg.毛薯是海南特产的农家杂粮,男女老少,一年四季,均可食用.具有健脾止泻,益肺滋肾,解毒敛疮的功效[1].
海南省独特的自然条件非常适宜于海南毛薯的生长,毛薯已成为海南省的一大特产.据统计,全省每年种植面积约1.8×107m2以上.海南出产的毛薯,产量高、品质优、口感好,深受岛上居民喜爱.海南毛薯富含淀粉,是制备酒精的理想原料.还原糖和淀粉含量是毛薯制备酒精的关键性指标,毛薯中总还原糖含量乘以0.9便是其淀粉含量.毛薯干粉中总还原糖测定尚未见文献报道,因此,本研究开展了这方面的工作.
1 材料与方法
1.1 材料与试剂
1.1.1 材料
海南毛薯(以下简称毛薯)干粉制备:新采收的毛薯,去毛、洗净、切片、烘干,粉碎至80~100目,得含水量为8% ~12%干粉,备用.
1.1.2 试剂
盐酸、氢氧化钠、酒石酸钾钠、苯酚、亚硫酸氢钠、3,5-二硝基水杨酸、葡萄糖等,所有试剂均为分析纯.
1.2 仪器与设备
721-型分光光度计,上海精密科学仪器有限公司;齿爪式粉碎机、不锈钢水解反应釜等.
1.3 标准溶液的配制
1.3.1 葡萄糖标准溶液的配制
准确称取预先于105℃烘箱中干燥至恒重的葡萄糖0.100 0 g,用少量蒸馏水溶解,转入100 mL容量瓶,加蒸馏水稀释定容,得质量浓度为1 mg/mL葡萄糖标准溶液[2].
1.3.2 DNS显色剂的制备
甲液:称取6.9 g重蒸馏的苯酚溶解于15.2 mL 10%氢氧化钠溶液中,稀释至69 mL,加入6.8 g亚硫酸氢钠,摇匀.
乙液:称取225 g酒石酸钾钠于1 000 mL烧杯中,加入300 mL 10% 氢氧化钠溶液,搅拌溶解,加入880 mL 1%3,5-二硝基水杨酸(DNS)溶液,激烈摇匀.
将甲液与乙液充分混合,贮于棕色瓶中,室温下于阴凉处放置一周,备用[3].
1.4 实验原理
在中性或偏碱性条件下,3,5-二硝基水杨酸与葡萄糖共热被还原生成棕色氨基化合物,其反应式如下:

在一定范围内,葡萄糖的质量浓度与溶液的吸光度成正比,利用分光光度法可测定毛薯干粉中总还原糖的含量[4].
1.4 高压氧治疗[2] 治疗组所有患者在引流管拔除24 h后开始行高压氧治疗。采用空气加压多人舱,治疗压力2 ATA,加减压时间各20 min,稳压65 min、中间停止吸氧(休息)5 min,每天1次,10次为一个疗程,治疗2~3个疗程。
1.5 样品处理
准确称取5.000 0 g毛薯干粉于三颈烧瓶中,按一定料液比加入一定浓度的稀盐酸,调成粉浆.装上回流冷凝管,在一定温度下,水解一定时间,水解液用氢氧化钠溶液中和,转入250 mL容量瓶,用蒸馏水稀释定容,摇匀,备用.
1.6 DNS的比色测定
准确吸取5.0 mL毛薯水解稀释液于100 mL容量瓶,加蒸馏水稀释定容,摇匀.分别准确吸取1.0 mL水解稀释液于50 mL容量瓶,加入1.5 mL DNS溶液、2.0 mL蒸馏水,于沸水浴中加热5 min,显色,迅速冷却,用蒸馏水稀释定容,摇匀.另取50 mL容量瓶,加入1.5 mL DNS显色剂、2.0 mL蒸馏水,方法与上述相同,加蒸馏水稀释定容作空白液.选用1 cm比色皿,选择适当的吸收波长,分别测定其吸光度,按式(1)计算水解液中总还原糖含量[5].

式(1)中,A为水解液的吸光度;W为毛薯质量,g;M为工作曲线的斜率.
2 结果与分析
2.1 最大吸收波长的选择
准确吸取1.0 mg/mL葡萄糖标准溶液1.0 mL于50 mL容量瓶中,按 1.6中方法[6],配成 0.020 mg/mL标准葡萄糖溶液,选择不同的吸收波长,选择1 cm的比色皿,分别测定其吸光度(并以1.5,2.0 mg/mL葡萄糖标准溶液作对照),结果见图1.

图1 波长与吸光度的关系Fig.1 Relationship between wavelength and absorbance
从图1可以看出,质量浓度为1.0 mg/mL的葡萄糖标准溶液在480 nm处有最大吸收峰,而作为对照组的质量浓度为1.5,2.0 mg/mL葡萄糖标准溶液的最大吸收波长也在480 nm处,故选择较佳测定波长为480 nm.
2.2 标准工作曲线的绘制
准确吸取1.0 mg/mL葡萄糖标准溶液于50 mL容量瓶,按1.6中方法,分别配成质量浓度分别为0,0.002,0.004,0.006,0.008,0.010,0.012,0.014,0.016,0.018,0.020,0.022,0.024,0.026,0.028,0.030,0.032,0.034,0.036,0.038,0.040 mg/mL 的葡萄糖标准溶液.选择1 cm比色皿,在480 nm处测定吸光度.以葡萄糖质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,结果见图2.

图2 葡萄糖含量测定标准曲线Fig.2 Standard curve for glucose determination
从图2可以看出,随着葡萄糖质量浓度的增大,吸光度呈线性上升.作一元回归分析,得到吸光度对葡萄糖质量浓度的回归方程为:Y=22.57X-0.010 9(R2=0.996 1).
2.3 正交试验设计
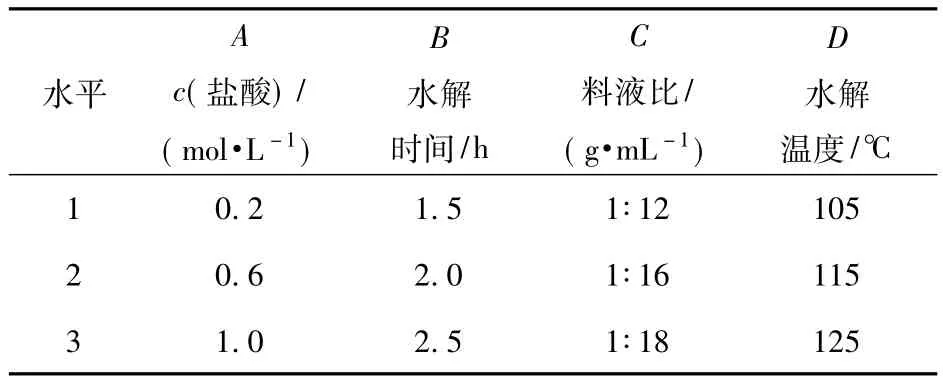
表1 正交试验因素水平表Tab.1 Factors and levels in L9(34)orthogonal test
准确称取5.0000 g毛薯干粉,按L9(34)正交表的料液比,加入一定量的盐酸溶液,调成粉浆.在一定温度下,水解一定时间,水解液用氢氧化钠溶液中和,转入250 mL容量瓶,加蒸馏水稀释定容.准确吸取5.00 mL水解稀释液于100 mL容量瓶,加蒸馏水稀释定容,摇匀.准确吸取1.0 mL水解稀释液于50 mL容量瓶,按1.6中方法,选择1 cm比色皿,于480 nm处测定其吸光度,其试验结果与极差分析情况见表2.

表2 L9(34)正交试验结果与极差分析Tab.2 Analysis of variance and results of L9(34)orthogonal test
由表2极差R分析可知,影响毛薯粉浆水解的因素主次顺序:料液比>水解温度>水解时间>盐酸浓度.毛薯粉浆料液比是主要的影响因素,其次是水解温度、水解时间,影响最小的是盐酸浓度,优化的反应组合是A3B2C1D3,即当盐酸浓度1.0 mol/L,水解时间2.0 h,料液比(g/mL)1∶12,水解温度125℃时,毛薯粉浆水解液的吸光度最高,达到0.227.然而,正交试验确定的优化条件,不一定是全部实验中最佳的条件.因正交试验设计时,每个试验参数都是随机的,其因素水平不同,所得的结果也不一样.因此,本文又进一步做单因素实验,单独考察各主要因素对毛薯粉浆水解的影响[9-10].
2.4 盐酸浓度对毛薯粉浆水解的影响
准确称取5.000 0 g毛薯干粉于三颈烧瓶中,分别按1∶16 料液比(g/mL)加入0.025,0.050,0.075,0.10,0.20,0.30,0.40,0.50,0.60,0.70,0.80,0.90,1.00 mol/L的盐酸溶液,调成粉浆.装上回流冷凝管,水解温度103℃,水解时间2.0 h,水解液用氢氧化钠溶液中和,转入250 mL容量瓶,加蒸馏水稀释定容.准确吸取5.0 mL水解稀释液于100 mL容量瓶,加蒸馏水稀释定容,摇匀.准确吸取1.0 mL水解稀释液于50 mL容量瓶,按1.6中方法,选择1 cm比色皿,于480 nm处测定其吸光度,结果见图3.

图3 盐酸浓度对毛薯粉浆水解的影响Fig.3 Effects of hydrochloric acid concentration on hydrolysis of dry powder of Dioscorea esculenta(Lour.)brukill
从图3可以看出,盐酸浓度小于0.30 mol/L时,随着盐酸浓度的增大,毛薯粉浆水解液的吸光度呈线性急剧上升;盐酸浓度为0.30 mol/L时,水解液的吸光度达到最大值;当盐酸浓度大于0.3 mol/L时,随着盐酸浓度的增大,水解液的吸光度呈缓慢下降趋势.其原因在于盐酸浓度增大,毛薯水解液中的还原糖分解严重,吸光度便下降.因此毛薯粉浆水解较佳的盐酸浓度为0.3 mol/L.
2.5 水解时间对毛薯粉浆水解的影响
准确称取5.000 0 g毛薯干粉于三颈烧瓶中,分别按1∶16料液比(g/mL)加入0.3 mol/L盐酸溶液,调成粉浆.装上回流冷凝管,水解温度103℃,水解时间为0.5~3.0 h,按0.5 h增序.水解液用氢氧化钠溶液中和,转入250 mL容量瓶,加蒸馏水稀释定容.准确吸取5.00 mL水解稀释液于100 mL容量瓶,加蒸馏水稀释定容,摇匀.准确吸取1.0 mL水解稀释液于50 mL容量瓶,按1.6中方法,选择1 cm比色皿,于480 nm处测定其吸光度,结果见图4.

图4 水解时间对毛薯粉浆水解的影响Fig.4 Effects of hydrolytic time of dry powder of Dioscorea esculenta(Lour.)brukill
由图4可以看出,随着水解时间的延长,毛薯粉浆水解液的吸光度呈线性上升.水解时间为2.0 h时,水解液的吸光度达到最大值.当水解时间大于2.0 h时,继续延长水解时间,水解液吸光度几乎保持不变,可认为水解时间大于2.0 h后,毛薯中的多糖几乎全部水解,再延长水解时间,对水解液吸光度的影响不大,甚至有下降的趋势.主要是因为反应体系中副产物的增加,导致还原糖自身的分解及与副反应产物进行缩合反应所致的[11].所以优化水解时间以2.0 h为宜.
2.6 料液比对毛薯粉浆水解的影响
准确称取5.000 0 g毛薯干粉于三颈烧瓶中,分别按料液比(g/mL)1∶5,1∶10,1∶16,1∶20,1∶25,1∶30的比例加入0.3 mol/L盐酸溶液,调成粉浆.装上回流冷凝管,水解温度103℃,水解时间2.0 h.水解液用氢氧化钠溶液中和,转入250 mL容量瓶,加蒸馏水稀释定容.分别准确吸取5.0 mL水解稀释液于100 mL容量瓶,加蒸馏水稀释定容,摇匀.准确吸取1.0 mL水解稀释液于50 mL容量瓶,按1.6中方法,选择1 cm比色皿,于480 nm处测定其吸光度,结果见图5.

图5 料液比对毛薯干粉水解的影响Fig.5 Effects of ratio of material-liquid on hydrolysis of dry powder of Dioscorea esculenta(Lour.)brukill
从图5可以看出,料液比小于1∶16时,随着料液比的增大,毛薯粉浆水解液的吸光度呈上升趋势.因为料液比的大小决定了水解液的流动性,当比例小于1∶16时,水解液黏度过高,流动性差,盐酸中的氢离子作用于淀粉链内部葡萄糖糖苷键上氧原子的几率较小,所以会导致水解效果不佳[12].当料液比为1∶16时,水解液的吸光度达到最大值.料液比大于1∶16时,随着料液比的增大,水解液的吸光度缓慢下降.主要是由于随着料液比的增大,底物可被充分水解,但是过多的H+则会使得水解后的还原糖进一步分解.因此优化料液比为1∶16.
2.7 水解温度对毛薯粉浆水解的影响
准确称取5.000 0 g的毛薯干粉于三颈烧瓶,按料液比1∶16的比例,分别加入0.3 mol/L盐酸溶液,调成粉浆.装上磨口玻璃塞,置于不锈钢高反应压釜中,水解温度为105~135℃,按5℃的温度增序,水解时间2.0 h.水解液用氢氧化钠溶液中和,转入250 mL容量瓶,加蒸馏水稀释定容.分别准确吸取5.0 mL水解稀释液于100 mL容量瓶,加蒸馏水稀释定容,摇匀.准确吸取1.0 mL水解稀释液于50 mL容量瓶,按1.6中方法,选择1 cm比色皿,于480 nm处测定其吸光度,结果见图6.

图6 水解温度对毛薯干粉水解的影响Fig.6 Effects of hydrolytic temperature on dry powder of Dioscorea esculenta(Lour.)brukill
从图6可以看出,水解温度小于110℃时,随着水解温度的增大,毛薯粉浆水解液的吸光度急剧增大,而后趋于平缓.水解温度为110℃时,吸光度稳定在高值.水解温度大于110℃时,水解液的吸光度缓慢下降,水解液的色泽逐渐加深.表明水解温度升高,会加速盐酸中H+作用于葡萄糖糖苷键上的氧原子,进而使水解液中还原糖分解严重[12].因此水解温度采用110℃.
2.8 重现性实验结果
准确称取5.000 0 g毛薯干粉,按料液比为1∶16比例加入0.3 mol/L的盐酸溶液,调成粉浆.装上磨口玻璃塞,置于不锈钢高压反应釜中,水解温度110℃,水解时间2.0 h.水解液用氢氧化钠溶液中和,转入250 mL容量瓶,加蒸馏水稀释定容.分别准确吸取5.0 mL水解稀释液于100 mL容量瓶,加蒸馏水稀释定容,摇匀.准确吸取1.0 mL水解稀释液于50 mL容量瓶,按1.6中方法,选择1 cm比色皿,于480 nm处测定其吸光度,其结果见表3.

表3 毛薯还原糖测定的重复性实验结果Tab.3 Results of repeatability experiment on determination of reducing saccharidein from Dioscorea esculenta(Lour.)brukill
从表3可以看出,标准偏差为±0.006 7,相对平均标准偏差为±2.15%,重现性好,相对误差小,根据标准回归曲线和计算公式,可计算出毛薯干粉中总还原糖的含量为71.08%.将毛薯干粉中总还原糖含量,乘以0.9便可得到毛薯干粉中淀粉含量为 63.97%[13].
2.9 标准回收实验结果
准确称取5.000 0 g毛薯干粉于三颈烧瓶中,按料液比为1∶16比例加入0.3 mol/L的盐酸溶液,调成粉浆.装上磨口玻璃塞,置于不锈钢高压反应釜中,水解温度110℃,水解时间2.0 h.水解液用氢氧化钠溶液中和,转入250 mL容量瓶,加蒸馏水稀释定容.准确吸取5.0 mL水解稀释液于100 mL容量瓶,加蒸馏水稀释定容,摇匀.分别准确吸取1.0 mL水解稀释液于50 mL容量瓶,加入1 mg/mL标准葡萄糖溶液0,0.1,0.2,0.3,0.4,0.5 mL,按1.6 中方法,选择1 cm比色皿,于480 nm处测定其吸光度,计算水解液中葡萄糖的标准回收率[14],结果见表4.

表4 毛薯干粉中总还原糖测定标准回收实验结果Tab.4 Results of recovery experiment of reducing saccharide in spiked Dioscorea esculenta(Lour.)brukill
由表4可以看出,采用葡萄糖为标准溶液,DNS作显色剂,测定毛薯干粉中总还原糖的含量,标准回收率最高为101.9%,最低为99.7%,相对误差为±1.9%,相对误差小[15],标准回收率高,效果好.
3 结论
用分光光度法可测定海南毛薯干粉中总还原糖的含量.毛薯经晒干或烘干,粉碎至80~100目,按料液比1∶16的比例,加入0.3 mol/L盐酸溶液,调成粉浆,水解温度110℃,水解时间2.0 h,水解液用氢氧化钠溶液中和,水解液不需分离,直接用葡萄糖作标准溶液,用3,5-二硝基水杨酸溶液作显色剂,于沸水浴中加热显色,迅速冷却,加蒸馏水稀释定容,于480 nm处测定其吸光度.测定回收率最大为101.9%,最小为99.7%,相对误差为±1.9%.实测得毛薯干粉中总还原糖含量为71.08%,毛薯中淀粉含量为63.97%.
[1]王茀能,汪飞杰,王天云,等.海南岛大薯、毛薯等资源考察报告[P].作物品种资源,1991,2(3):8.
[2]黄广民,刘秋实.香/芭蕉根部球茎干粉中还原糖含量的测定[J].食品科学,2008,29(8):485-488.
[3]罗志刚,曾满枝,凌晨,等.3,5二硝基水杨酸比色法测定烟草中水溶性总糖[J].中国烟草科学,2000(2):34-36.
[4]守正祥.食品分析手册[M].北京:中国轻工业出版社,1998.
[5]许庆芬,吕文河,石瑛,等.马铃薯块茎还原糖的测定方法比较[J].中国马铃薯,2004,6(18):338-340.
[6]赵凯,许鹏举,谷广烨.3,5一二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[7]大连轻工业学院,华东理工大学,郑州轻工业学院,等.食品分析[M].北京:中国轻工业出版社,1999.
[8]马延和,周培谨.浅谈寡糖的开发和应用[J].食品与发酵工业,1992(1):80-82.
[9]Nagie N,Ibsen K,Jennings E.A process economic approach todevelop adilute-acid cellulose hydrolysis process to produce ethanol from biomass[J].Appl Biochem Biotechnol,1999(77/79):599-607.
[10]林颖,吴毓敏.天然产物中的糖含量测定方法正确性的研究[J].天然产物研究与开发,1996,8(4):5-9.
[11]余先纯,孙德林,李湘苏.微波固体酸联合水解棉籽壳制备还原糖的研究[J].食品工业科技,2011,32(1):207-211.
[12]陈伟.香蕉根球茎粉浆糖化工艺研究[D].海口:海南大学,2011.
[13]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:14.
[14]孙伟伟,曹维强,王静.DNS法测定玉米秸秆中总糖[J].食品研究与开发,2006(6):120-124.
[15]华东理工大学化学系,四川大学化工学院.分析化学[M].北京:高等教育出版社,2003(7):7-10.
[16]Miller G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Anal Chem,1959,31(3):426-428.
[17]李谊轩,黄广民.参薯干粉中总还原糖含量的测定[J].食品科技,2011,36(9):322-326.
(责任编辑:叶红波)
Determination of Total Reducing Saccharide in Hainan Dioscorea Esculenta(Lour.)brukill
HE Jiao,HUANG Guang-min
(College of Food Science,Hainan University,Haikou 570228,China)
Using glucose as standard and DNS as color developing reagent,the content of total reducing saccharide in Hainan Dioscorea esculenta(Lour.)brukill was determined by spectrophotometry.The results showed that the maximum absorption wavelength of the sample was 480nm.The maximum recovery rate was determined as 101.9%,and the minimum was 99.7%.The relative error was±1.9%.The content of total reducing saccharide and starch in Hainan Dioscorea esculenta(Lour.)brukill was 71.08%and 63.97%,respectively.
Hainan Dioscorea esculenta(Lour.)brukill;reducing saccharide;spectrophotometry
TS201;TS215
A
1671-1513(2012)05-0056-06
2012-04-06
海口市重点科技计划项目(0000017).
何 娇,女,硕士研究生,研究方向为糖及碳水化合物化学和生物质能源;
黄广民,男,教授,主要从事糖及碳水化合物化学和生物质能源方面的研究.通讯作者.
