癌胚抗原T、B细胞表位短肽诱导特异性体液免疫反应研究
2012-12-07肖德双蒋佩佩邵欢义应江辉朱珊丽薛向阳张丽芳朱冠保
陈 江 肖德双 吴 乐 蒋佩佩 邵欢义 应江辉 朱珊丽 薛向阳 张丽芳 朱冠保
癌胚抗原(CEA)是肿瘤相关抗原[1]。正常情况下CEA经胃肠道代谢,而肿瘤状态时的CEA则进入血和淋巴循环,引起血清CEA异常增高。分泌CEA的肿瘤大多位于空腔脏器,如胃肠道、呼吸道、泌尿道等。既往的研究已证实,CEA可诱导机体产生特异性细胞和体液免疫,从而抑制体内肿瘤细胞生长,因此CEA是肿瘤疫苗研究的靶抗原之一。目前,基于CEA的一些细胞表位已被鉴定,本实验室也对CEA的B细胞表位进行了分析报道[2~4]。本研究在既往研究基础上,选择富含T、B细胞表位的短肽基因,通过原核表达系统制备多表位融合蛋白并分析其诱导机体产生特异性体液免疫反应的特征,为该短肽的进一步应用研究奠定基础。
材料与方法
1.材料:(1)主要试剂:限制性核酸内切酶XholⅠ、BamHⅠ、IPTG和预染蛋白Marker购自MBI公司。6×His-Tag单克隆抗体购自Bethyl公司、HRP-山羊抗小鼠IgG(H+L)及HRP-山羊抗兔IgG(H+L)抗体购自MultiSciences公司。金属螯合纯化试剂盒Ni-NTA购自德国QIAGEN公司。胎牛血清、细胞培养基RPMI1640购自美国Gibco公司。弗氏佐剂购自Sigma公司。膜蛋白提取试剂盒(Membrane Protein Extraction kit)购买自上海BestBio生物技术公司。(2)质粒和细胞株:原核表达载体pET32a(+)和E.coli BL21(DE3)菌株由本实验室保存。Lovo细胞购自中国科学院上海生命科学研究院细胞库。(3)动物:健康日本大耳白兔,雌性,体重1.8~2.4kg,由温州医学院实验动物中心提供。
2.方法:(1)CEA多表位短肽的预测、筛选:CEA氨基酸序列来自GeneBank公布的数据(M17303)。根据本实验室已预测结果,经综合比较分析,评判确定CEA的B细胞优势表位,筛选B细胞表位基因。CTL细胞表位的预测应用SYFPEITHI超基序法远程预测由9个氨基酸残基组成的CEA的CTL表位,即利用Intenet网络进入SYFPEITH I主页(http://www.uni-tuebingen.de/uni/kxi)介绍的方法,对 CEA 的HLA-A*0201限制性CTL表位及HLA-A24和H2-Kd进行远程预测[4,5]。(2)CEA多表位目的基因的获得:选择CEA蛋白序列中含有抗原指数较高的B表位,同时选择位于B表位上下游的分值较高的HLA-A2,A24及H2-Kd限制性的CTL表位作为多表位的组成成分,共同组成含CTL和B细胞表位的多表位肽。即筛选CEA氨基酸序列580~598区域(NRSDPVTLD VLYGPDTPII)的基因进行研究。并选取原核系统偏爱的氨基酸密码子进行密码子优化确定核苷酸序列,分别设计核苷酸的正、反链,并在其上、下游引入限制性内切酶XhoⅠ(酶切位点为CTC GAG)和BamHⅠ(酶切位点为GGATCC)的酶切位点,其序列如下:正向引物:5'gatc caaccgcagcgatccggtcactttagacgtcttgtatgggcccgatactccgattattc 3';反向引物:5'tcgagaataatcggagt atcgggcccatacaagacgtctaaagtgaccggatcgctgcggttg 3'。上述序列委托上海生工生物工程技术服务有限公司合成。将合成的互补寡核苷酸分别退火,获得双链的目的基因。(3)CEA多表位基因重组质粒的构建和鉴定:通过XhoⅠ和BamHⅠ酶切位点,将获得双链的目的基因克隆到pET32a(+)载体,构建重组质粒pET32a(+)/CEA580~598多表位,并通过测序鉴定。(4)CEA多表位基因重组质粒的原核表达和鉴定:将鉴定后的阳性质粒转化E.coli BL21(DE3)后,接种于LB培养液(100μg/ml Amp),37℃培养过夜。加入 IPTG(终浓度为1mmol/L)诱导4h,10000×g离心5min收集细菌。取IPTG诱导前和诱导4h的菌液,经PBS洗涤、离心、超声破菌,10000×g离心10min收集上清,进行SDS-PAGE分析。同时,以小鼠抗6×His单克隆抗体为一抗和HRP-山羊抗小鼠IgG(H+L)为二抗,进行Western blotting分析。(5)CEA多表位融合蛋白的的纯化:收集诱导表达后的菌液,5000×g于4℃离心 10min,收集菌体,pH8.0的 Buffer B(8mol/L尿素,100mmol/L NaH2PO4,10mmol/L Tris- Cl)重悬,并加入 PMSF至终浓度为1mmol/L,冰浴中超声破菌、离心后,用Ni-NTA Agarose柱纯化、洗脱,收集蛋白峰。(6)Western blotting分析:CEA多表位融合蛋白经SDS-PAGE电泳分离后,转印至硝酸纤维膜上,用5%脱脂奶粉-TBST于4℃封闭过夜,漂洗3次后加入1∶5000稀释的小鼠抗6×His单克隆抗体或1∶200稀释的免疫兔血清为一抗,37℃震荡孵育1h,漂洗3次后加入1∶2000稀释的HRP-山羊抗小鼠 IgG(H+L)或1∶5000稀释的HRP标记的山羊抗兔IgG(H+L)为二抗,再于37℃震荡孵育1h,漂洗3次后DAB显色。(7)动物免疫:日本大耳白兔随机分为3组,每组3只。分别用纯化的CEA多表位融合蛋白、Trx-His(空载载体蛋白)和PBS与等体积福氏佐剂充分混匀进行背部皮内多点注射免疫。抗原免疫剂量100微克/只(体积500μl),隔2周加强免疫,共3次。于末次免疫后第2周心脏采血分离免疫血清。(8)免疫血清特异性抗体ELISA检测:根据膜蛋白提取试剂盒(BestBio公司)操作手册,提取Lovo细胞的膜蛋白作为天然CEA抗原。分别以纯化的CEA多表位融合蛋白抗原(2μg/ml)和天然CEA抗原(Lovo细胞膜蛋白)(1×107/ml)包被ELISA反应板,5%脱脂奶粉封闭,PBST洗涤5次,每孔加入稀释的兔免疫血清,置37℃ 2h,PBST洗涤5次,每孔加入1∶2000稀释的HRP-标记的100μl山羊抗兔IgG(H+L),置37℃ 1h,PBST洗板5次后OPD显色,每孔加入50μl的2mol/L H2SO4终止反应,酶标仪测A490值。每份血清标本均重复3孔检测,并设标准阳性对照和阴性对照。
结 果
1.CEA多表位预测和筛选结果:根据SYFPEITH I法预测分值均较高(分值>20)的CTL表位,结合本实验室既往B细胞表位预测的结果(NRSDP),选择在其序列下游的多个CTL表位序列(PVTLDVLYGPDTPII),即 CEA580~598(NRSDPVTLDVLYGPDTPII)共同组成CEA多表位目的短肽。其中CEA580~584为预测的B细胞表位,CEA589~597为HLA-A2限制性CTL表位,CEA590~598既为 H2-Kd限制性CTL表位又为HLA-A24限制性CTL表位(图1)。
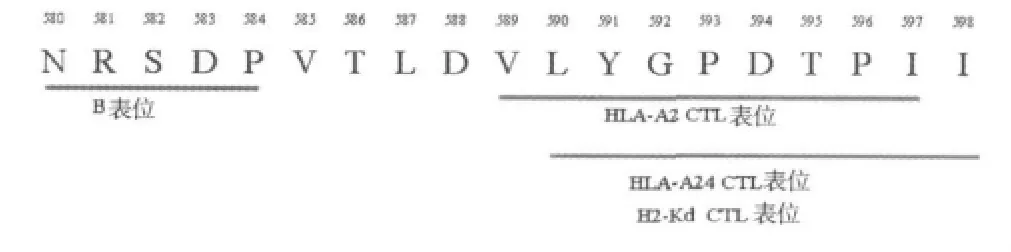
图1 CEA580~598短肽表位分布
2.CEA多表位重组质粒构建和鉴定:将引物退火,得到含CTL、B细胞表位的目的基因,分别插入经XhoⅠ和BamHⅠ酶切纯化得到的pET32a(+)质粒,构建重组质粒pET32a(+)/CEA580~598。重组质粒经测序结果经BLAST分析显示插入的表位基因序列与设计的碱基序列完全一致(图2)。

图2 CEA多表位重组质粒测序图
3.CEA多表位重组质粒的表达及目的蛋白纯化和鉴定:转化入E.Coli BL21(DE3)的阳性单克隆菌落经终浓度为1mmol/L的IPTG诱导表达和SDSPAGE分析,结果显示:IPTG诱导6h后,在分子质量约21kDa可见特异性的染色条带,与预期融合蛋白的分子质量相等(图3A),经Bandscan软件分析该蛋白表达量占总蛋白的25.6%。进一步将诱导表达后的细菌超声破碎、离心,取上清通过Ni-NTA Agarose亲和层析柱分离纯化,以鼠抗His单克隆抗体为一抗,经Western blotting检测,显示在分子质量约21kDa处出现特异性阳性信号条带,空载体转化的E.Coli BL21(DE3)则在分子质量约18kDa处出现特异性阳性信号条带,未转化的E.Coli BL21(DE3)均未显示阳性信号条带(图3B)。以CEA阳性大肠癌患者血清为一抗,经Western blotting检测,显示在分子质量约21kDa处出现特异性阳性信号条带,而空载体和未转化的E.Coli BL21(DE3)均未显示阳性信号条带(图3C)。

图3 纯化的CEA多表位融合蛋白SDS-PAGE电泳及Western boltting分析
4.CEA多表位融合蛋白免疫血清抗体效价ELISA分析:CEA580-598融合蛋白以1.0μg/ml浓度包被酶标板,采用ELISA法检测CEA多表位融合蛋白、Trx-his和PBS兔免疫血清的抗体效价。CEA多表位融合蛋白免疫血清抗体水平明显高于Trxhis和PBS对照组(图4)。
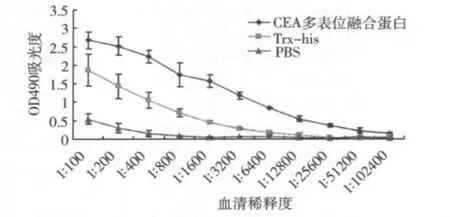
图4 不同稀释度CEA多表位融合蛋白免疫血清抗体效价ELISA分析
5.CEA580~598短肽兔免疫血清对天然CEA抗原的反应:用Lovo细胞提取的膜蛋白作为包被抗原,ELISA方法检测末次免疫后2周的CEA580~598兔免疫血清对天然CEA抗原的识别能力,分别以Trx-his和PBS免疫兔制备的兔血清抗体为对照。结果,CEA多表位免疫血清抗体水平(0.390±0.100)显著高于Trx-his对照组(0.045 ±0.030)和 PBS 对照组(0.034 ±0.027),3组比较具有显著性差异(P≤0.05)(图5)。

图5 ELISA检测不同免疫组血清对天然CEA抗原的识别
讨 论
CEA是最常见的肿瘤标志物。文献报道CEA在胃肠道肿瘤、乳癌、肺癌及大多数上皮来源的肿瘤患者血清中有不同程度的升高,且血清CEA水平与病程进展和复发有一定的平行相关关系[1,6~8]。因此,CEA是肿瘤诊断和病情监测中最常用的一种肿瘤标志物。CEA检测对消化系统恶性肿瘤的早期诊断、疗效观察、提示复发转移及治疗方案的选择具有较大的参考价值。CEA尤其在大肠癌肿瘤组织中呈高表达,研究表明,CEA能诱导机体产生较强的细胞和体液免疫,并可抑制体内肿瘤细胞生长,因此,CEA是研究大肠癌肿瘤疫苗的候选靶抗原之一,且已经进入临床Ⅰ期研究[2,9,10]。但是,由于与 CEA 具有机体某些蛋白如反应蛋白(NCA)和胆汁糖蛋白(BGP)等有共同序列,可能产生交叉广泛而影响CEA全长蛋白作为疫苗的使用,因此研究者将研究目标聚集在CEA的多肽及表位的研究上,即可避免产生自身免疫反应,又可产生针对性的特异性免疫反应。
Li等[11]选择CEA氨基酸序列625~667的多肽(CEA625~667),此段序列含有两个Th表位,将其单独及重复3次串联构建DNA疫苗,结果发现BALB/c经此DNA疫苗免疫可产生很强的T细胞增殖反应和血清抗体反应,重复肽则可诱导产生显著的IFN-γ分泌水平及Th1反应。Saha等选择抗-独特型的CEA模拟表位(3H1)结合 HLA-A2限制的 CEA(691~699)和CAP1-6D冲击DC细胞,联合免疫小鼠,能诱导更强的CEA特异的CTL反应和抗瘤效应。刘晶等[12]选择 HLA-A2限制的 CEA605~613表位,在其610位上以天冬氨酸代替天冬酰氨,合成修饰肽(CEA610D),采用同种异体混合淋巴细胞与肽共孵育的方法分析其CTL活性,结果发现,修饰的CEA610D疫苗产生最强的肽特异性CTL活性、CTL所释放的杀伤相关介质穿孔素和上清中IFN-γ的水平也最高。表明,表位或多肽能诱导机体产生特异性的体液免疫和细胞免疫,为CEA表位及多肽疫苗的研究打下了基础。
本研究结合我们既往B细胞表位预测结果,根据SYFPEITH I法预测分值均较高(分值 >20)的CTL表位,选择 CEA580~598(NRSDPVTLDVLYGPDTPII)短肽进行研究。该短肽包含有CEA B细胞表位,含多个Th细胞表位及多个HLA-A2、H2-Kd、HLA-A24限制性的CTL表位,为进一步的动物实验与临床实验研究打下了基础。
为获得大量含表位肽的蛋白,本研究对 CEA CEA580~598的基因进行了大肠杆菌偏好的密码子优化,主要的改变是增加了 GC含量,结果 CEA CEA580~598在大肠杆菌中获得了高效表达,表达量占总蛋白的25.6%。ELISA法检测兔免疫血清显示,日本大耳白兔经CEA多表位融合蛋白免疫3次后的免疫血清抗体水平明显高于trx-His和PBS对照组。Western blotting进一步证实兔免疫血清与CEA多表位融合蛋白结合的特异性。提示,CEA多表位融合蛋白具较强的免疫原性。进一步以Lovo细胞制备的天然CEA抗原包被ELISA板检测兔免疫血清,结果显示,兔免疫血清较对照组血清IgG抗体的效价均值具显著性差异,表明CEA580~598多表位融合蛋白识别Lovo细胞制备的天然CEA抗原,可进一步用于表达CEA的肿瘤检测和免疫学应用的研究。同时,经CEA阳性患者血清为一抗的Western blotting检测分析,表明患者的血清可识别CEA580~598多表位融合蛋白,提示本研究CEA580~598多表位融合蛋白具较强的免疫原性,为进一步研究CEA580~598短肽蛋白的功能及研制多表位疫苗打下了基础。
1 Gold P,Freedman SO.Specific carcinoembryonic antigens of the human digestive system[J].The Journal of experimental medicine,1965,122(3):467-481
2 Greiner JW,Zeytin H,Anver MR,et al.Vaccine-based therapy directed against carcinoembryonic antigen demonstrates antitumor activity on spontaneous intestinal tumors in the absence of autoimmunity[J].Cancer research,2002,62(23):6944 -6951
3 Hou Y,Kavanagh B,Fong L.Distinct CD8+Tcell repertoires primed with agonist and native peptides derived from a tumor-associated antigen[J].JImmunol,2008,180(3):1526 - 1534
4 王鹏飞,欧琴,朱珊丽.肿瘤相关抗原CEA的B细胞表位预测[J].生物工程医学与临床,2007,9(5):4
5 Rammensee H,Bachmann J,Emmerich NP,et al.SYFPEITHI:database for MHC ligands and peptide motifs[J].Immunogenetics,1999,50(3-4):213-219
6 Kuhel WI,Chow H,Godwin TA,et al.Elevated carcinoembryonic antigen levels correlating with disease recurrence in a patient with adenoid cystic carcinoma[J].Head & neck,1995,17(5):431 -436
7 Mulcahy MF,Benson AB.The role of carcinoembryonic antigen monitoring in management of colorectal cancer[J].Current oncology reports,1999,1(2):168 -172
8 Saad A,Abraham J:Role of tumor markers and circulating tumors cells in the management of breast cancer[J].Oncology(Williston Park),2008,22(7):726 -731
9 Berinstein NL.Carcinoembryonic antigen as a target for therapeutic anticancer vaccines:a review[J].JClin Oncol,2002,20(8):2197 -2207
10 Morse MA,Clay TM,Hobeika AC,et al.Phase I study of immunization with dendritic cells modified with fowlpox encoding carcinoembryonic antigen and costimulatory molecules[J].Clin Cancer Res,2005,11(8):3017-3024
11 Li D,Hua S,Fan Y,et al.DNA vaccine expressing repeated carcinoembryonic antigen(CEA)(625-667)induces strong immunity in mice[J].Immunology letters,2011,135(1 ~2):124 -128
12 刘晶,李翠玲,顾洪涛,等.修饰的肿瘤抗原肽CEA610D疫苗的体外抗肿瘤作用[J].中国肿瘤生物治疗杂志,2009,16(2):5
