干姜、大黄和丹参水提物对MPP+诱导的SH-SY5Y细胞凋亡的药性学对比研究※
2012-12-06陈智伟周红祖余惠旻
陈智伟 周红祖 余惠旻*
(1 广东省深圳市中医院,深圳518020;2 深圳大学医学院,深圳518060)
中药四性即中药的寒、热、温、凉四种功能之气,是中医药最重要的基本理论之一。近年来,中药四性理论的研究虽然取得一定进展,对从现代科学视角认知中药四性理论起到一定作用,但从整体上看,研究成果仍不足以促使中药四性理论体系产生质的飞跃。
本课题组前期研究证明:中药药性不同,其抗凋亡作用亦不同[1-3]。来源和功效相同或相近的人参类中药对细胞凋亡的作用存在很大的差异性[4-5]。西洋参(凉性)和红参(温性)水提物均对MPP+诱导的SH-SY5Y细胞凋亡具有不同程度的保护作用[6],而温性中药抗凋亡作用更强;来源和功效不同的中药附子、黄芩和穿心莲对MPP+诱导SH-SY5Y细胞凋亡的作用亦不同,附子(热性)具有显著的保护作用[7]。为了验证其他不同药性的中药也具有相同的作用趋势,本研究运用不同寒热药性的药物——干姜(热)、大黄(寒)和丹参(微寒),观察其对MPP+诱导SH-SY5Y细胞凋亡的作用,以此为建立中药四性的凋亡学模型奠定一定的实验基础。
1 材料
1.1 仪器 CO2培养箱(美国 Shella公司);DC300型倒置荧光相差显微镜(德国Leica公司);超净工作台(比利时Esco 公司);Rotofix32型离心机(德国Hettich公司);AllegraTM21R型低温离心机(美国Coulter公司);Epics XL型流式细胞仪(美国 Coulter公司);Polar star Galaxy型酶标仪(德国BMG公司)。
1.2 试药 干姜、大黄、丹参均购于深圳华辉药业有限公司,由深圳市中医院中药科刘志诚主任药师鉴定为正品。MPP+、MTT、二甲基亚砜(DMSO)、碘化丙啶(PI)、RNA酶(RNase)均购自美国 Sigma公司;1640培养基、胰酶(trypsin,美国Gibico公司);胎牛血清(FBS,美国Hyclone公司);Hoechst 33258(瑞士Fluka公司)。
1.3 细胞 SH-SY5Y细胞取自中山大学医学院细胞库。
2 方法
2.1 药物制备
2.1.1 中药(干姜、大黄、丹参)水提物的制备 取干姜、大黄、丹参中药材各100g粉碎,加8倍蒸馏水浸泡0.5 h,水浴2h,纱布过滤,滤渣先后加6倍、4倍量水,各提0.5h。合并3次滤液,冷冻干燥,得到干姜、大黄、丹参冻干粉各12.24g、24.00g和41.70g。冻干粉溶于灭菌去离子水,12000r·min-1,离心 5min,上清液过 0.22μm的滤膜,配成 400mg·mL-1(生药浓度)的母液,实验前用培养基稀释成所需浓度(终浓度以生药浓度计)。
2.1.2 MPP+去离子水配制成80mmol·L-1的母液,-20℃保存。用时培养基稀释成实验所需浓度。
2.2 细胞培养与预处理 用含有体积分数为 10 %的FBS,1%的非必须氨基酸(NEAA)的1640完全培养基,于37℃、5%的CO2孵箱中培养。4d进行1次传代,传代时取0.2ml细胞悬液(密度为8×106·mL-1)加入到 9 mL 培养基中,取生长期细胞进行实验。
2.3 实验分组 将实验分为5组:即正常对照组、模型租和干姜、大黄、丹参水提物组。
2.4 观察指标和方法
2.4.1 显微镜观察细胞形态 SH-SY5Y 以 7×104·ml-1密度接种于直径为 6cm的培养皿,模型组用终浓度为0.5mmol·L-1的 MPP+作用 60h,干姜、大黄、丹参组分别用 5mg·mL-1和 10mg·Ml-1的水提物与 0.5mmol·L-1的MPP+共同孵育60h,每组均3个复孔,于倒置显微镜下观察并摄片。
2.4.2 MTT法测定细胞存活率 取对数生长期细胞,调整细胞密度为1×104·mL-1,以 100μL·孔-1接入96孔板,37℃、5%的CO2孵箱中培养48h。48h后吸弃旧培养基,正常对照组加入100μL的新鲜培养基,MPP+模型组加入100μL含有 MPP+的培养基,干姜、大黄和丹参水提物组分别加入 100μL含有 MPP+和不同浓度的干姜、大黄和丹参水提物的培养基,各浓度6个复孔。药物作用60h后,每孔加5 mg·mL-1的MTT(PBS配)10μL,4h后,弃培养液,加DMSO 150μL·孔-1,轻轻震荡10 min,使甲臢颗粒溶解,用酶标仪在 570nm处读取吸光度(OD)值,取 6孔均值按下列公式计算,细胞存活率=实验组OD值/对照组OD值×100。各组实验重复3次。
2.4.3 Hoechst 33258染色形态学观察 将 SH-SY5Y细胞(7×104·mL-1)接种于直径为6cm的培养皿的盖玻片上,各实验组按要求给予不同的处理因素后,加入新鲜配制的4%多聚甲醛(pH值为7.4)于37 ℃固定细胞30min,PBS液洗2次,加5mg·L-1Hochest 33258染色液染色30min,PBS液洗后,用封片液(20mmol· L-柠檬酸,50mmol·L-1磷酸氢二钠,50%甘油,pH=5.5)封片后荧光显微镜观察、摄片。
2.4.4 PI单染流式细胞仪测定细胞凋亡率和细胞周期
调整细胞密度为 7×104·mL-1,以 3mL·well-1种入直径为6 cm的培养皿。分组和处理同上,每组6个复孔。药物作用 60h后,细胞刮刮取细胞,1000 r·min-1离心 10 min,去上清液,PBS漂洗 2次,沉淀中缓慢依次加入70%的冰乙醇固定。- 20℃固定24h。固定后,1000r·min-1离心10min,去上清液,PBS漂洗2次,调整细胞浓度为 1×106·mL-1。加 RNase 至终浓度 100μg·mL-1,37℃水浴30min。加PI至终浓度50μg·mL-1,350目尼龙网滤膜过滤去除细胞团块,4℃避光染色30min后,上流式细胞仪检测(激发波长:488nm;发射波长:610nm)各期细胞 DNA的含量。测定数据按流式细胞仪所配置的软件进行数据处理,以DNA组方图出现低于G1期DNA含量的亚G1峰的大小代表凋亡细胞的数值。
2.4.5 统计学处理 全部数据采用 SPSS 1010 统计软件进行统计分析,数据用均数±标准差(±s)表示,组间比较用单因素方差分析检验。P<0.05为差异有统计学意义。
3 结果
3.1 干姜、大黄、丹参水提物对MPP+诱导的SH-SY5Y细胞凋亡的影响 在倒置显微镜下观察发现,传代的SH-SY5Y细胞培养4 h左右贴壁,起初呈梭型或椭圆形,18 h后胞体出现树枝状突起(轴突),以后逐渐显著,胞间的突起相互连接。而模型组细胞(0.5mmol的MPP+)胞浆黯淡,出现空泡和小斑点,轴突消失,细胞皱缩变圆。经Hochest 33258荧光染色后,对照组细胞核呈现出低强度弥散均匀的蓝色荧光,模型组细胞核出现亮蓝色的典型凋亡小体,其细胞核显著固缩、凝聚和碎裂,而干姜、大黄、丹参水提物与0.5mmol MPP+同时处理SHSY5Y 细胞后,干姜组 SH-SY5Y的细胞核与对照组SH-SY5Y的细胞核形态接近,大黄组和丹参组SH-SY5Y的细胞核与模型组SH-SY5Y的细胞核形态接近,说明:干姜水提物对 MPP+诱导的 SH-SY5Y细胞凋亡有显著的保护作用,而大黄和丹参组对 MPP+诱导的SH-SY5Y细胞凋亡无保护作用。10mg·mL-1干姜、大黄、丹参水提物对SH-SY5Y细胞凋亡形态学的影响见图 1。
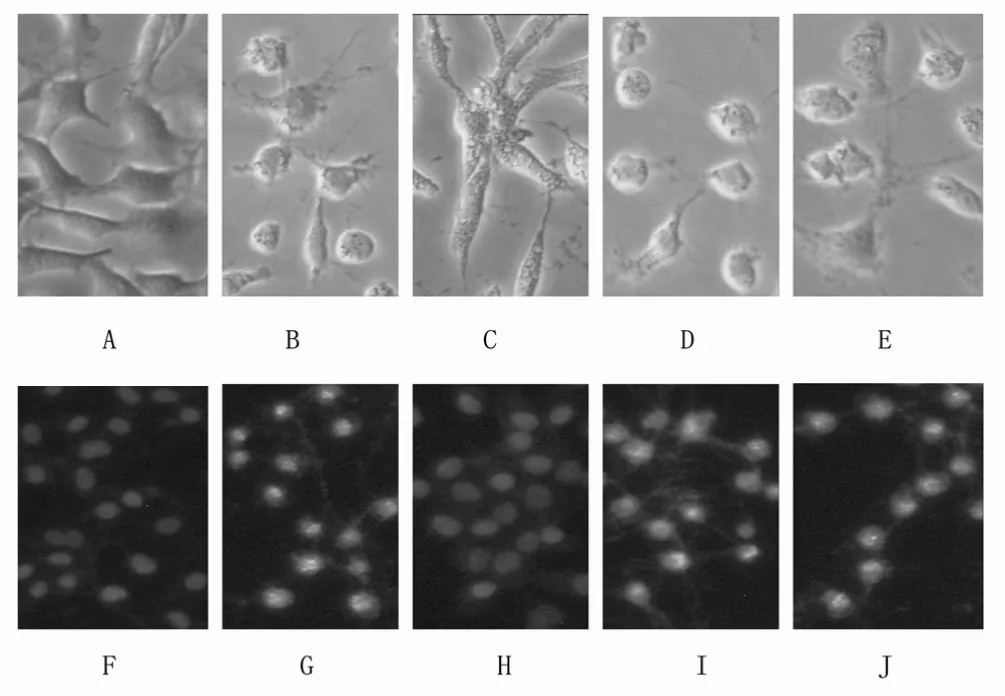
图1 10mg·mL-1干姜、大黄和丹参水提物对细胞凋亡形态学的影响(×400)
2.1 MTT法检测SH-SY5Y细胞存活率 如图2所示,与正常对照组相比,MPP+模型组存活率显著降低为(30.43±2.69)%(P<0.01)。MPP+和 5mg·mL-1干姜、大黄、丹参同时孵育后,存活率分别为(48.70±1.56)%、(20.10±2.97)%、(27.15±2.14)%,与模型组比较,干姜组保护作用明显(P<0.01),而大黄、丹参没有保护作用。当干姜、大黄、丹参的生药浓度为10mg·mL-1时,其存活率又分别为(54.70±2.40)%、(22.17±1.98)%、(29.20±1.15)%,与模型组比较,干姜组保护作用明显(P<0.01),而大黄、丹参组没有保护作用。以上数据表明,热性中药干姜对 MPP+诱导的 SH-SY5Y 细胞凋亡有明显的保护作用,而寒性中药大黄、丹参没有保护作用。

图2 5、10mg·mL-1干姜、大黄、丹参水提物对SH-SY5Y细胞存活率的影响
3.2 干姜、大黄、丹参水提物对 MPP+诱导 SH-SY5Y细胞凋亡的影响 流式细胞仪的检测结果表明:正常对照组 SH-SY5Y细胞的凋亡率为(1.87±1.14)% ,经0.5mmol·L-1MPP-1处理60h后,其凋亡率增加到(40.52±1.68)%,与正常组相比有显著性差异(P<0.01),5mg·mL-1和 10mg·mL-1干姜水提物能显著对抗细胞凋亡,凋亡率分别下降到(19.06±3.01)% 和(16.20±2.44)%(P<0.01 vs. model group)。而大黄和丹参水提物则对MPP+诱导的SH-SY5Y细胞凋亡无保护作用。10mg·mL-1干姜、大黄和丹参水提物对 MPP+诱导的SH-SY5Y细胞凋亡的影响见图3。

图3 10mg·mL-1干姜、大黄、丹参和Aβ25-35对SH-SY5Y细胞凋亡率的影响
4 讨论
前期研究发现,尽管不同药性的中药对神经系统退行性疾病(Aβ25-35、MPP+诱导SH-SY5Y的凋亡模型)的作用各不相同[1-6],但其抗凋亡作用却有相似的趋势,温性中药显示出明显的抗凋亡趋势。药性与细胞凋亡之间是否存在一定的关系,并能藉此区别中药的寒热属性,笔者为此开展了系列对比研究。本文选取来源、成分功效、药性均不相同的药物——干姜(热)、大黄(寒)和丹参(微寒),观察其对MPP+诱导的SH-SY5Y细胞凋亡的作用,开展其药性差异的对比性研究。MTT检测的结果显示,干姜水提物对 0.5mmol·L-1MPP+诱导的SH-SY5Y凋亡有显著的保护作用,并随着干姜水提物浓度的提高,保护作用增强,而大黄和丹参水提物组无保护作用;Hochest染色的结果显示,干姜水提物组能改变由MPP+诱导的细胞凋亡特性,呈现出低强度弥散均匀的蓝色荧光,使细胞核形态恢复至接近对照组的特征,而大黄组和丹参组无改变;流式细胞仪的结果进一步显示,干姜水提物能明显的对抗由MPP+诱导的细胞凋亡(P<0.01),而大黄组、丹参组没有保护作用。以上结果表明:热性药干姜对 MPP+诱导SH-SY5Y细胞凋亡有明显的抑制作用,对细胞的保护作用较强,而寒性药大黄和丹参则无此作用。以上研究结果与前期的研究结果一致[3-7],为以凋亡模型为基础,建立中药四性的凋亡学模式识别系统进一步奠定了实验基础。
[1]胡胜全,余惠旻.西洋参水提物对Aβ25-35诱导的SH-SY5Y细胞凋亡的保护作用[J].中药材,2008,1(9):1373-1377.
[2]Jeong-Ki Min, Kim JH, Cho YL, et al. 20(S)-Ginsenoside Rg3 prevents endothelial cell apoptosis via inhibition of a mitochondrial caspase pathway [J].Biochem Biophys Res Commun, 2006,349(3):987-994.
[3]王晶,余惠旻.红参水提物对Aβ25-35诱导SH-SY5Y 细胞凋亡的保护作用[J].华西药学杂志,2008,23(6):627-630.
[4]胡胜全,周红祖,余惠旻.基于细胞凋亡表达的生晒参、红参和西洋参四性研究展望[J].中草药,2008,39(6):801-804.
[5]余惠旻,周红祖.基于细胞凋亡表达的中药四性模式识别系统研究——红参、生晒参和西洋参抗AB25-35诱导SH-SY5Y细胞凋亡的药性学比较[J].中国药房,2009,20(24):1843-1844.
[6]余惠旻,周红祖.基于细胞凋亡表达的中药四性模式识别系统研究——西洋参和红参抗MPP+诱导SH-SY5Y细胞凋亡的药性学对比研究 [J].中国药房,2009,20(18):1367-1369.
[7]邱连建,周红祖,余惠旻.附子、黄芩和穿心莲水提物对 MPP+诱导的 SHSY5Y细胞凋亡的药性学对比研究[J].中国药房,2012,23(31):2888-2890.
