癌光啉在兔体内的药代动力学及生物利用度
2012-12-06郑立卿阴慧娟李迎新陈洪丽
郑立卿,阴慧娟,李迎新,陈洪丽
(1.中国医学科学院·北京协和医学院生物医学工程研究所激光医学实验室,天津 300192;2.河北北方学院药理学教研室,河北 张 家口 075000)
光动力疗法(photodynamic therapy,PDT)是20世纪70年代末问世而在近几年来迅速发展起来的一种针对(血管)增生性病变组织的选择性治疗新技术,已成为世界肿瘤防治科学中最活跃的研究领域之一[1-3]。光动力疗法是以光、光敏剂和氧的相互作用为基础的一种新的疾病治疗手段,光敏剂(光动力治疗药物)的研究是影响光动力治疗前景的关键所在。癌光啉(代号:PSD-007)是我国独立研制的一种新的卟啉类光敏剂。由血卟啉Ⅸ(HP)、3(8)-(1-甲氧乙基)-8(3)-(1-羟乙基)-次卟啉Ⅸ(MHD)、3(8)-0-乙酰基-8(3)-(1-羟乙基)-次卟啉Ⅸ(AHD)、3(8)-(1-羟乙基)-8(3)-乙酰基-次卟啉Ⅸ(HVD)、3,8-二(1-甲氧乙基)- 次卟啉 Ⅸ(DMD)、3,8-(1-甲氧乙基)-8(3)-乙酰基-次卟啉Ⅸ(MVD)和原卟啉Ⅸ(Pp)7种卟啉组成[4]。实验证明,PSD-007对人骨肉瘤MG-63细胞具有光动力杀伤效应[5],可诱导鼻炎癌细胞凋亡[6],治疗白血病[7]等。于1983年6月由总后勤部过渡临床试验,临床上癌光啉放射增敏治疗食管癌[8]。本实验采用荧光法研究兔血浆中PSD-007,首次研究了ip、iv两种给药途径的药代动力学特点,阐明癌光啉在动物体内的药代动力学规律,为药物进一步研究提供依据。
1 材料
1.1 动物 新西兰白兔,体质量(1.7±0.2)kg,♂,中国医学科学院放射所动物中心提供,给药前禁食12 h,自由饮水。
1.2 仪器 D-37520超速低温离心机(德国Heraeus公司),全波长多功能酶标仪(Thermo),XW-80型漩涡混合器。
1.3 药品和试剂 癌光啉(PSD-007)注射液,上海红绿光敏剂研究所有限公司提供;NaCl、NaOH分析纯(BBI),其他试剂均为分析纯,实验用水全部为三重蒸馏水。
2 方法与结果
2.1 荧光检测方法的建立 取癌光啉稀释到10 mg·L-1,于200 ~400 nm 紫外扫描,在395 nm 处有最大吸收峰。以395 nm为激发波长,于400~700 nm作荧光扫描,623 nm处有最大吸收。因此选取检测方法为激发波长395 nm,吸收波长623 nm。见Fig 1。
2.2 生物样品中癌光啉测定方法的确认
2.2.1 样品处理 血液经肝素抗凝,3 000 r·min-1离心15 min 后收集血浆,取 150 μl加入 2.4 ml 9%NaCl-1 mol·L-1HCl[9]充分混匀后震荡提取 30 min,3 000 r·min-1离心 15 min 后取上清 100 μl置96空板中,平行4个复孔,用5%NaOH稀释到线性范围。
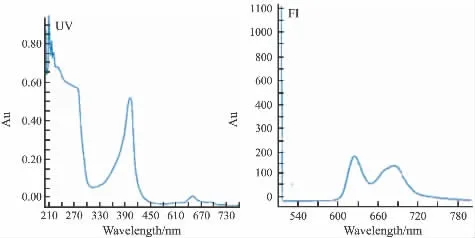
Fig 1 UV and fluorescence absorption spectrum of PSD-007
2.2.2 标准曲线的制备 取癌光啉注射液用PBS稀释到 100 mg·L-1,取 200 μl置 96 孔板,倍比稀释得到 100、50、25、12.5、6.25、3.13、1.56、0.78、0.39、0.20、0.10、0.05 mg·L-112 个系列浓度,3 个复孔,测定荧光值,结果癌光啉在浓度小于1.56 mg·L-1时,浓度与荧光值为线形关系,大于1.56 mg·L-1时,浓度与荧光值没有线形关系。同法稀释得到浓度为1.0、0.5、0.3、0.2、0.1 mg·L-15 个系列浓度癌光啉样品,按“3.2.1样品处理”以荧光值平均值对浓度进行回归,得到回归方程为Y=40.692X+2.4429(r=0.999 9,n=4;Y荧光值,X浓度 mg·L-1),标准曲线见Fig 2。最低定量限为0.05 mg·L-1。
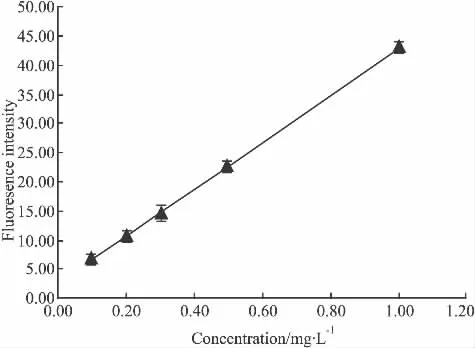
Fig 2Standard curve of PSD-007(±s,n=4)
2.3 药代动力学研究
2.3.1 腹腔给药 5只新西兰白兔ip 10 mg·kg-1癌光啉,于给药后的 10 min、30 min、1 h、2 h、4 h、8 h、24 h、48 h、72 h 耳缘静脉采血 1 ml,按“2.2.1 样品处理”制备血浆样品并测定药物含量,绘制药-时曲线,见Fig 3。

Fig 3 Average plasma concentration-time curve of rabbits after a single ip administration of 10 mg·kg-1PSD-007(±s,n=5)
Fig 3表明:ip癌光啉10 mg·kg-1后,药物吸收较快,吸收相短,消除相较长,消除较快,8 h前血浆药物浓度下降较快,8 h后血浆药物浓度下降较慢,48 h后仍可以检测到药物。在给药后50 h时血药浓度可降到0.2 mg·L-1以下。
用3P97软件对癌光啉在兔体内的血药浓度曲线分别按一室、二室、三室进行Marquard拟合,对3种模型利用F检验进行方差分析。当权重为1/C/C,r2=0.947 668 4,AIC=-2.943 897,符合一室模型。结果表明,癌光啉ip在家兔体内的动力学行为符合一级消除一室模型,药代动力学参数见Tab 1(A:经验常数;Ka:分布速度常数;Ke:消除速度常数:分布半衰期:消除半衰期;Vc,中央室表观分布容积;CL:清除率;AUC:血药浓度-时间曲线下面积。)
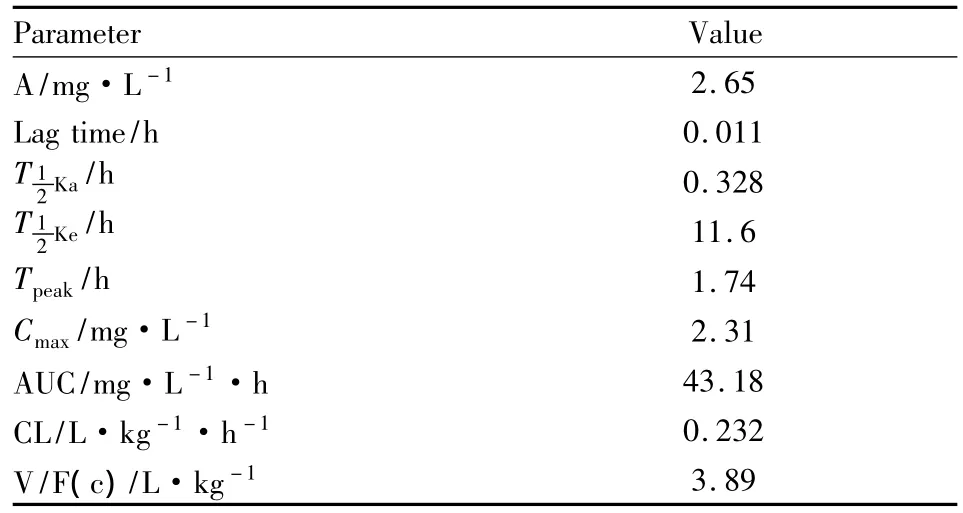
Tab 1 Pharmacokinetic parameters
2.3.2 静脉给药 白兔5只,iv癌光啉10 mg·kg-1,于给药后的 10 min、30 min、1 h、2 h、4 h、8 h、24 h、48 h、72 h 耳缘静脉采血 1 ml,肝素抗凝。测定血浆药物浓度,绘制药-时曲线,见Fig 4。药物体内消除缓慢,8 h前血浆药物浓度下降较快,8 h后血浆药物浓度下降较慢,72 h后仍可以检测到药物。
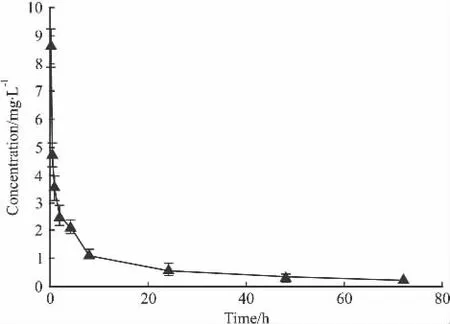
Fig 4 Average plasma concentration-time curve of rabbits after a single iv administration of 10 mg·kg-1PSD-007(±s,n=5)
iv给药后的平均血浆药物浓度-时间数据,代入3P97,根据AIC最小的原则,评价房室模型。计算药动学参数。按Marquardt计算方法,当权重为1/C/C,r2=0.999 747 3,AIC=-26.093 21,符合三室模型。药代动力学参数见Tab 2(P、A、B:经验常数;α:分布速度常数;β:消除速度常数:分布半衰期:消除半衰期;K12:中央室向浅外室的转运速度常数;K21:浅外室向中央室的转运速度常数;K13:中央室向深外室的转运速度常数;K31:深外室向中央室的转运速度常数;K10:中央室的消除速度常数)。
2.4 生物利用度 腹腔注射生物利用度关系式[10]如下

[AUC]IP,[AUC]IV是腹腔、静脉注射剂量曲线下的面积 , DIP、DIV是腹腔、静脉注射剂量。
由Tab 1,2计算腹腔注射血药浓度与时间的关系式[11]如下:
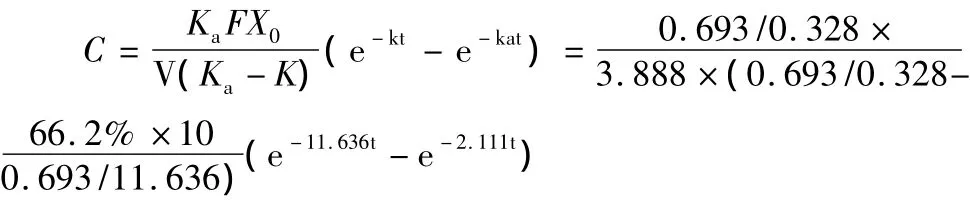
Ka、K:吸收、消除速度常数生物利用度;X0:给药剂量;C:浓度(mg·L-1);t:时间(h)。
静脉注射血药浓度与时间的关系式[12]如下:

3 讨论
灵敏度高特异性好的分析方法是药代动力学研究的基础,荧光检测方法灵敏度高,选择性高。癌光啉是混合卟啉制剂,多种成分有效,各成分均具有卟啉母环,荧光特性相似,因此,本研究采用酶标仪测定药物总的荧光特性来定量,在一定程度上可以检测癌光啉在体内的动态变化过程,最低定量限为0.05 mg·L-1,比分光光度法高2~4个数量级。本实验用盐酸盐缓冲液裂解血浆蛋白提取样品,可直接用于荧光检测,相比有机溶剂如乙腈、甲醇沉淀蛋白,操作简单并且可以避免有机溶剂的背景干扰。
本实验结果表明腹腔给药时,兔对癌光啉吸收较快,1.74 h达到峰浓度2.31 g·L-1,体内维持时间较长,消除半衰期11.63 h,体内药代动力学特征符合一室模型。静脉给药时,癌光啉消除半衰期达40.6 h,药动学特征符合三室模型,与文献报道一致[9],由第一分布相和第二分布相的药代动力学参数来看,癌光啉静脉注射后,在家兔体内迅速由中央室向周边室分布,同时浅外室向中央室的转运,且K12>K21>K13,该给药方式体内滞留时间长,应用时可减少给药次数或降低给药剂量。给药方式不同,体内的药动学特征符合不同模型与文献报道相似[14]。在分布相时药物实际上已开始消除,到达消除相时可能已有相当分量的药物已被消除。三室模型的前两相在腹腔注射时被吸收相掩盖。这些时相的划分仅靠血药浓度的测定。如果早期(此时血药浓度变化较快)取样间隔过疏,很难据此准确划分时相,此为房室模型法的局限。
Tab 2 Pharmacokinetic parameters(±s,n=5)

Tab 2 Pharmacokinetic parameters(±s,n=5)
Parameter Value P/mg·L-19.37 γ/h -1 4.03 A/mg·L -1 3.05 α/h-1 0.246 B/mg·L -1 0.860 β/h-1 0.017 Vc/L·kg-1 0.753 T 12α/h 2.82 T 12β/h 40.6 K12/h -1 2.28 K21/h -1 1.33 K13/h -1 0.417 K31/h -1 0.062 K10/h -1 0.204 AUC/mg·L -1·h 65.2 CL(s)L·kg-1·h-1 0.153 MRT/h 43.3
腹腔给药后绝对生物利用度是66.2%,表明吸收尚可。两种给药途径说明癌光啉吸收迅速,消除相较长,8 h前消除较快。ip给药体内清除速度相对iv较快,后者72 h仍可监测到微量的药物,建议给药后至少3 d才能2次给药,两种给药方式均不易积蓄,现开始用于治疗鲜红斑痣[13]、皮肤肿瘤、激光美容等领域,有望广泛应用于临床。考虑到药物在体内见光出现的光毒性现象,应选择消除方式更快的腹腔给药方式,但此给药方式需根据血药浓度调节给药剂量。腹腔注射经肠系膜静脉吸收,吸收迅速,肝代谢率低,因此进一步研究PSD-007的口服和肠靶向制剂是一个新药开发的新方向,也符合老药新用的药物开发新模式。
[1]Selman S H.Photodynamic therapy for prostate cancer:One urologist’s perspective[J].Photodiag Photodyn Ther,2007,4(1):26-30.
[2]Muller P J,Wilson B C.Photodynamic therapy of brain tumors-a work in progress[J].Lasers Surg Med,2006,38(5):384-9.
[3]Biel M.Ad vances in photodynamic therapy for the treatment of head and neck cancers[J].Lasers Surg Med,2006,38(5):349-55.
[4]陈文晖,许德余,殷祥生.新肿瘤光化学诊治剂(PSD-007)的化学组成的研究[J].现代应用药学,1993,10(6):12-4.
[4]Che W H,Xu D Y,Yin X S.Studies on determination of the chemical composition of the new tumor-photochemodiagnostic&photochemotherapeutic agent(PsD-007)[J].Chin J Mod Appl Pharm,1993,10(6):12-4.
[5]胡 硕,孙梦熊,蔡郑东.光敏剂癌光啉对小鼠骨肉瘤LM-8细胞体外光动力作用的实验研究[J].上海医学,2010,33(6):562-5.
[5]Hu S,Sun M X,Cai Z D.Photodynamic effect of PSD007 on mouse osteosarcoma cell line LM-Sinin vitro[J].Shanghai Med J,2010,33(6):562-5.
[6]王承龙,赖金平,王行炜.光动力作用诱导人鼻咽癌细胞凋亡超微结构形态改变[J].中华理疗杂志,2001,24(5):270-3.
[6]Wang C L,Lai J P,Wang X W,et al.Effect of photodynamic therapy on morphological changes of ultrastructure in human nasopharyngeal carcinoma cells apoptosis[J].Chin J Physical Ther,2001,24(5):270-3.
[7]楼方定,张伯龙,高春记.癌光啉体外净化骨髓中残留白血病变后行自体骨髓移植治疗白血病[J].军医进修学院学报,2000,21(1):11-3.
[7]Lou F D,Zhang B L,Gao C J,et al.Autologous bone marrow transplantation with purging of residual leukemic cells in bone marrow by PSD 007in vitro[J].Acad J PLA Postgrad Med School,2000,21(1):11-3.
[8]苏璧泓,林祥松,李云英,等.癌光啉放射增敏治疗食管癌的远期疗效观察[J].中华放射肿瘤学杂志,2000,9(1):26-8.
[8]Su B H,Lin X S,Li Y Y,et al.Radiotherapy combined with photosensitizer(PSD-007)for esophageal cancer[J].Chin J Radiat Oncol,2000,9(1):26-8.
[9]陈文晖,姚建鑫,沈卫镝,等.光动力治疗药血啉甲醚的药代动力学研究[J].中国激光医学杂志,2000,9(2):105-8.
[9]Chen W H,Yao J X,Shen W D,et al.Pharmacokinetic studies on hematoporphyrin monomethyl ether:A new promising drug for photodynamic therapy of tumors[J].Chin J Laser Med Surg,2000,9(2):105-8.
[10]粱文权主编.生物药剂学与药物动力学[M].第2版.北京:人民卫生出版社,2003:331.
[10]Liang W Q.Biopharmaceutics and Pharmacokinetics[M].2nd ed.Beijing:People’s Medical Publishing House(PMPH),2003:331.
[11]粱文权主编.生物药剂学与药物动力学[M].第2版.北京:人民卫生出版社,2003:186.
[11]Liang W Q.Biopharmaceutics and Pharmacokinetics[M].2nd ed.Beijing:People’s Medical Publishing House(PMPH),2003:186.
[12]粱文权主编.生物药剂学与药物动力学[M].第2版.北京:人民卫生出版社,2003:222.
[12]Liang W Q.Biopharmaceutics and Pharmacokinetics[M].2nd ed.Beijing:People’s Medical Publishing House(PMPH),2003:222.
[13]顾 瑛,李峻亨,王 开,等.血啉甲醚用于光动力疗法治疗鲜红斑痣的初步临床研究[J].中国激光医学杂志,1996,5:201-4.
[13]Gu Y,Li J T,Wang K,et al.Preliminary clinical observation of HMME in PDT for PWS[J].Chin J Laser Med Surg,1996,5:201-4.
[14]郑立卿,刘建华,张丹参,等.蛇床子素在大鼠体内的药动学和组织靶向性研究[J].中国药理学通报,2011,27(4):421-3.
[14]Zheng L Q,Liu J H,Zhang D S,et al.Study on pharmacokinetics and tissue targeting of osthol in rats[J].Chin Pharmacol Bull,2011,27(4):421-3.
