体外培养单个造血干细胞实验方法的建立
2012-12-06王金宏刘延风高瀛岱
李 乔,纪 庆,王金宏,许 静,田 晨,程 辉,刘延风,张 娜,程 涛,高瀛岱
(中国医学科学院血液病医院(血液学研究所)实验血液学国家重点实验室,天津 300020)
造血干细胞一直是成体干细胞研究中的热点。基于最近20年以来实验技术的发展,HSCs的发育分化过程、HSCs池的维持等方面已经有比较透彻的研究。关于造血干、祖细胞的传统研究方法主要是建立体内、体外的造血模型,已有的实验方法有:①将HSCs体内移植给受致死剂量照射的受体鼠(体内重建造血能力)[1]。该实验方法主要是观察研究HSCs在受体鼠体内归巢-自我更新-分化产生各系祖细胞-分化产生血液系统的整个造血过程;② 骨髓造血细胞的体外克隆性生长实验[2]。测定长期培养启动细胞(long-term culture initiating cells,LTC-IC)在体外基质细胞支持下形成鹅卵石样区域(CA)实验,即长周期HSCs体外培养实验,主要用于测定HSCs在体外有基质细胞支持的条件下自我更新的能力,所需时间8~12周;③ 通过计数BFU-E等各系分化集落[3],或通过血(细胞)涂片结合人工计数各系细胞比例,可以分析HSCs分化能力与分化水平。
可以看出,研究HSCs的关键就在于建立造血模型,并藉此研究HSCs的自我更新和分化能力。传统的实验方法主要局限于所需时间久,所需细胞量大,人为因素多(主观性强),工作量巨大。因此,当进行大规模化合物筛选时需要设计一种高通量、快速、准确、客观、重复性强的针对HSCs的药物筛选实验方法。本课题建立了一种体外无需基质细胞支持、高通量培养单个HSCs集落形成实验,培养10~14 d,观察化合物物对HSCs的作用,为后续的研究和药物筛选工作打下基础。
为了验证实验方法在筛选化合物时的可靠性,使用了一种小分子化合物(BIO,6-bromoindirubin-3'-oxime),据文献报道,BIO通过特异性抑制GSK-3(糖原合成酶激酶-3)的功能,进而激活Wnt信号通路,转录可以维持干细胞活性的转录因子[4],具有促进造血干细胞干性维持、增殖与扩增的作用[5]。我们采用第一部分中建立的培养单个HSCs的造血模型,验证该化合物是否可以促进HSCs的自我更新与增殖,从而验证实验方法在化合物筛选方面的可靠性。
1 材料
实验动物为 C57BL/6J小鼠(SPF级),♀,4~6周龄(CD34在8周龄以下小鼠中表达[6])购自中国医学科学院血液学研究所实验动物中心;免疫磁珠分选系统(MACS),购自美天尼公司;流式细胞术检测分析所需荧光素标记的单克隆抗体及其同型对照,均购自BD公司;重组细胞因子包括小鼠血小板生成素(murine thrombopoietin,mTPO 10 mg·L-1,400× )、小鼠白细胞介素 3(murine interleukin-3,mIL-3 10 mg·L-1,1 000× )、小鼠干细胞因子(murine stem cell factor,mSCF,10 mg·L-1,100× ),人促红细胞生成素(human erythropoietin,hEPO,50 000 μg·L-1,5 000× )均购于Peprotech公司,无血清培养基(Bit,5×)购于 Stem Cell公司,初生牛血清(NCS)购于Stem Cell公司,L-谷氨酰胺和2-巯基乙醇购于Millipore公司。
2 方法
2.1 小鼠骨髓采集与骨髓细胞悬液的制备 颈椎脱臼法处死小鼠,无菌条件下取其股骨、胫骨和髂骨,用1 ml注射器吸取培养基反复冲洗骨髓腔。将骨髓细胞悬液反复吹打,用300目的无菌滤网过滤成为单细胞悬液。
2.2 免疫磁珠富集 收集c-kit+细胞 (正筛选):带有ckit+抗体的磁珠吸附c-kit+细胞,当细胞混合液通过磁场时,被柱子吸附的是c-kit+细胞,具体操作步骤参照MACS操作手册。
2.3 单克隆抗体标记HSCs 收集免疫磁珠富集后得到的细胞混合液,用单克隆抗体(抗体均购买自BD公司)FITC-anti-CD34,PE-anti-Sca1,APC-anti-c-kit,PE-cy7-anti-Lin(包括PE-cy7-anti-B220、Ter119、Mac-1、CD3、Gr-1、CD4、CD8),标记60 min。
2.4 HSCs体外培养液的配制 普通培养液:含10%NCS的 HSCs培养基,各组分浓度为:mTPO 25 μg·L-1,mIL-3 10 μg·L-1,mSCF 100 μg·L-1和 hEPO 10 μg·L-1,并添加 L-谷氨酰胺(2 mmol·L-1),2-巯基乙醇(10 mmol·L-1),双抗(青霉素100 kU·L-1,链霉素100 mg·L-1)。
含小分子化合物的培养液:基本成分同普通培养液,根据培养液中是否加入药物分为两个组,实验组:3#化合物20 μmol·L-1(化合物用 DMSO 溶解,终浓度为 20 mmol·L-1,1 000×)组(3块96孔板,即3次重复);空白对照组(只加入相同量的 DMSO,3块96孔板,分别记为 con1,con2与con3)。
取96孔板,外圈36孔中加入 PBS,100 μl/孔,主要作用是提高湿度,降低培养液的蒸发,保证细胞生长所需湿度。中间6排(B~G)×10(B2~B11)孔加入上述配置好的培养液,100 μl/孔。
2.5 流式分选 先加100 μl/孔完全培养基于96孔板,用流式细胞分选仪(Influx,BD公司)分选标记好的细胞悬液,分选出表型为Sca1+c-kit+lin-CD34-的单个HSC接种于96孔板中,每孔1个细胞。
2.6 细胞培养 将分选接种好的HSC培养板置于孵箱中,37℃,5%CO2浓度,饱和湿度培养10 d,观察细胞生长情况。
2.7 细胞涂片与流式分析 在产生了阳性集落的孔中,挑选细胞数大于20 000的孔,每个孔平均分为两部分,其中一部分用甩片机甩片(5 min,500 r·min-1),制成血细胞涂片;晾干24 h后,用瑞士-吉姆萨染液染色0.5 h,洗去染液。显微镜100×观察,计数各系细胞比例(总共计数200个)。另一部分用:Percp-cy5.5-anti-GR-1,PE-anti-CD41,APC-cy7-anti-Mac-1,APC-anti-Ter119 抗体(各 0.5μl)混合液标记,流式检测不同血细胞的比例。
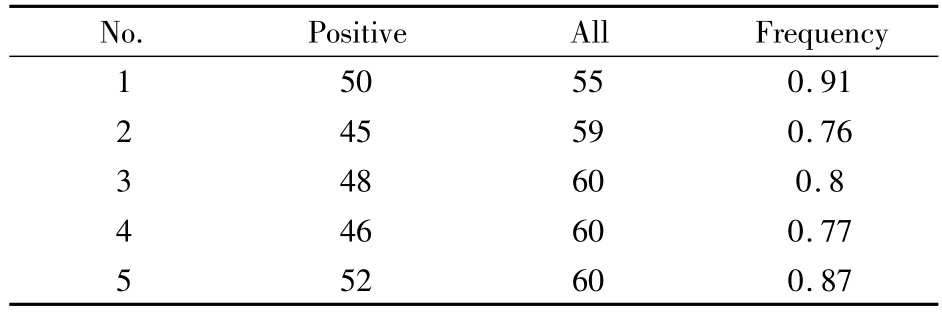
Tab 1 Colony frequency
3 结果
3.1 细胞、集落形态记录 培养10 d过程中对细胞进行观察,并随机选择某孔进行拍照,记录细胞、集落形态:从图像记录中可以看出,在3 d时,得到3~5个细胞,5 d时细胞数量达到几十个,到10 d时,形成大约数万个细胞组成的血细胞集落。见Fig 1。
3.2 集落形成频率 在一般培养条件下,统计每块96孔板中能够生长出克隆的阳性孔数量,并统计阳性率(集落形成频率)。
从Fig 1可以看出:每块96孔板(n=5)所能得到的阳性孔占全部有效孔(10 d后仍含有足量培养液的孔数)的比例(Tab 1)稳定在0.75~0.9之间。SD值<0.1,说明该实验可以较好的重复。

Fig 1 The image of blood cell colony A:3 d;B:5 d;C:10 d
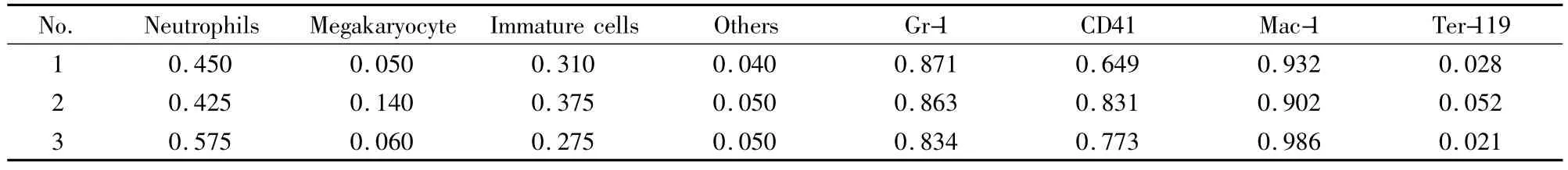
Tab 2 Proportion of cell type and proportion of surface marker expression
3.3 血细胞涂片结合流式细胞分析实验结果 血细胞涂片镜下观察计数。可以看到视野中有:中性粒细胞——特征为环状核、杆状核、分叶核,大约占0.4~0.5的比例;巨核细胞——特征为体积约是中性粒细胞的5~10倍,并可见云雾状血小板;未成熟细胞——特征为核偏于胞质一侧,胞核、胞质着色深。
将血细胞涂片计数所得各系细胞比例,与流式检测结果相对照,见Tab 2,表的左半部分是细胞涂片计数结果,右半部分是流式细胞分析表面标记的表达情况结果,两种方法对分化情况的反映结果相近,说明可以采用机器分析代替人工计数。
3.4 阳性化合物实验验证 以下是培养10 d后,通过每组3次重复实验的集落产生阳性率来确定药物是否有促进造血集落生成的作用。阳性率:每组计数得到的血细胞集落数/该组接种单个造血干细胞孔数。从阳性率结果统计可以看出,化合物的作用明显促进了单个HSCs形成造血集落的能力:相对空白对照组,加药组生成了更多的造血集落[见Fig 2,20 μmol·L-1组与对照组差异有显著性,P<0.01(t检验,单尾,齐方差)]。实验结果与前期体外、体内实验结果相同——化合物促进了HSCs的增殖和产生造血集落的能力。
每板随机抽取10孔进行流式分析,分化情况见Tab 3,表中列出部分结果。
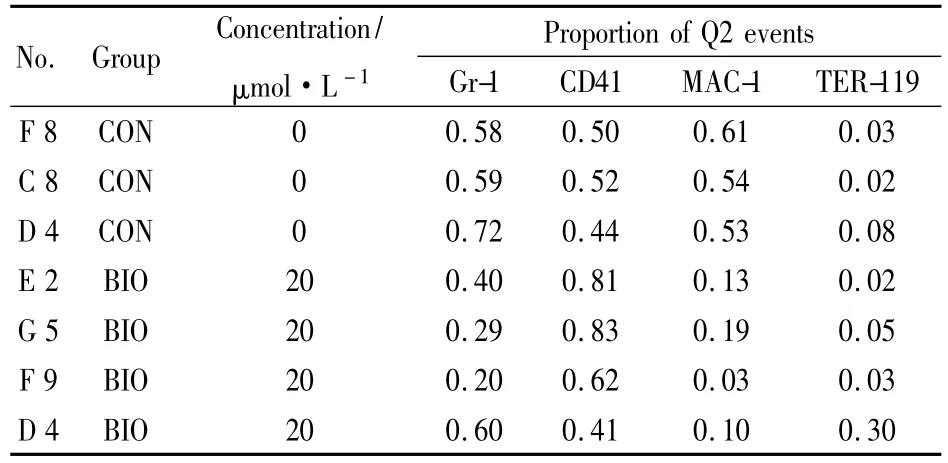
Tab 3 Proportion of surface marker expression
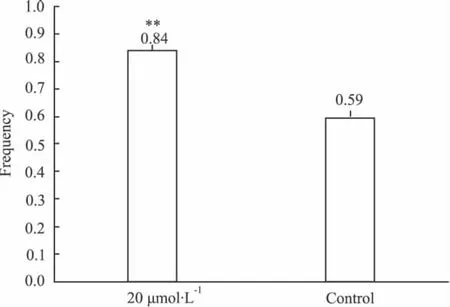
Fig 2 Frequency of experimental and control group**P<0.01 vs Control
从流式分析结果中可以看出,实验组与对照组之间无差异,加药组也无明显偏系分化,只是粒-单核系祖细胞(granulocyte mmacrophage progenitors,GMP)子代细胞与巨核-红系祖细胞(megakaryocyte erythroid progenitors,MEP)子代细胞间的比例有波动。
综合阳性率与流式分析实验结果来看,细胞培养时所加化合物起到了促进了HSCs的增殖作用,不会造成恶性增殖或偏系分化,与文献报道的该化合物对HSC的作用结果相同。该实验说明单个HSC培养实验在测定干细胞生长能力、分化能力时,能够一定程度地客观反映化合物对造血干细胞的作用,符合化合物筛选需求,可以应用于大规模的靶向HSC扩增的化合物筛选的需求。
4 讨论
本实验建立了一种体外稳定培养单个造血干细胞的实验方法,使单次实验阳性克隆生成率达到0.8以上,实现了可重复性强的效果。阳性率不能达1的原因主要有:①由于采用流式细胞仪进行细胞分选,虽然设定是每孔分选单个造血干细胞,但是由于机器分选可能存在的个别孔未加入细胞的情况;② 分选出的 Sca1+,c-kit+,Lin-,CD34-细胞目前认为属于长周期造血干细胞(LT-HSC),但文献表明,仅有40%的LT-HSC可以分化产生全部nmEM(粒细胞、单核细胞、红系细胞、巨核细胞)四系成熟细胞[7]。
另外,由于分选出的细胞所处细胞周期不同、细胞表面受体水平不同、接受信号刺激不同,导致细胞在生长分化过程中个体差异大,最终血细胞集落大小、分化情况差异明显。
综上,由于不可避免的系统误差导致分选出的细胞个体差异显著。可以采用更加精准的表面标记,筛选更纯的、分化阶段更原始的造血干细胞,如采用slam family marker系统等[9]。但是如果是进行化合物筛选实验时,则无需选用slam family marker,而应做到高通量筛选和多次重复(即分选多块96孔板),并进行科学统计来降低系统误差产生的影响。
本研究通过测定血细胞表面标记表达与血细胞涂片计数各系分化情况的结果相对比,可以得出两组数据间具有正相关性,采用流式分析代替人工计数,从而达到更客观、自动化水平更高的目的。
细胞涂片结果分析:由于培养时间较短,细胞分化水平比较低,不成熟细胞占据较大比例;分化的细胞基本都属于髓系细胞。成熟细胞中主要以中性粒细胞为主,巨核细胞占少量;也就是说GMP及其子代细胞占多数,MEP及其子代细胞占少数。
流式分析细胞表面标记:① Gr-1抗原在髓系细胞中表达[10],但是不会在淋系或红系细胞中表达;在骨髓或外周血中,anti-Gr-1主要可以标记成熟粒细胞。GR-1还可能在单核细胞发育过程中一过性表达。因此从流式分析结果可以看出,标记有Gr-1的细胞占据绝大多数,即HSCs主要分化为粒-单系细胞。② Mac-1(CD11b)在自然杀伤细胞(NK细胞)、中性粒细胞、单核细胞和巨噬细胞中高表达。因此表达Mac-1的细胞占据90%以上也说明了HSCs主要分化为粒-单系细胞。③CD41是由巨核细胞表达的,作用是促进血小板黏附和凝集;有报道称CD41也在造血祖细胞中表达。标记有CD41的细胞比例与巨核细胞加未成熟细胞总比例相近。结合以上3点:中性粒细胞表达Gr-1和Mac-1,巨核细胞主要表达CD41,未成熟细胞表达Gr-1、Mac-1和部分CD41。结合细胞涂片结果说明两种实验方法在反映细胞分化情况时结果吻合。
本研究使用一种可以促进HSCs扩增的化合物,通过阳性率鉴定,该化合物确实促进了HSCs的增殖,同时不会造成细胞偏系分化或过度增殖,与文献报道的结果一致,说明该实验方法在筛选促进HSCs扩增的化合物时具有很好的应用前景。
[1]Ford C E,Hamerton J L,Barnes D W,Loutit J F.Cytological identification of radiation-chimaeras[J].Nature,1956,177:452-4.
[2]Bradley T R,Metcalf D.The growth of mouse bone marrow cellsin vitro[J].Aust J Exp Biol Med Sci,1966,44:287-300.
[3]Suda T,Suda J,Ogawa M.Single cell origin of mouse hemopoietic colonies expressing multiple lineages in variable combinations[J].Proc Natl Acad Sci USA,1983,80:6689-93.
[4]Sato N,Meijer L,Skaltsounis L,et al.Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signalingby a pharmacological GSK-3-specific inhibitor[J].Nat Med,2004,10(1):55-63.
[5]Ko K H,Holmes T,Palladinetti P,et al.GSK-3β inhibition promotes engraftment of ex vivo-expanded hematopoietic stem cells and modulates gene expression[J].Stem Cells,2011,29(1):108-18.
[6]Matsuoka S,Ebihara Y,Xu M,et al.CD34 expression on longterm repopulating hematopoietic stem cells changes during developmental stages[H].Blood,2001,97:419-25.
[7]Takano H,Ema H,Sudo K,Nakauchi H.Asymmetric division and lineage commitment at the level of hematopoietic stem cells.inference from differentiation in daughter cell and granddaughter cell pairs[J].JEM,2004,199:3295-302
[8]Cheng T.Stem cell fate outcomes modulated by the CDK inhibitors[J].Cell Res,2008,18:s94.
[9]Takano H,Ema H,Sudo K,Nakauchi H.Asymmetric division and lineage commitment at the level of hematopoietic stem cells:inference from differentiation in daughter cell and granddaughter cell pairs[J].J Exp Med,2004,199(3):295-302.
[10]Yang L,Bryder D,Adolfsson J,et al.Identification of Lin(- )Sca1(+)c-kit(+)CD34(+)Flt3(-)short-term hematopoietic stem cells capable of rapidly reconstituting and rescuing myeloablated transplant recipients[J].Blood,2005,105:2717-23.
[11]Kim I,He S,Yilmaz O H,et al.Enhanced purification of fetal liver hematopoietic stem cells using SLAM family receptors[J].Blood,2006,108:737-44.
[12]Hestdal K,Ruscetti F W,Ihle J N,et al.Characterization and regulation of RB6-8C5 antigen expression on murine bone marrow cells[J].J Immunol,1991,147:22-8.
[13]秦 立,纪 庆,高瀛岱,等.新型CDK9小分子抑制剂的设计和发现[J].中国药理学通报,2005,25(10):1299-303.
[13]Qin L,Ji Q,Gao Y D,et al.Design and discovery of novel small molecule inhibitor of CDK9[J].Chin Pharmacol Bull,2005,25(10):1299-303.
